水稻鋅指蛋白基因CRISPR/Cas9突變體的構建及突變分析
易勇 鄭瑞 楊波 欒維江 郭嗣斌 沙愛華
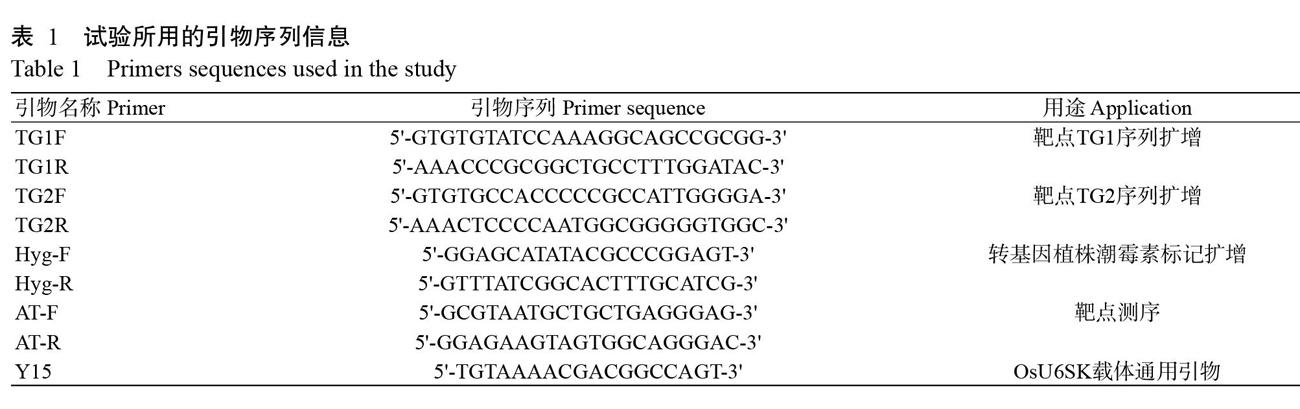

摘要:【目的】通過CRISPR/Cas9基因編輯技術對水稻鋅指蛋白基因(OsC3H54)進行基因編輯,篩選鑒定出其突變體植株,為深入研究OsC3H54的生物學功能提供良好材料,也為水稻鋅指蛋白研究提供參考依據。【方法】通過E-CRISP在OsC3H54基因的外顯子上設計靶點序列,將靶點序列連接至OsU6SK載體上,再與Cas9一起連接到pCAMBIA1300雙元載體上,獲得CRISPR/Cas9重組雙元載體,通過農桿菌介導將其轉入日本晴水稻愈傷組織,利用潮霉素進行抗性篩選,獲得突變體植株,并分析其靶點位置的堿基及編碼氨基酸突變情況。【結果】在OsC3H54基因第2個外顯子上找到2個符合靶點設計要求的靶點,分別為TG1:5'-CCGCCGCGGCTGCCTTTGGATAC-3'和TG2:5'-CCTTCCC CAATGGCGGGGGTGGC-3'。將OsU6SK載體和靶點序列正確連接的重組載體與Cas9一起連接至pCAMBIA1300雙載體上,成功獲得CRISPR/Cas9重組雙元載體(pCAMBIA1300-Cas9-TG1和pCAMBIA1300-Cas9-TG2)。通過農桿菌介導轉入日本晴水稻,經潮霉素抗性篩選獲得TG1靶點株系和TG2靶點株系,共16株CRISPR/Cas9突變體植株。CRISPR/Cas9突變體植株在靶點序列的突變位點位置附近出現套峰,表明2個株系的植株均發生堿基突變,其中Y1、Y2、Y3和Y4突變體植株均為單堿基插入突變,最終導致編碼的氨基酸發生移碼突變,蛋白翻譯提前終止。【結論】水稻OsC3H54基因CRISPR/Cas9突變體植株的獲得為進一步研究水稻鋅指蛋白生物學功能提供了良好材料。
關鍵詞: 水稻;鋅指蛋白;C3H54;CRISPR/Cas9;基因編輯;突變體植株;突變分析
中圖分類號: S511.035.3 ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2020)11-2607-07
CRISPR/Cas9 mutants construction of rice zinc finger protein gene and mutation analysis
YI Yong1, ZHENG Rui2, YANG Bo2, LUAN Wei-jiang2, GUO Si-bin3, SHA Ai-hua1*
(1College of Agriculture,Yangtze University/Hubei Collaborative Innovation Center for Industrialization of Major Grain Crops, Jingzhou, Hubei ?434025, China; 2College of Life Science,Tianjin Normal University, Tianjin ?300387, China;3Rice Research Institute, Guangxi Academy of Agricultural Sciences/Guangxi Key Laboratory
of Rice Genetics and Breeding, Nanning ?530007, China)
Abstract:【Objective】The rice zinc finger protein gene(OsC3H54) was genetically edited based on CRISPR/Cas9 gene editing technology, and the mutant plants were screened and identified, which would provide materials for in-depth study of the biological functions of OsC3H54 as well as reference for the research of rice zinc finger protein. 【Method】The target sequence was designed on the exon of rice OsC3H54 gene through E-CRISP, and the target sequence was liga-ted to the OsU6SK vector to obtain the target link vector. Then the target link vector together with Cas9 were integrated to pCAMBIA1300 to obtain the CRISPR/Cas9 recombination binary vector, which was then transformed into Nipponbare rice callus ?with Agrobacterium-mediated method. The positive transformed plants were screened out ? using hygromycin, and the mutated bases at the target site and encoded amino acids were analyzed. 【Result】Two targets were found on the second exon of OsC3H54, which met the target design requirements, named TG1:5'-CCGCCGCGGCTGCCTTTGG ATAC-3' and TG2: 5'-CCTTCCCCAATGGCGGGGGTGGC-3'. The OsU6SK vector and recombinant vector with correct target sequence and the empty Cas9 vector were ligated to the pCAMBIA1300 binary vector, and the CRISPR/Cas9 recombinant binary vector(pCAMBIA1300-Cas9-TG1 and pCAMBIA1300-Cas9-TG2) was successfully obtained. The CRISPR/Cas9 recombinant vectors were transferred to Nipponbare based on Agrobacterium-mediated method with hygromycin resistance for transforms screening. A total of 16 CRISPR/Cas9 mutant lines of TG1 and TG2 target were obtained. A set of peaks near the mutation site of the target sequence in the CRISPR/Cas9 mutant lines were detected, indicating that base mutations happened in two transformed lines. Among them,the Y1,Y2,Y3 and Y4 mutant lines were all single-base insertions mutations that led to premature termination of amino acid traanslation with frameshift mutations. 【Conclusion】The obtained CRISPR/Cas9 mutant plant of OsC3H54 provides good materials for biological functions studying of rice zinc finger protein.
Key words: rice; zinc finger protein; C3H54; CRISPR/Cas9; gene editing; mutant plants; mutation analysis
Foundation item:National Key Research and Development Program of China (2018YFD0301301-5-2); Guangxi Natural Science Foundation (2017GXNSFDA198039); Guangxi Key Laboratory of Rice Genetics and Breeding Open Pro-ject (No.160-380-16-1)
0 引言
【研究意義】水稻(Oryza sativa)是全球主要的糧食作物之一,世界上近一半人口以稻米為主食,其對我國農業的可持續發展也發揮著舉足輕重的作用(劉凱等,2019)。鋅指蛋白是一類通過與Zn2+結合形成短且穩定、能自我折疊成“手指”形狀結構域的蛋白,其結構域由3個半胱氨酸和1個組氨酸組成,在植物體內主要作為轉錄因子對基因表達發揮重要作用(劉丹等,2019)。該蛋白家族擁有眾多成員,主要調控植物生長發育。C3H54是鋅指蛋白家族的成員之一,克隆其編碼基因并構建基因編輯突變植株,對研究鋅指蛋白在水稻生長發育過程中的調控作用具有重要意義。【前人研究進展】鋅指蛋白最早在非洲爪蟾中發現(Miller et al.,1985)。根據鋅指結構功能及序列的不同,可將鋅指蛋白分成9種類型:C2H2、C2HC、C2HC5、C3H、C3HC4、C4、C4HC3、C6和C8(Berg and Shi,1996),其中C3H型鋅指蛋白的研究較少(劉小艷等,2015)。目前已有較多關于水稻鋅指蛋白的研究報道:OsDOS是第一個在水稻中發現的鋅指蛋白基因,其在水稻植株中過表達可延緩葉片衰老(Kong et al.,2006);通過水稻全基因組分析共發現67個C3H基因,通過構建系統發育進化樹可將其分為8個亞家族(Wang et al.,2008a);水稻OsLIC基因能負調控油菜素內酯合成,其過表達會影響植株的形態建成(Wang et al.,2008b);C3H12基因編碼的鋅指蛋白是一種核酸結合蛋白,可通過茉莉酸途徑正向調節水稻白葉枯病抗性(Deng et al.,2012);水稻OsTZF1基因過表達不僅可延緩水稻葉片衰老,還能阻滯水稻種子的萌發和生長(Jan et al.,2013);水稻Ehd4基因編碼一種新型鋅指蛋白,可調控植株光周期,進而影響開花,可導致長日照條件下植株不開花,短日照條件下植株可提前開花(Gao et al.,2013);水稻鋅指蛋白基因OsZFP1在水稻中過量表達可提高植株稻瘟病抗性(李賀等,2015);非典型的串聯鋅指蛋白IIP4不僅能與促進水稻次生壁生成的NAC29/NAC31上游調節因子相互作用抑制下游調節因子,從而抑制次生壁的形成, 還可調控植株的機械強度(Zhang et al.,2018a)。此外,目前已有較多其他植物鋅指蛋白的研究報道:橡膠樹HbCZF1是一種非典型且具有C-X7-C-X5-C3-HCCCH基序和RNA識別基序的鋅指蛋白,高度表達可激活hmg1基因的轉錄,參與天然橡膠的生物合成(Guo et al.,2015);擬南芥AtTZF5通過TZF基序與調控脫落酸(ABA)調節因子相互作用,在種子中高度表達并參與ABA信號轉導(Bogamuwa and Jang,2016);辣椒CaC3H14基因上調表達可增強植株對病菌的抗性(Qiu et al.,2018);在甘藍型油菜中C3H型轉錄因子BnZFP1與高油酸性狀相關,其過表達可使油酸含量提高18.8%(Zhang et al.,2018b);甘薯IbC3H18是一種非串聯的鋅指蛋白,可作為核酸轉錄激活因子,其過表達增強甘薯的耐鹽性和抗旱性(Zhang et al.,2019)。【本研究切入點】至今未見水稻C3H54鋅指蛋白的相關研究報道。【擬解決的關鍵問題】通過CRISPR/Cas9基因編輯技術對水稻C3H54基因(OsC3H54)進行基因編輯,獲得其穩定遺傳突變體株系,并分析其靶點位置的堿基及編碼的氨基酸突變情況,為深入研究OsC3H54的生物學功能提供良好材料,也為水稻鋅指蛋白研究提供參考依據。
1 材料與方法
1. 1 試驗材料
供試水稻品種為日本晴,由天津師范大學生命科學院提供。主要試劑:Bsa I酶購自紐英倫生物技術(北京)有限公司;質粒提取試劑盒購自天根生化科技(北京)有限公司,其他生化試劑購自武漢漢宇飛揚科技有限公司。主要儀器設備:SYSTEM GelDoc XR+IMAGELA-凝膠成像系統(Bio-Rad,美國)、T100TM Thermal Cycler PCR儀(Bio-Rad,美國)、Centrifuge 5430R離心機(Eppendorf,德國)和JY600C電泳儀(北京君意東方電泳設備有限公司)。
1. 2 靶點選擇
在E-CRISP輸入OsC3H54基因的編碼區序列(CDS),找到含有20個堿基的靶點序列GN19NGG,其中NGG是識別靶點序列的原初間隔序列毗鄰基序(Protospacer adjacent motif,PAM),N代表T、G、C或A,靶點序列位置必須設計在同一外顯子上。通過E-CRISP評估分析靶點序列的打靶效率,從而選出合適的靶點序列。最后,利用NCBI數據庫的BLAST對靶點進行特異性分析。
1. 3 CRISPR/Cas9重組雙元載體構建
具體操作:(1)根據引物互補性,分別利用靶點引物TG1F/TG1R和TG2F/TG2R(表1)通過引物低溫退火配對方式獲得靶點序列TG1和TG2的Oligo二聚體。PCR擴增程序:95 ℃ 3 min;0.1 ℃/s速率降至22 ℃。(2)用Bsa I酶切OsU6SK載體過夜,回收載體片段,將其分別與靶點序列TG1和TG2連接,轉化大腸桿菌DH5α感受態細胞。挑選單菌落,利用引物Y15(表1)和靶點序列下游引物(TG1R或TG2R)分別進行菌落PCR鑒定。PCR反應體系20.0 μL:10×Buffer 2.0 μL,Y15引物和靶點序列的下游引物各1.0 μL,5 U/μL Taq DNA聚合酶0.2 μL,2.5 mmol/L dNTP 1.5 μL,單克隆菌液1.0 μL,ddH2O補足至20.0 μL。擴增程序:94 ℃預變性4 min;94 ℃ 30 s;55 ℃ 30 s;72 ℃ 30 s,進行35個循環;72 ℃延伸7 min,12 ℃保存。挑選陽性單克隆菌株送至生工生物工程(上海)股份有限公司測序。將OsU6SK載體和靶點序列正確連接的重組載體與Cas9一起連接至pCAMBIA1300雙元載體上,轉化大腸桿菌DH5α感受態細胞,挑取單菌落,提取其質粒進行酶切鑒定,確保獲得正確的CRISPR/Cas9重組雙元載體(孔曉聰等,2019)。
1. 4 突變體植株的構建及分子鑒定
將構建的重組雙元載體轉化農桿菌后,通過農桿菌介導法侵染日本晴水稻愈傷組織,置于含潮霉素的培養基上培養,篩選出陽性愈傷組織,轉至分化培養基上培養,再轉至生根培養基上培養,最終獲得突變體植株。將突變體植株種植于試驗大田中,正常田間管理,待植株長大后收集幼嫩葉片,采用CTAB法提取其DNA,用潮霉素標記的特異引物Hyg-R和Hyg-F(表1)進行PCR鑒定,反應體系和擴增程序同1.3中的菌落PCR鑒定。
1. 5 突變體植株突變類型分析
根據OsC3H54基因序列設計能特異性檢測CRISPR/Cas9的引物(AT-F/AT-R),其中上游引物AT-F在靶點序列上游約250 bp處,下游引物AT-R在靶點序列下游約250 bp處(表1)。利用AT-F/AT-R進行PCR擴增,模板為1.4中提取的突變體植株葉片DNA,反應體系同1.3中的菌落PCR鑒定;擴增程序略有修改,即退火溫度和時間改為52 ℃和30 s,其余條件不變。PCR擴增產物經1%瓊脂糖凝膠電泳驗證后送至生工生物工程(上海)股份有限公司進行測序。測序結果用DNAMAN 6.0進行分析。
2 結果與分析
2. 1 靶點選擇結果
由圖1可知,OsC3H54基因含有7個內含子、8個外顯子。依據靶點設計原則,結合OsC3H54基因的結構特點,在該基因的第2個外顯子上找到符合要求的2個靶點。利用E-CRISP評估這2個靶點的打靶效率,再利用NCBI數據庫中的BLAST對靶點特異性進行分析,結果顯示這2個靶點的打靶效率和特異性均較好,可作為OsC3H54基因的編輯靶點,分別為TG1:5'-CCGCCGCGGCTGCCTTTGGATAC-3'和TG2:5'-CCTTCCCCAATGGCGGGGGTGGC-3'。
2. 2 CRISPR/Cas9重組雙元載體構建結果
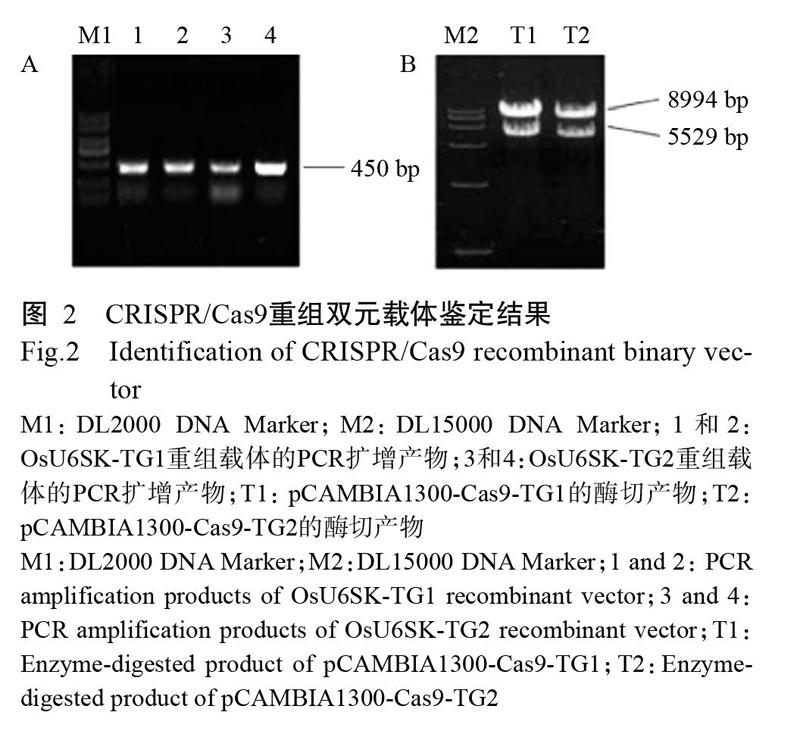
將靶點序列片段TG1和TG2分別與OsU6SK載體連接,然后轉化大腸桿菌DH5α感受態細胞,挑取單菌落利用引物Y15(表1)和靶點序列下游引物(TG1R和TG2R)進行PCR鑒定,PCR擴增產物用1%瓊脂糖凝膠電泳進行檢測,成功獲得2個含有靶點序列的重組載體(OsU6SK-TG1和OsU6SK-TG2),長度均450 bp(圖2-A)。將測序正確的重組載體與Cas9一起連接至pCAMBIA1300雙元載體上,并轉大腸桿菌DH5α感受態細胞,提取其質粒進行酶切鑒定,酶切產物用1%瓊脂糖凝膠電泳進行檢測,結果(圖2-B)顯示,酶切產物大小分別為8994和5529 bp,與預期結果相符,表明pCAMBIA1300雙元載體中已插入含靶點序列的重組載體和Cas9,成功獲得含TG1和TG2靶點序列的CRISPR/Cas9重組雙元載體(pCAMBIA1300-Cas9-TG1和pCAMBIA1300-Cas9-TG2)(圖3)。
2. 3 CRISPR/Cas9突變體植株分子鑒定結果
將CRISPR/Cas9重組雙元載體轉化農桿菌,挑取陽性菌侵染日本晴水稻愈傷組織,將侵染成功的愈傷組織置于含有潮霉素的培養基上進行抗性篩選,經分化培養和生根培養,最終獲得TG1靶點株系和TG2靶點株系,共16株CRISPR/Cas9突變體植株。利用潮霉素標記的特異引物Hyg-R和Hyg-F對其進行PCR鑒定,結果顯示,這些植株均為陽性突變體植株(圖4)。
2. 4 CRISPR/Cas9突變體植株OsC3H54基因堿基突變分析結果
采用CTAB法提取CRISPR/Cas9突變體植株DNA,以CRISPR/Cas9的引物(AT-F/AT-R)進行PCR擴增,PCR擴增產物測序結果顯示,CRISPR/Cas9突變體植株在靶點序列的突變位點位置附近出現套峰(圖5),表明2個株系的植株均發生突變。每個株系各挑2株突變體植株(Y1和Y2,Y3和Y4)用于分析OsC3H54基因堿基序突變情況,結果表明,Y1、Y2、Y3和Y4均為單堿基插入突變。
2. 5 CRISPR/Cas9突變體植株OsC3H54蛋白氨基酸突變分析結果
將4個突變體植株與野生型植株的OsC3H54蛋白氨基酸序列進行比對,結果發現4個突變體植株均出現移碼突變,最終導致氨基酸翻譯提前終止(圖6)。以Y2為例,由于PAM附近插入單堿基,導致序列在441 bp處提前產生終止密碼子,致使蛋白翻譯提前終止于第147位氨基酸。
3 討論
鋅指蛋白是一個龐大的蛋白家族,不同鋅指蛋白行使不同的功能,在植物抗病和非生物脅迫等方面具有重要作用。研究表明,鋅指蛋白不僅可與RNA結合發揮作用,還能與其他蛋白質結合發揮功能。擬南芥中鋅指蛋白可識別植株體內的RNA并與其結合調控植物的生長發育,其中HUA1是細胞核中的C3H型鋅指RNA結合蛋白,在植株生長發育過程中參與調控花的發育(Cheng et al.,2003)。鋅指蛋白也可與其他蛋白互作提高植株不同抗性,如棉花鋅指蛋白GhZFP1可與GZIRD21A和GZIPR5結合,提高轉基因煙草的耐鹽性和抗真菌性(Guo et al.,2009)。鋅指蛋白自身結構也能影響植物的生長發育,如鋅指蛋白Ⅶ亞家族中的KH結構蛋白KHZ1和KHZ2能延緩擬南芥葉片衰老,調控植株延遲開花(Yan et al.,2017)。
目前,有關C3H基因的研究發現,水稻OsC3H54基因和OsC3H51基因可能是緊密同源的重復基因(Wang et al.,2008b);擬南芥C3H基因可對多種環境刺激響應,其中AtC3H54基因在冷脅迫時下調表達(Wang et al.,2008a);擬南芥中過表達AtC3H49/AtTZF3和AtC3H20/AtTZF2基因可提高植株對ABA的敏感性,減少葉片蒸騰,進而增強耐旱性,同時延緩茉莉酸途徑介導的植株衰老過程(Lee et al.,2012)。C3H54作為鋅指蛋白家族中的重要成員,但有關其功能研究鮮見報道。本研究通過CRISPR/Cas9基因編輯技術對OsC3H54基因進行基因編輯,獲得其突變體植株,測序結果顯示其主要為單堿基插入突變,其中A或T是主要的插入堿基類型,與Zhang等(2014)研究結果相似。水稻OsC3H54基因CRISPR/Cas9突變體植株的獲得為進一步研究OsC3H54基因功能提供了良好材料。
4 結論
水稻OsC3H54基因CRISPR/Cas9突變體植株的獲得為進一步研究水稻鋅指蛋白的生物學功能提供了良好材料。
參考文獻:
孔曉聰,邳瑞雪,石雨鷺,王荃,靳亞軍,梁閃閃,張泗舉,欒維江. 2019. 基于CRISPR/Cas9技術的水稻OsDUF1475突變體的創建與分析[J]. 農業生物技術學報,27(3):17-25. [Kong X C,Pi R X,Shi Y L,Wang Q,Jin Y J,Liang S S,Zhang S J,Luan W J. 2019. Obtainment and characteri-zation of rice(Oryza sativa) OsDUF1475 mutants based on CRISPR/Cas9 technique[J]. Journal of Agricultural Biotechnology,27(3):17-25.]
李賀,韓藝娟,林藝娟,劉麗華,張承康,張連虎,王宗華,魯國東. 2015. 水稻鋅指蛋白基因OsZFP1的功能分析[J]. 中國水稻科學,29(2):135-140. [Li H,Han Y J,Lin Y J,Liu L H,Zhang C K,Zhang L H,Wang Z H,Lu G D. 2015. Functional analysis of zinc finger protein gene OsZFP1 in rice[J]. China Rice Science,29(2):135-140.]
劉丹,李然紅,陳鑫,王立鳳. 2019. 狗棗獼猴桃AkSAP蛋白的生物信息學分析[J]. 河南農業科學,48(12):103-108. [Liu D,Li R H,Chen X,Wang L F. 2019. Bioinformatics analysis of AkSAP protein from Actinidia kolomikta[J]. Journal of Henan Agricultural Sciences,48(12):103-108.]
劉凱,嚴國紅,張桂云,孫明法. 2019. 水稻滯綠突變分子遺傳研究進展[J]. 江蘇農業學報,35(2):484-488. [Liu K,Yan G H,Zhang G Y,Sun M F. 2019. Advances in molecular genetics of rice stay green mutation[J]. Jiangsu Journal of Agricultural Sciences,35(2):484-488.]
劉小艷,孫艷俠,王亞男,劉曉楠,劉坤,郗冬梅. 2015. 水稻CCCH型鋅指蛋白亞家族Ⅰ基因的表達分析[J]. 山東農業科學,(2):7-11. [Liu X Y,Sun Y X,Wang Y N,Liu X N,Liu K,Xi D M. 2015. Expression analysis of CCCH-zinc finger protein subfamily Ⅰ genes in rice[J]. Shandong Agricultural Sciences,(2):7-11.]
Berg J M,Shi Y G. 1996. The galvanization of biology:A growing appreciation for the roles of zinc[J]. Science,271(5252):1081-1085.
Bogamuwa S,Jang J C. 2016. Plant tandem CCCH zinc finger proteins interact with ABA,drought,and stress response regulators in processing-bodies and stress granules[J]. PLoS One,11(3):e0151574.
Cheng Y L,Kato N,Wang W M,Li J J,Chen X M. 2003. Two RNA binding proteins,HEN4 and HUA1,act in the processing of AGAMOUS pre-mRNA in Arabidopsis tha-liana[J]. Developmental Cell,4(1):53-66.
Deng H Q,Liu H B,Li X H,Xiao J H,Wang S P. 2012. A CCCH-type zinc finger nucleic acid-binding protein quantitatively confers resistance against rice bacterial blight disease[J]. Plant Physiology,158(2):876-889.
Gao H,Zheng X M,Fei G L,Chen J,Jin M N,Ren Y L,Wu W X,Zhou K N,Sheng P K,Zhou F,Jiang L,Wang J,Zhang X,Guo X P,Wang J L,Cheng Z J,Wu C Y,Wang H Y,Wan J M. 2013. Ehd4 encodes a novel and oryza-genus-specific regulator of photoperiodic flowering in rice[J]. PLoS Genetics,9(2):e1003281.
Guo D,Yi H Y,Li H L,Liu C,Yang Z P,Peng S Q. 2015. Molecular characterization of HbCZF1,a Hevea brasiliensis CCCH-type zinc finger protein that regulates hmg1[J]. Plant Cell Reports,34(9):1569-1578.
Guo Y H,Yu Y P,Wang D,Wu C A,Yang G D,Huang J G,Zheng C C. 2009. GhZFP1,a novel CCCH-type zinc finger protein from cotton,enhances salt stress tolerance and fungal disease resistance in transgenic tobacco by interacting with GZIRD21A and GZIPR5[J]. New Phytologist,183(1):62-75.
Jan A,Maruyama K,Todaka D,Kidokoro S,Abo M,Yoshimura E,Shinozaki K,Nakashima K,Yamaguchi-Shinozaki K. 2013. OsTZF1,a CCCH-tandem zinc finger protein,confers delayed senescence and stress tolerance in rice by regulating stress-related genes[J]. Plant Physiology,161(3):1202-1216.
Kong Z S,Li M N,Yang W Q,Xu W Y,Xue Y B. 2006. A novel nuclear-localized CCCH-type zinc finger protein,OsDOS,is involved in delaying leaf senescence in rice[J]. Plant Physiology,141(4):1376-1388.
Lee S J,Jung H J,Kang H,Kim S Y. 2012. Arabidopsis zinc finger proteins AtC3H49/AtTZF3 and AtC3H20/AtTZF2 are involved in ABA and JA responses[J]. Plant and Cell Physiology,53(4):673-686.
Miller J,Mclachlan A D,Klug A. 1985. Repetitive zinc-bin-ding domains in the protein transcription factor IIIA from Xenopus oocytes[J]. The EMBO Journal,4(6):1609-1614.
Qiu A L,Lei Y F,Yang S,Wu J,Li J Z,Bao B J,Cai Y T,Wang S,Lin J H,Wang Y Z,Shen L,Cai J S,Guan D Y,He S L. 2018. CaC3H14 encoding a tandem CCCH zinc finger protein is directly targeted by CaWRKY40 and positively regulates the response of pepper to inoculation by Ralstonia solanacearum[J]. Molecular Plant Pathology,19(10):2221-2235.
Wang D,Guo Y H,Wu C A ,Yang G D,Li Y Y,Zheng C C. 2008a. Genome-wide analysis of CCCH zinc finger family in Arabidopsis and rice[J]. BMC Genomics,9(1):44.
Wang L,Xu Y Y,Zhang C,Ma Q B,Joo S H,Seong-Ki K,Xu Z H,Chong K. 2008b. OsLIC,a novel CCCH-type zinc finger protein with transcription activation,mediates rice architecture via brassinosteroids signaling[J]. PLoS One,3(10):e3521.
Yan Z Y,Jia J H,Yan X Y,Shi H Y,Han Y Z. 2017. Arabidopsis KHZ1 and KHZ2,two novel non-tandem CCCH zinc-finger and K-homolog domain proteins,have redundant roles in the regulation of flowering and senescence[J]. Plant Molecular Biology,95(6):1-17.
Zhang D M,Xu Z P,Cao S X,Chen K L,Li S C,Liu X L,Gao C X,Zhang B C,Zhou Y H. 2018a. An uncanonical CCCH-tandem zinc-finger protein represses secondary wall synthesis and controls mechanical strength in rice[J]. Molecular Plant,11(1):163-174.
Zhang H Q,Zhang Z Q,Xiong T,Xiong X H,Wu X M,Guan C Y,Xiao G. 2018b. The CCCH-type transcription factor BnZFP1 is a positive regulator to control oleic acid levels through the expression of diacylglycerol O-acyltransferase 1 gene in Brassica napus[J]. Plant Physiology and Biochemistry,132:633-640.
Zhang H,Gao X R,Zhi Y H,Li X,Zhang Q,Niu J B,Wang J,Zhai H,Zhao N,Li J G,Liu Q C,He S Z. 2019. A non-tandem CCCH-type zinc-finger protein,IbC3H18,functions as a nuclear transcriptional activator and enhances abiotic stress tolerance in sweet potato[J]. New Phytologist,223(4):1918-1936.
Zhang H,Zhang J S,Wei P L,Zhang B T,Gou F,Feng Z Y,Mao Y F,Yang L,Zhang H,Xu N F,Zhu J K. 2014. The CRISPR/Cas9 system produces specific and homozygous targeted gene editing in rice in one generation[J]. Plant Biotechnology Journal,12(6):797-807.
(責任編輯 陳 燕)
收稿日期:2020-01-20
基金項目:國家重點研發計劃項目(2018YFD0301301-5-2);廣西自然科學基金項目(2017GXNSFDA198039);廣西水稻遺傳育種重點實驗室開放基金項目(160-380-16-1)
作者簡介:*為通訊作者,沙愛華(1973-),博士,教授,主要從事植物分子生物學及作物育種研究工作,E-mail:aihuasha@163.com。易勇(1995-),研究方向為植物分子育種,E-mail:yy1111666 @163.com

