異源表達芥菜BjMATE增強紫花苜蓿耐酸鋁脅迫的機理
李小冬,尚以順,李世歌,陳光吉,裴成江,孫方,熊先勤
異源表達芥菜增強紫花苜蓿耐酸鋁脅迫的機理
李小冬1,2,尚以順1,李世歌1,2,陳光吉1,2,裴成江1,2,孫方1,熊先勤1
(1貴州省農業科學院草業研究所,貴陽 550006;2貴州鼎芯農牧科技有限公司,貴陽 550006)
【】酸鋁脅迫是南方農業生產面臨的主要環境脅迫之一。研究鄉土植物對酸鋁脅迫的適應機理,發掘并利用優良基因培育抗酸耐鋁作物新品種,從而為紫花苜蓿分子遺傳改良奠定基礎。貴州省草業研究所紫花苜蓿遺傳改良組前期已從貴州鄉土資源平壩苦油菜中克隆獲得,并將其構建過量表達載體。采用組織培養和花器官浸泡法分別對紫花苜蓿和擬南芥進行遺傳轉化,根據NPT抗性基因和特異基因設計引物對轉化材料進行分子鑒定,并采用qRT-PCR進行表達量的鑒定。利用水培法平行比較轉基因和對照紫花苜蓿在酸、鋁和酸鋁組合脅迫條件下的發芽率、幼苗生長狀況,以及在長時間弱酸鋁脅迫條件下的幼苗地上和地下部分的生長變化。采用酶標儀檢測酸、鋁以及酸鋁組合脅迫條件下轉基因和對照紫花苜蓿根系中POD、SOD、CAT等抗氧化酶的活性和MDA含量的變化,同時在過表達的擬南芥中采用qRT-PCR的方法分析酸鋁代謝途徑的關鍵基因、、、和在脅迫條件下的表達變化,并對其調控關系進行討論。過量表達的擬南芥和紫花苜蓿的陽性率分別為100%與66.7%,候選紫花苜蓿和擬南芥轉基因株系中的表達量分別比對照上調63.02和76.87倍。過量表達紫花苜蓿株系和對照中苜1號紫花苜蓿的發芽率在正常、酸脅迫、鋁脅迫和酸鋁組合脅迫條件下都沒有顯著差別,但是其發芽勢在脅迫條件下顯著優于對照中苜1號。在長時間弱脅迫條件下,的株高與對照沒有顯著區別,但在鋁離子脅迫和酸鋁組合脅迫條件下,其的生物產量和根系伸長顯著優于對照中苜1號。抗氧化酶活性和MDA含量在與中苜1號中的變化不盡相同。POD和SOD的活性在脅迫處理后的2個材料中都顯著上升,但只有SOD的活性在2材料間差異顯著。CAT的活性在處理間和材料間都沒有顯著的差異。MDA的含量略有下降,在鋁離子和酸鋁組合脅迫條件下的2個材料中差異達顯著水平。qRT-PCR顯示,在植株中,、、、和受鋁和酸鋁組合脅迫誘導,但只有在與野生型之間差異顯著。能夠正向調節紫花苜蓿在種子萌發和幼苗生長階段對酸鋁脅迫的耐受性。活性氧清除系統尤其是SOD以及酸鋁代謝途徑關鍵基因可能參與介導的酸鋁脅迫調節。
酸鋁脅迫;;紫花苜蓿;基因表達調控
0 引言
【研究意義】南方酸性土壤氮磷等養分缺乏、離子不平衡和活性鋁含量較高等特點,是限制農作物生長的主要非生物逆境脅迫因素之一[1]。紫花苜蓿作為“飼草之王”在貴州地區適應性較差,是草畜產業發展的主要限制性因素之一。同時,由于貴州地區生態氣候的多樣性,孕育了豐富的植物種質資源,其中,有許多資源能夠適應當地的酸鋁土壤環境。研究并開發利用地方種質資源的功能基因,對酸鋁脅迫敏感農作物品種進行遺傳改良以培育南方適應性強的作物品種(如紫花苜蓿等)有一定的指導意義。【前人研究進展】酸鋁脅迫對植物生長發育的抑制作用在多個植物中被報道,分別涉及植物形態、生理和基因表達等多個不同方面。酸鋁脅迫早期直接的性狀是抑制植物根系伸長,根部的根冠、分生組織、伸長區細胞、根毛和分枝形成點等細胞受鋁離子毒害最嚴重[2]。鋁離子通過靶定到細胞表面的結合位點,導致細胞壁、細胞膜和信號轉導等細胞結構和功能紊亂[3]。目前,已報道鋁離子主要通過3條途徑對根系產生毒害,首先是增強鐵離子介導的膜脂氧化導致細胞膜完整性下降;其次是通過擾亂線粒體正常功能導致活性氧類物質含量增加;再次是上調液泡加工酶的活性,導致液泡解體進而影響膜脂的完整性[4]。相關結果在動物細胞中也有類似的報道,在鋁離子敏感細胞系PC12中外源施加甘草酸能通過增強線粒體基因的表達,增加細胞內抗氧化酶活性,緩解了鋁離子對細胞膜的毒害作用[5]。植物細胞周期也受鋁離子毒害的影響。JASKOWIAK等[6]研究表明在大麥()中,鋁離子毒害能夠顯著抑制根尖細胞的有絲分裂活性,并伴隨有微核和損傷的核出現,鋁離子對細胞周期的傷害主要集中在S期和G2/M期。ZHANG等[7]研究表明在擬南芥()中,鋁離子對植物根系伸長的抑制作用依賴于細胞周期調控基因和等基因介導的調控途徑。另外,還發現多種方法可以緩解鋁離子的毒害作用。RIAZ等[8]研究表明外源施加硼元素能夠通過調節抗氧化酶活性、脯氨酸含量、次生代謝物等緩解酸鋁脅迫對枸橘()的毒害作用。TENG等[9]在2個對鋁離子耐受能力不同的桉樹()無性克隆系中,通過施加磷肥能夠減少鋁離子的毒害作用,磷元素主要通過將有害的鋁離子固定在植物的根部,以及增加植物根系向土壤分泌有機酸的量來緩解鋁離子對植物的傷害,在耐受性強的無性系植株中鋁離子在根系中富集,不向葉片中轉運,而鋁離子敏感的植株中呈現相反的趨勢。ZHU等[10]通過外源施加硫化氫能夠顯著緩解鋁離子對水稻()根系的傷害,通過增加根系檸檬酸的分泌量以及減少根系細胞壁中的果膠和半纖維素的含量,增強植物對酸鋁脅迫耐受性,此外,超氧化物歧化酶(superoxide dismutase,SOD)、抗壞血酸過氧化物酶(ascorbate peroxidase,APX)、過氧化氫酶(catalase,CAT)和過氧化物酶(peroxidase,POD)的活性增加,苯二醛(malondialdehyde,MDA)和H2O2的含量減低。通過突變體等多種技術手段,許多鋁離子毒害的調控基因已被發現。細胞壁是保護植物細胞的第一道屏障,在緩解鋁離子毒害中起十分重要的作用,水稻OsSTAR1/OsSTAR2蛋白復合體能夠向細胞壁中分泌尿苷二磷酸葡萄糖,改變細胞壁的組成,減弱鋁離子對細胞的毒害作用[11]。細胞膜上有許多離子轉運蛋白和水通道蛋白,在調節鋁離子毒害過程中起至關重要的作用,最著名的是Al-activated malate transporter(ALMT)家族和multidrug and toxic compound extrusion(MATE)家族基因[12-13],它們通過分泌有機酸將活性鋁離子熬合成無毒的復合物阻止鋁離子進入細胞[14],除了這兩個轉運蛋白家族外,NRAMs[15]、ABC轉運蛋白[11]和水通道蛋白[16]也參與鋁離子毒害的調節過程。【本研究切入點】在這些膜蛋白中,MATE家族基因在高粱()[13]、大麥[12]、擬南芥[17]、水稻[18]多個植物物種的功能高度保守,參與鋁離子毒害的調控過程。然而在芥菜中的功能還沒有報道。【擬解決的關鍵問題】本研究擬通過轉基因技術將鄉土資源中的重要功能基因轉化到生產上亟需的牧草品種紫花苜蓿中,比較轉基因植株在正常、酸脅迫、鋁離子脅迫和酸鋁組合脅迫條件下的表型、生理生化以及基因調控網絡分析,對功能進行了鑒定與研究,為進一步剖析家族基因在酸鋁脅迫下的分子作用機制提供有價值的參考,并為紫花苜蓿分子遺傳改良及轉基因新品種的培育提供重要的候選功能基因。
1 材料與方法
1.1 材料
芥菜型油菜種質資源平壩苦油菜(Pingba bitter rape)是由貴州省農業科學院油料研究所饒勇饋贈。紫花苜蓿品種中苜1號(Zhongmu 1#)由中國農業科學院北京畜牧獸醫研究所高洪文團隊饋贈,哥倫比亞型野生型擬南芥(Col-0)從ABRC購買。所有植物都在人工氣候室中培養,其生長條件參考Li等[19]方法,具體參數如下:溫度為22℃,濕度為60%,光照強度為230—300 μE·m-2·s-1,光周期為16 h光照/8 h黑暗,試驗于2015—2018年在貴州省草業研究所完成。
1.2 紫花苜蓿和擬南芥的遺傳轉化
將貴州省草業研究所紫花苜蓿遺傳改良項目組前期構建的過量表達載體分別通過組織培養和花器官浸泡法轉化到紫花苜蓿和擬南芥中。
采用農桿菌介導轉化愈傷組織的方法轉化紫花苜蓿,用酒精和市售84對紫花苜蓿中苜1號種子各消毒1 min,并用無菌水清洗3—4次;在光照培養箱中培養15—20 d,將新生葉片切成2—4 mm2的小塊備用;用MS液體培養基+30%蔗糖+100 μmol·L-1AS懸浮農桿菌細胞,然后侵染外植體10—30 min,共培養2—3 d(MS+2 mmol·L-1TDZ+1 mmol·L-16BA);在分化培養基(MS+2 mmol·L-1TDZ+1 mmol·L-16BA+50 mg·L-1Km+150 mg·L-1Cr)中培養30—45 d,每10—15 d繼代一次,挑出心形胚和魚雷形胚到分化培養基(MS + 2 mmol·L-1KT + 1 mmol·L-1IAA + 50 mg·L-1Km + 150 mg·L-1Cr)至分化成苗,每10—15 d繼代一次;將再生植株移栽到生根培養基(MS + 1 mmol·L-1NAA + 50 mg·L-1Km + 150 mg·L-1Cr)進行生根培養。將長成的苜蓿幼苗移栽到營養土中煉苗7—10 d后,移栽隔離棚。
參考李小冬等[20]方法轉化擬南芥。
1.3 轉基因紫花苜蓿和轉基因擬南芥的基因組水平鑒定
分別采用CTAB法和Edwards DNA快速提取法提取紫花苜蓿和擬南芥的DNA[21]。利用PCR法分別對插入片段的位點和+R引物組合進行轉基因植物的分子檢測(表1)。PCR反應體系為2×Taq PCR Mixture(生物工程(上海)股份有限公司)10 μL、正向引物(10 mmol·L-1)1 μL、反向引物(10 mmol·L-1)1 μL、dd H2O 6μL和DNA 2 μL。反應程序為94℃ 3 min;94℃ 30 s,58℃ 45 s,72℃ 1 min 30 s,30 cycles;72℃ 5 min。1%瓊脂糖凝膠電泳檢測。
1.4 RNA提取與反轉錄
分別取100 mg轉基因紫花苜蓿和轉基因擬南芥生長7 d的幼苗(包括根),采用TRIZOLTMKit RNA提取試劑(Invitrogen,USA)參照說明書提取植物總RNA[21],根據MBI公司的RevertAid H Minus First Strand cDNA Synthesis Kit(Fermentas)反轉錄cDNA第一鏈合成試劑盒說明書進行反轉錄試驗。采用qRT-PCR方法分析轉基因紫花苜蓿和轉基因擬南芥中的表達量。反應體系為2×SYBR Green Realtime PCR Master Mix plus(TOYUBO,QPK-212)、正向引物(10 mmol·L-1)1 μL、反向引物(10 mmol·L-1)1 μL、10倍稀釋的cDNA模板2 μL和ddH2O 6 μL。反應程序為94℃ 2 min;94℃ 15 s,58℃ 15 s,72℃ 30 s,45個循環;72℃ 5 min,25℃ 5 min。采用2-ΔΔct方法分析的表達情況,每個樣品3個生物學重復,每個生物學重復3個技術重復。內參基因為(擬南芥)和(紫花苜蓿)。
1.5 酸鋁脅迫處理及表型觀察
采用水培法進行酸鋁脅迫處理。
發芽試驗:挑選大小一致的轉基因紫花苜蓿和對照中苜1號種子,分成4組,每組30粒,對照組用正常Hoagland全營養培養液(1.25 mmol·L-1KNO3、1.25 mmol·L-1Ca(NO3)2·4H2O、0.5 mmol·L-1MgSO4·7H2O、0.25 mmol·L-1KH2(PO4)、11.6 μmol·L-1H3BO3、4.6 μmol·L-1MnCl2·4H2O、0.19 μmol·L-1ZnSO4·7H2O、0.12 μmol·L-1Na2MoO4·2H2O、0.08 μmol·L-1CuSO4·5H2O和10 μmol·L-1Fe(III)-EDTA,NaOH調pH7.0)培養。酸處理組為Hoagland全營養培養液,且HCl調pH4.5。鋁處理組為Hoagland全營養培養液,且加入100 mg·L-1的硝酸鋁,用NaOH調pH7.0。酸鋁組合處理為Hoagland全營養培養液,且加入100 mg·L-1的硝酸鋁,用HCl調pH4.5。在人工氣候室中脅迫處理7 d,統計各材料的發芽率,并測量幼苗的根長。
幼苗處理試驗:挑選生長整齊一致的幼苗分別在減弱的酸鋁脅迫強度下進行處理,對照組仍為正常的Hoagland全營養培養液(pH7.0);酸處理組為Hoagland全營養培養液(pH5.5);鋁離子處理組為Hoagland全營養培養液,加入50 mg·L-1的硝酸鋁(pH7.0);酸鋁組合組為Hoagland全營養培養液,加入50 mg·L-1的硝酸鋁(pH5.5)。脅迫處理20 d后測量株高、地上部分鮮重和根長。
1.6 抗氧化酶活性的測定
采取脅迫處理后的紫花苜蓿根系樣品,采用南京建成POD測定試劑盒(A084-3)測定POD活性,采用碧云天SOD活性檢測試劑盒(S0102)和CAT檢測試劑盒(S0055)測定SOD和CAT活性,采用試劑盒(Solarbio,BC0025)測定MDA含量。
1.7 相關基因的表達分析
根據1.3和1.4方法進行轉基因植株中相關基因的qRT-PCR分析。
1.8 數據分析
采用測驗分析表達差異顯著性,閾值設為<0.05,采用Excel 2010與Power Point 2010作圖。
2 結果
2.1 BjMATE的遺傳轉化與轉基因植株的篩選鑒定
分別采用組織培養和花器官浸泡方法對紫花苜蓿和擬南芥進行遺傳轉化,利用卡那霉素篩選,共獲得15株轉紫花苜蓿與24株轉擬南芥植株。分別用和的引物對轉基因植株進行PCR鑒定,發現轉基因擬南芥中2對引物組合的檢測陽性率均為100%,而在轉基因苜蓿中,檢測結果陽性率為100%,+R引物組合陽性植株為10株,陽性率為66.7%(圖1-A和圖1-B)。
分別挑選轉基因株系-、-與-和、-與-進行基因的qRT-PCR分析。所有挑選植株的的表達量均顯著上調,與野生型擬南芥相比,-、-和-中分別上調了76.87、67.73和62.68倍。在紫花苜蓿中,、-和-中分別上調了63.02、31.99和58.65倍(圖1-C和圖1-D)。在后續研究中,以-和為試驗材料進行研究。
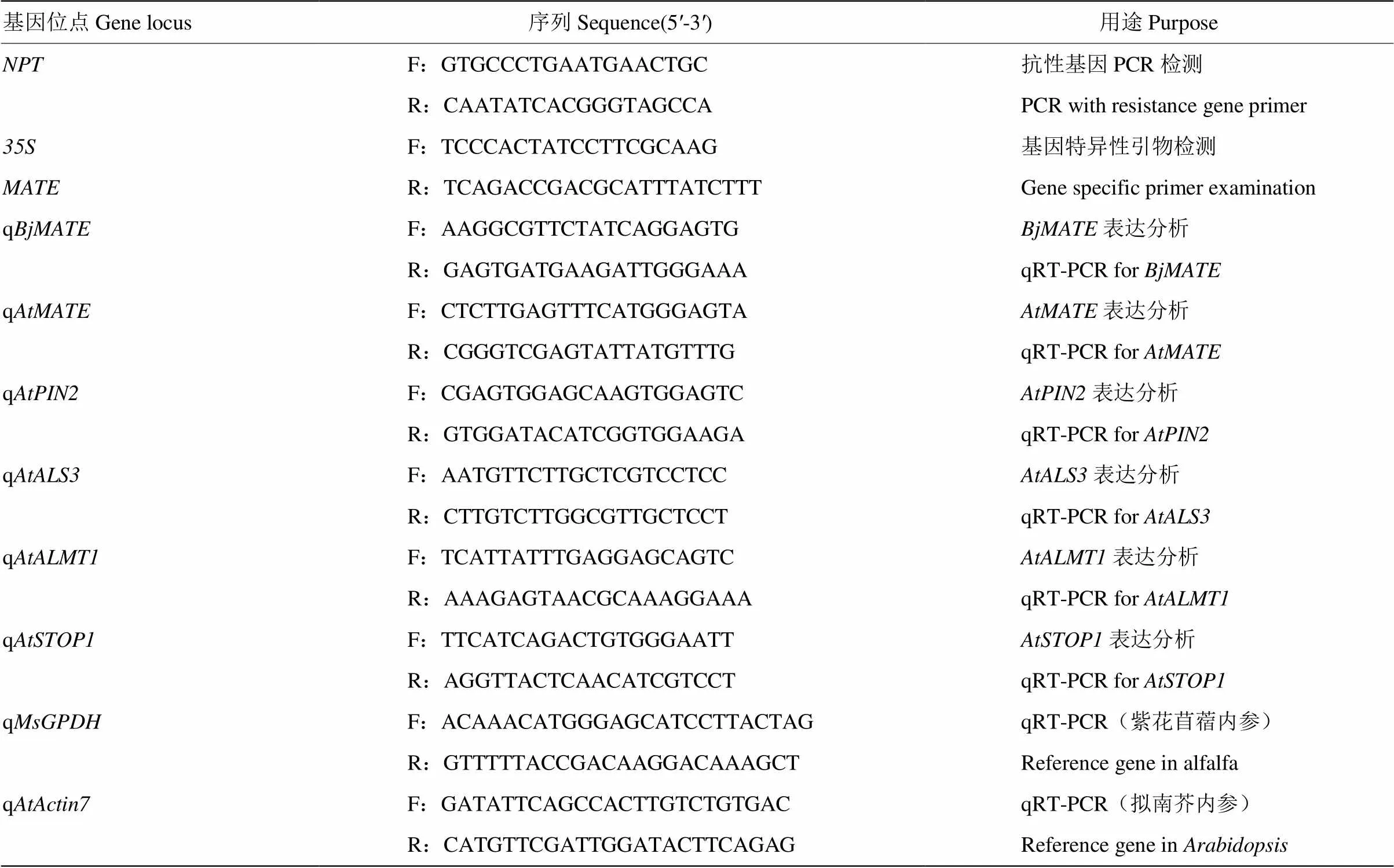
表1 試驗中用到的引物
2.2 酸鋁脅迫下35S:BjMATE轉基因紫花苜蓿的生長情況
為分析是否具有調節植物耐酸鋁脅迫的功能,通過比較分析和對照紫花苜蓿中苜1號在酸、鋁離子以及酸鋁組合脅迫條件下種子的發芽率和發芽勢變化(圖2-A和圖2-B)。在正常條件下,和中苜1號的發芽率分別為95.3%和96.5%,兩者之間沒有顯著差異。在脅迫條件下,和中苜1號的發芽率為92.3%—96.2%,2種材料之間以及不同處理之間在發芽率上沒有顯著差異。
通過比較分析和對照中苜1號在酸鋁脅迫條件下根系的生長變化。在正常條件下,和對照中苜1號根系長度分別為6.33和6.23 cm,差異不顯著(圖2-A和圖2-C)。脅迫處理后,和中苜1號根系長度顯著受到抑制,但材料間和處理間存在不同的變化。與正常條件相比,在酸脅迫條件下,根長為5.30 cm,下降16.3%;中苜1號根長為5.07 cm,下降18.7%,但在與中苜1號之間差異不顯著(>0.05)(圖2-A和圖2-C)。在鋁離子脅迫條件下,與中苜1號根系長度分別為3.97和3.23 cm,分別下降37.3%和48.1%,在2個材料間差異顯著(<0.05)。與鋁離子脅迫類似,在酸鋁組和脅迫條件下,與中苜1號根系長度分別為3.37和2.87 cm,分別下降46.8%和54.0%,2個材料間差異顯著(<0.05,圖2-A和圖2-C)。
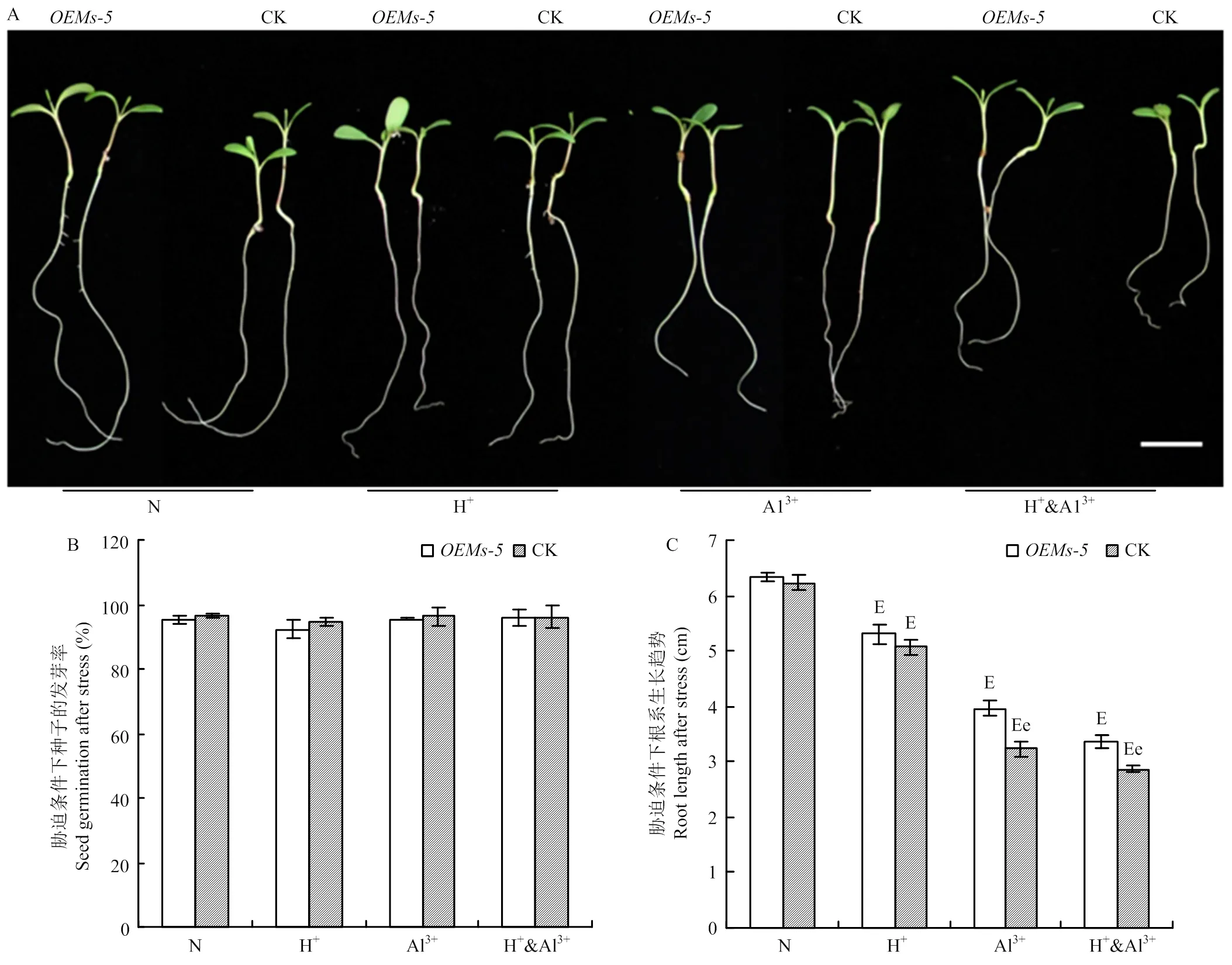
A:脅迫處理后紫花苜蓿種子萌發后根系伸長情況,Bar=1 cm;B:脅迫條件下種子發芽率;C:脅迫條件下不同紫花苜蓿材料幼苗根長的變化。e表示OEMs-5和中苜1號在p<0.05水平差異顯著,E表示同一種材料在脅迫處理和正常條件之間在p<0.05水平差異顯著。下同
為進一步分析調節植物應答酸鋁脅迫的功能,在長時間減弱的酸鋁脅迫條件下,比較分析和對照中苜1號紫花苜蓿幼苗的地上部分和地下部分的變化。在正常、酸脅迫、鋁離子脅迫和酸鋁組合脅迫條件下,和對照中苜1號株高在5.0—5.8 cm,材料間和處理間均沒有顯著差異(圖3-A和圖3-B)。在正常條件下,和中苜1號的單株產量分別為0.42和0.41 g,二者差異不顯著(圖3-A和圖3-C)。在脅迫條件下,雖然植株株高沒有變化,但生物產量變化趨勢不盡相同。在酸脅迫條件下,和中苜1號的單株生物產量都為0.35 g,與正常條件相比,分別下降18.5%與14.1%,但兩者差異不顯著(圖3-A和圖3-C)。在鋁離子脅迫條件下,和中苜1號的單株生物產量分別為0.36 和0.32 g,分別下降14.8%和20.5%,顯著優于中苜1號(圖3-A和圖3-C)。在酸鋁組合脅迫條件下,的生物產量為0.34 g,下降19.5%,顯著優于中苜1號(0.30 g,下降26.1%),2個材料間的變化趨勢與鋁離子脅迫類似(圖3-A和圖3-C)。
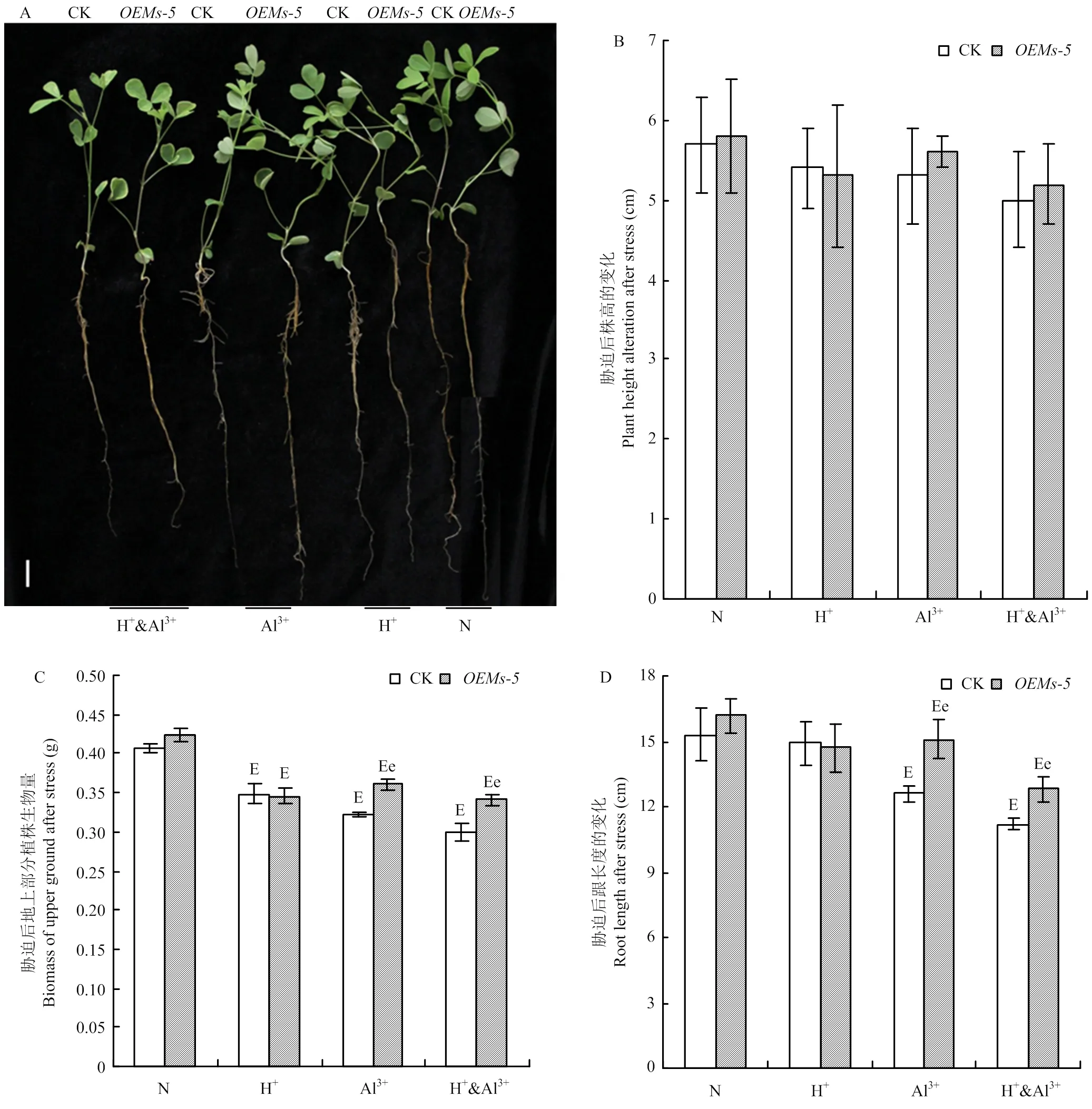
A:脅迫處理后紫花苜蓿幼苗生長情況,Bar=1 cm;B:脅迫條件下株高的變化;C:脅迫條件下紫花苜蓿幼苗地上部分生物量的變化。D:脅迫條件下紫花苜蓿幼苗根長的變化
地下部分的變化趨勢要比地上部分更加顯著。脅迫處理后的根系長度變化與地上部分類似,在正常條件和酸脅迫條件下,和中苜1號的根長在14.7—16.2 cm,均沒有顯著差異(圖3-A和圖3-D)。鋁離子和酸鋁組合脅迫后,和中苜1號的根長都受到抑制,但受抑制程度不相同。鋁離子脅迫后,根長為15.1 cm,根長比正常條件減少6.8%,顯著優于中苜1號(12.6 cm,減少17.6%)。酸鋁組合脅迫對根系伸長的抑制效果更加明顯,和中苜1號的根長分別為12.8和11.2 cm,下降12.9%和24.8%,材料間和處理間的差異都達顯著水平(圖3-A和圖3-D)。
2.3 酸鋁脅迫條件下35S:BjMATE轉基因紫花苜蓿的生理變化
和中苜1號在酸、鋁離子以及酸鋁組脅迫條件下的表型和生物產量有顯著差異,為分析導致差異的原因,比較分析2個材料在脅迫條件下的抗氧化酶活性的變化。在正常條件下,和中苜1號植株中POD、SOD、CAT的活性和MDA含量都沒有顯著區別(圖4)。酸脅迫后,與正常條件相比,SOD的活性在和中苜1號中都顯著升高,但它們之間差異不顯著(圖4-B),POD、CAT的活性和MDA的含量在材料間和處理間都沒有顯著差異(圖4)。鋁離子脅迫后,各酶活的變化趨勢不相同。與正常條件相比,POD和SOD活性在中和中苜1號均有升高,但只有SOD在兩材料間差異顯著(圖4-A和圖4-B)。CAT的活性在處理間和材料間沒有顯著區別(圖4-C)。MDA的含量略有下降,但差異不顯著(圖4-D)。在酸鋁組合脅迫條件下,POD、SOD和CAT的活性在和中苜1號的變化趨勢與鋁離子脅迫相同(圖4-A—圖4-C),與正常條件相比,MDA的含量在中苜1號中下降,而在沒有顯著變化,與中苜1號的差異達顯著水平(圖4-D)。
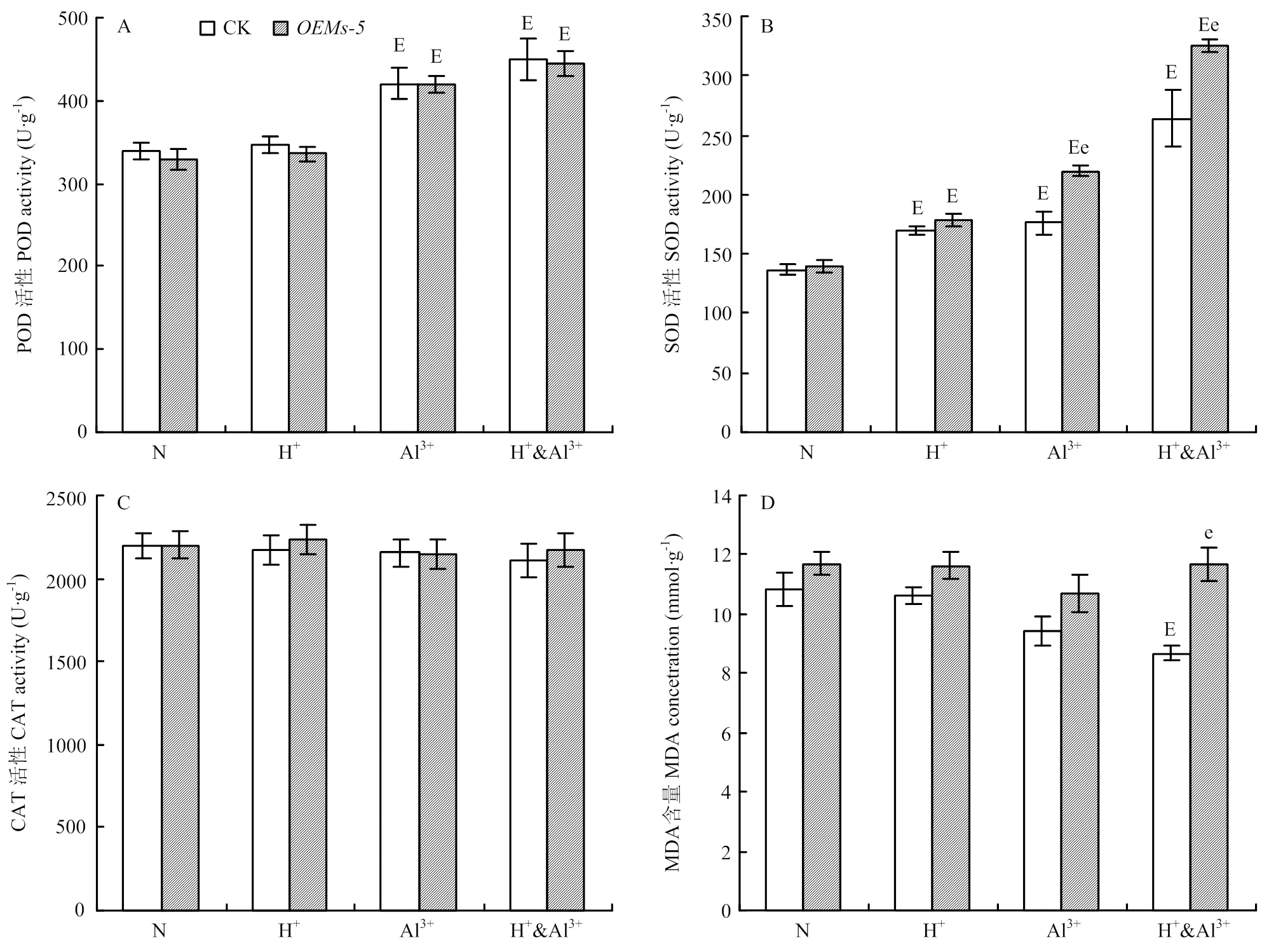
A—D:脅迫處理后紫花苜蓿POD(A)、SOD(B)、CAT(C)和MDA(D)的變化
2.4 酸鋁脅迫調節關鍵基因在下35S:BjMATE轉基因擬南芥中的表達變化
因為紫花苜蓿基因組較大較復雜,其酸鋁調控網絡研究不如模式植物擬南芥深入;此外,來源于芥菜基因組,與擬南芥同源性更高,因此,以和野生型擬南芥為研究對象,通過比較酸鋁調節途徑上重要功能基因在酸鋁脅迫條件下的表達變化,發現在正常和脅迫條件下的野生擬南芥中檢測不到的表達,而在植株中一直表現為高豐度表達,說明材料中一直被過量表達(圖5-A)。正常條件下,在和野生型擬南芥中、、與的表達差異顯著,而在植株中顯著被誘導表達,為野生型植株表達量的2.63倍(圖5-B)。在酸脅迫條件下,與正常條件相比,、與的表達差異不顯著,而與上調表達,但在和野生型之間差異不顯著(圖5-B)。在鋁離子脅迫條件下,所有挑選的基因都被顯著誘導,其中,、、與的表達在和野生型擬南芥材料間沒有顯著差異,而在兩材料間差異顯著(圖5-B)。酸鋁組合脅迫條件下各基因的變化趨勢與鋁離子單獨脅迫相似(圖5-B)。
3 討論
3.1 BjMATE為功能保守的酸鋁脅迫調節基因
酸性土壤面積分布廣而且對作物生產限制大,鋁離子毒害是酸性土壤的首要限制性因素。當pH低于5時,以活性的Al3+形式存在的鋁元素在土壤中的含量顯著增加,能夠在數分鐘之內抑制植物根系生長,隨后導致植物根系和營養缺乏[22]。前人研究發現,單獨的酸脅迫就能夠導致植物根系生長受抑制[23-24],在本研究中,轉基因和中苜1號紫花苜蓿在單獨的酸脅迫條件下,根系伸長受抑制程度與正常條件差異不顯著,可能與減弱的酸脅迫條件有關。而在鋁離子脅迫和酸鋁組合脅迫條件下,無論是在萌發后的幼苗還是長時間弱酸鋁脅迫后植株的根系生長都顯著受到抑制,而且在和中苜1號之間也具有顯著差異。除此之外,轉基因和中苜1號紫花苜蓿的地上部分生物產量也發生顯著的變化,但的生物產量顯著高于中苜1號,并且相同材料在不同的組合處理之間也具有顯著差異。說明對紫花苜蓿酸鋁脅迫的調節作用的功能的保守性較高。
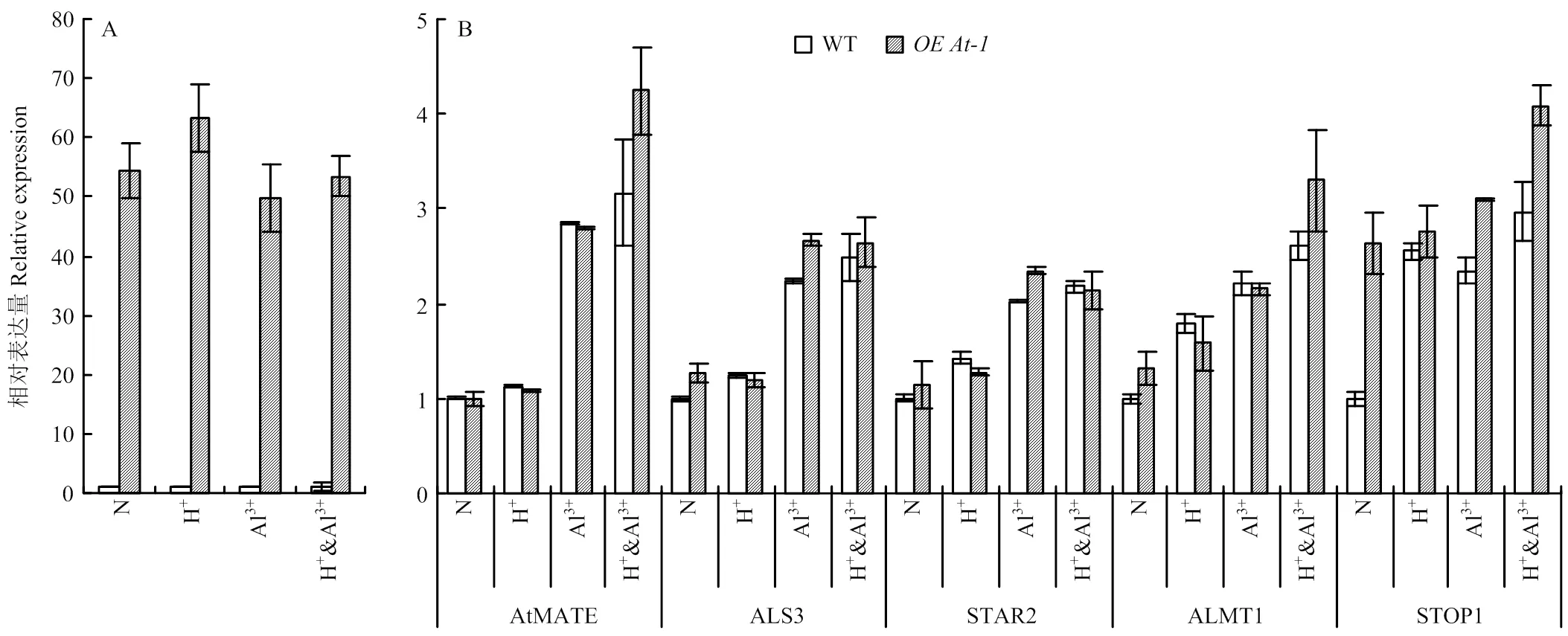
A:BjMATE在正常(N)、酸(H+)、鋁(Al3+)和酸鋁組合脅迫(H+ & Al3+)后的OEAt-1中的表達分析;B:擬南芥中酸鋁脅迫標志性基因在正常、酸、鋁和酸鋁組合脅迫后的OEAt-1中的表達分析
3.2 SOD的活性在BjMATE介導的抗酸鋁脅迫調節中起重要作用
鋁離子抑制植物根系伸長的主要機制之一是擾亂線粒體的正常功能,導致細胞內的活性氧物質含量增加。在水稻中鋁離子毒害能夠整體的顯著增加細胞內抗氧化酶活性[10],本研究發現紫花苜蓿在脅迫處理之后SOD、POD活性增加,而CAT的活性沒有顯著變化。盡管與水稻中結果不一致,但總體的趨勢是吻合的,在水稻中,SOD、POD活性增加的幅度比CAT的要更劇烈[10]。因為鋁離子對植物毒害作用受很多因素的影響,包括培養基、pH、Al3+濃度、處理的時期和時間等。因此,本研究中CAT的活性與水稻中的變化趨勢不一致,可能是由于物種差異、酸鋁脅迫處理方式或脅迫處理時間等因素造成。在本研究中,除了SOD的活性外,抗氧化酶的活性在處理之間差異顯著,但在和中苜1號之間差異不顯著。中SOD的活性在鋁離子脅迫和酸鋁組合脅迫條件下顯著高于中苜1號,說明過SOD調控途徑可能在介導的酸鋁脅迫調節途徑中起重要作用。
3.3 STOP1可能參與BjMATE介導的抗酸鋁脅迫調節
作物遺傳改良是減少酸性土壤中鋁離子對植物細胞傷害的主要的方法之一。鋁離子脅迫能夠誘導多個基因的表達,本研究中,以及挑選的、等基因都不同程度地受到酸、鋁離子和酸鋁組合脅迫的誘導,相應結果與前人結果一致[17]。AtSTOP1轉錄因子位于MATE的上游,能夠調節多個鋁離子耐受基因和酸脅迫耐受基因表達[17,25]。與生理變化類似,除以外,挑選酸鋁調節的標志性基因在脅迫處理之間差異顯著,但在和中苜1號之間差異不顯著,說明與挑選的、等基因處于平行的酸鋁脅迫調控途徑。在株系中,在酸鋁脅迫和正常條件下的表達量顯著高于對照中苜1號,說明的上調表達可能通過某種未知的調解途徑正向反饋調節的表達,或者這種現象是由芥菜的特性造成,因為不同物種的同源基因的功能具有相似性,同時也有物種的特異性。在擬南芥中,能夠同時調控酸脅迫和鋁脅迫相關基因的表達;但在水稻中,只調節鋁離子耐受基因的表達,不參與酸脅迫調控[26],更深入的結果還有待后續研究。
4 結論
在紫花苜蓿中,過量表達顯著提高轉基因植物在種子萌發和幼苗生長階段對酸鋁耐脅迫的耐受性。抗氧化酶的活性受酸鋁脅迫處理誘導,其中SOD活性在介導的抗酸鋁脅迫調節中起重要作用。在中,酸鋁脅迫調控的標志性基因1可能與之間存在一個正反饋調節,通過某種未知的途徑與互作調控植物對酸鋁脅迫的應答。
[1] 郭彥軍, 黃建國. 酸性紫色土上紫花苜蓿的結瘤性能與養分吸收. 植物營養與肥料學報, 2006, 12(1): 97-103.
GUO Y J, HUANG J G. Nutrients absorption and nodulation ability of alfalfa in acid purple soil., 2006, 12(1): 97-103. (in Chinese)
[2] VITORELLO V A, CAPALDI F R, STEFANUTO V A. Recent advances in aluminum toxicity and resistance in higher plants., 2005, 17(1): 129-143.
[3] JIAN F M. Syndrome of aluminum toxicity and diversity of aluminum resistance in higher plants., 2007, 264: 225-252.
[4] YAMAMOTO Y. Aluminum toxicity in plant cells: Mechanisms of cell death and inhibition of cell elongation., 2019, 65(1): 41-55.
[5] RASHEDINIA M, SABERZADEH J, BAKHTIARI TK, HOZHABRI S, ARABSOLGHAR R. Glycyrrhizic acid ameliorates mitochondrial function and biogenesis against aluminum toxicity in PC12 cells., 2019, 35(3): 584-593.
[6] JASKOWIAK J, TKACZYK O, SLOTA M, KWASNIEWSKA J, SZAREJKO I. Analysis of aluminum toxicity inroots with an emphasis on DNA integrity and cell cycle., 2018, 13(2): e0193156.
[7] ZHANG Y, GUO J, CHEN M, LI L, WANG L, HUANG C F. The cell cycle checkpoint regulatoris required for internal aluminum toxicity-mediated root growth inhibition in., 2018,9: 118.
[8] RIAZ M, YAN L, WU X, HUSSAIN S, AZIZ O, WANG Y, IMRAN M, JIANG C. Boron alleviates the aluminum toxicity inby regulating antioxidant defense system and reducing root cell injury., 2018, 208: 149-158.
[9] TENG W C, KANG Y C, HOU W J, HU H Z, LUO W J, WEI J, WANG, L H, ZHANG, B Y. Phosphorus application reduces aluminum toxicity in twoclones by increasing its accumulation in roots and decreasing its content in leaves., 2018, 13(1): e0190900.
[10] ZHU C Q, ZHANG J H, SUN L M, ZHU L F, ABLIZ B, HU, W J, ZHONG C, BAI Z G, SAJID H, CAO, X C. Hydrogen sulfide alleviates aluminum toxicity via decreasing apoplast and symplast al contents in rice., 2018, 9: 294.
[11] FENG H C, NAOKI Y, NAMIKI M, MASAHIRO Y, YOSHIAKI N, FENG M J. A bacterial-type ABC transporter is involved in aluminum tolerance in rice., 2009, 21(2): 655-667.
[12] JUN F, NAOKI Y, HUA W, NAMIKI M, YOSHIKO M, KAZUHIRO S, MAKI K, KAZUYOSHI T, FENG M J. An aluminum-activated citrate transporter in barley., 2007, 48(8): 1081-1091.
[13] MAGALHAES J V, JIPING L, GUIMARES C T, LANA U G P, ALVES V M C, WANG Y H, SCHAFFERT R E, HOEKENGA O A, PIEROS M A, SHAFF J E. A gene in the() family confers aluminum tolerance in sorghum., 2007, 39(9): 1156-1161.
[14] KOCHIAN L V, PIEROS M A, JIPING L, MAGALHAES J V. Plant adaptation to acid soils: the molecular basis for crop aluminum resistance., 2015, 66(1): 571-598.
[15] LI J Y, LIU JIPING, DONG DK, JIA XM, MCCOUCH S R, KOCHIAN L V. Natural variation underlies alterations inaluminum transporter () expression and function that play a key role in rice aluminum tolerance., 2014,111(17): 6503-6508.
[16] NEGISHI T, OSHIMA K, HATTORI M, KANAI M, MANO S, NISHIMURA M, YOSHIDA K. Tonoplast-and plasma membrane- localized aquaporin-family transporters in blue hydrangea sepals of aluminum hyperaccumulating plant., 2012, 7(8): e43189.
[17] JIPING L, MAGALHAES J V, JON S, KOCHIAN L V. Aluminum- activated citrate and malate transporters from theandfamilies function independently to conferaluminum tolerance., 2010, 57(3): 389-399.
[18] KENGO Y, NAOKI Y, FENG M J. An Al-induciblegene is involved in external detoxification of Al in rice., 2011, 68(6): 1061-1069.
[19] LI X D, WANG X L, CAI Y M, WU J H, MO B T, YU E R.() and() function in the same heat regulation pathway., 2017, 39(3): 67-76.
[20] 李小冬, 莫本田, 牟瓊, 婁芬, 陳文貴, 陳光吉, 張瑜, 韓永芬. 紫花苜蓿高溫誘導啟動子的克隆與功能分析. 草業學報, 2019, 28(1): 128-137.
LI X D, MO B T, MOU Q, LOU F, CHEN W G, CHEN G J, ZHANG Y, HAN Y F. Cloning and function ananlysis of the high temperature inducible promoterin alfalfa ()., 2019, 28(1): 128-137. (in Chinese)
[21] 李小冬. 擬南芥IKU2互作蛋白鑒定及同源四倍體分析[D]. 武漢: 華中農業大學, 2012.
LI X D. Screening ofIKU2 interacting proteins and analysis of an autotetraploid[D]. Wuhan: Huazhong Agriculture University, 2012. (in Chinese)
[22] BOJóRQUEZ-QUINTAL E, ESCALANTE-MAGA?A C, ECHEVARRíA- MACHADO I, MARTíNEZ-ESTéVEZ M. Aluminum, a friend or foe of higher plants in acid soils., 2017, 8: 1-18.
[23] MONSHAUSEN G B, BIBIKOVA T N, MESSERLI M A, SHI C, GILROY S. Oscillations in extracellular pH and reactive oxygen species modulate tip growth ofroot hairs., 2007, 104(52): 20996-21001.
[24] JIAN L Y, SHAO J Z, YUN F H, MATSUMOTO H. Aluminium resistance requires resistance to acid stress: a case study with spinach that exudes oxalate rapidly when exposed to Al stress., 2005, 56(414): 1197-1203.
[25] SAWAKI Y, IUCHI S, KOBAYASHI Y, KOBAYASHI Y, IKKA T, Sakurai N, Fujita M, Shinozaki K, Shibata D, Kobayashi M.regulates multiple genes that protectfrom proton and aluminum toxicities., 2009, 150(1): 281-294.
[26] NAOKI Y, FENG H C, SAKIKO N, MASAHIRO Y, YUTAKA S, YOSHIAKI N, FENG M J. A zinc finger transcription factorregulates multiple genes implicated in aluminum tolerance in rice., 2009, 21(10): 3339-3349.
The Mechanism of Ectopic Expression of() to Enhance the Resistance to Acid and Aluminum Stress in Alfalfa
LI XiaoDong1,2, SHANG YiShun1, LI ShiGe1,2, CHEN GuangJi1,2, PEI ChengJiang1,2, SUN Fang1, XIONG XianQin1
(1Guizhou Institute of Prataculture, Guizhou Academy of Agricultural Science, Guiyang 550006;2Guizhou Dingxin Agriculture and Animal Husbandry Technology co. ltd, Guiyang 550006)
【】 Acid and aluminum stress is one of the major environmental stresses in agricultural production in the south of China. Studying the mechanism of native plants adaptation to acid and aluminum stress, and identifying and making use of the excellent gene resources would benefit to breed new varieties of acid and aluminum resistant crops, that will play a fundamental role in molecular breeding of alfalfa. 【】In previous study, full length ofwas cloned from Pingba bitter rape, a nativeresource in Guizhou province, and the overexpression vector was constructed by the alfalfa genetic improvement group of Guizhou Institute of Prataculture. The transgenic plants of alfalfa andwere obtained by tissue culture and flower dipping methods, respectively. Molecular examination was carried out with NPT resistance gene primers and gene-specific primers; and the expression ofin transgenic plants was examined by qRT-PCR. The germination rate and seedling growth of transgenic and control alfalfa lines were analyzed by hydroponic method under acid, aluminum and acid aluminum combination stress conditions. The alteration of the seedling and root growth was also analyzed between transgenic and Zhongmu 1# alfalfa under a long term but weaker acid-aluminum stress condition. Antioxidant enzyme activity, including POD, SOD, CAT, and MDA concentration alterations betweenandZhongmu 1# were analyzed with microplate reader under acid, aluminum and acid-aluminum combined stress conditions. At the same time, expression changes of,,,,andwhich were key genes involving in acid aluminum regulation pathways, were analyzed in the model plantby qRT-PCR, and potential regulation network were discussed. 【】 The positive rates of transgenicand alfalfa were 100% and 66.7%, respectively. Compared with the control lines, the expression levels of the candidate transgenic alfalfa andlines were up-regulated by 63.02 and 76.87 times, respectively. There was no significant difference in seed germination rate betweenand Zhongmu 1# under normal, acid stress, aluminum ion stress and acid-aluminum combination stress conditions. While the germination potential was significantly different among the treatments, as well as the materials,was significantly better than Zhongmu 1#. After a long-term weak stress treatment, the plant height ofwas not significantly different from that of Zhongmu 1#; but the biomass and root length ofwas significantly better than that of Zhongmu 1# under aluminum stress and acid-aluminum combined stress conditions. Antioxidant enzyme activity and MDA concentration alterations betweenand Zhongmu 1# were different. POD and SOD activity increased in bothand Zhongmu 1# after stress treatment, however, significant difference was only detected in SOD assay. No significant difference in CAT activity was detected between the two materials, and the treatments. The content of MDA decreased slightly, significant differences were detected betweenand Zhongmu 1# under aluminum stress and acid-aluminum combined stress conditions. Expressions of,andwere up-regulated under aluminum stress and acid-aluminum combined stress in bothand Zhongmu 1#, however, no significant difference were detected between them except.【】can positively regulate alfalfa tolerance to acid-aluminum stress during seed germination and seedling growth stages. Reactive oxygen species (ROS) scavenger system, especially the activity of SOD, andgene which is a key gene involving in acid-aluminum stress regulation pathway, may participate inmediated acid-aluminum stress regulation.
acid aluminum stress;; alfalfa; gene expression regulation
10.3864/j.issn.0578-1752.2020.01.002

2019-06-03;
2019-09-10
國家自然科學基金(31960345)、貴州省科學技術基金(黔科合J字[2015]2080號)、貴州省科研機構服務企業行動計劃(黔科合服企[2018]4001號)、貴州省農業科學院院專項基金(黔農科院院專項[2013]003號)、貴州省科研機構創新能力建設專項資金項目(黔科合服企[2019]4010號)
李小冬,E-mail:lixiaodongzl@163.com。通信作者尚以順,E-mail:2892486467@qq.com
(責任編輯 李莉)

