長鏈非編碼RNA EXOC7在非酒精性脂肪性肝病中的表達及臨床意義
張麗云, 鄧家琦, 張 雙, 鄧華江, 李曉紅
西南醫科大學附屬醫院 a.健康管理中心; b.超聲醫學科; c.老年病科; d.神經外科, 四川 瀘州 646000
脂肪肝是一種可逆性肝病,超重、肥胖、胰島素抵抗、糖尿病、慢性酒精中毒以及HBV和HCV感染都有可能誘發脂肪肝[1]。脂肪肝最終有可能發展為肝纖維化,并導致肝硬化和肝癌。非酒精性脂肪性肝病(NAFLD)是病理變化與酒精性肝病相似但無過量飲酒史的臨床綜合征,好發于中年特別是超重肥胖個體,其發病率在西方國家非常高[2]。隨著我國國民經濟的快速發展以及物質生活水平的顯著提高,高能量的膳食密度、不健康的生活方式越來越普遍,NAFLD也成為愈來愈重要的慢性肝病問題[3]。NAFLD作為一種與遺傳-環境-代謝應激密切相關的疾病,以肝細胞內過量脂肪沉積為特征,并且常與肥胖、糖尿病、高血壓、高脂血癥等代謝性紊亂相伴,是一種從單純的脂肪變性、無炎癥或纖維化到非酒精性脂肪性肝炎(NASH)的一系列疾病[4],其發病機制較為復雜,目前尚未完全闡明。
長鏈非編碼RNA(long non-coding RNA,lncRNA)是長度大于200個核苷酸的非編碼RNA,其通過RNA聚合酶Ⅱ從基因位點轉錄,與mRNA相比,幾乎沒有已知的生化差異[5]。近年來研究[6]發現,lncRNA的異常調控與多種疾病的發生發展密切相關。此外,lncRNA在細胞中通過多種方式參與基因調控和蛋白質合成,進而影響細胞內物質代謝,參與NAFLD的發生發展[7]。課題組前期預實驗發現,lncRNA外泌體復合物7(lncRNA exocyst complex component 7,lncRNA EXOC7)在NAFLD患者組織中高表達,提示lncRNA EXOC7可能與NAFLD的發生和發展有關。本研究應用實時熒光定量PCR法(Real-time PCR)檢測lncRNA EXOC7在NAFLD患者肝組織及血液標本中的表達及其臨床意義。
1 資料與方法
1.1 研究對象 選取2013年1月1日-2018年12月31日在本院住院行肝穿刺并經影像學及組織病理學確診為NAFLD的患者,診斷標準符合2012年美國NAFLD診療指南[8]。另選取同期于本院體檢的無脂肪變性和脂肪性肝炎的其他肝病(主要包括輕型藥物性肝損傷、慢性乙型肝炎)患者作為對照。本研究方案經由西南醫科大學附屬醫院倫理委員會批準(批號:20121201),所有研究對象均簽署知情同意書。
1.2 觀察指標 收集所有研究對象的病理穿刺組織標本,并于診斷明確后次日清晨空腹采集靜脈血5 ml,靜置2~4 h,2500~3000 r/min離心10 min;將離心獲得的血清分裝后用于各項指標檢測。記錄LDL-C、HDL-C、TC、TG、ALT、AST、ALP、GGT、超敏C反應蛋白(hs-CRP)水平。根據CT影像學表現將NAFLD患者分為輕度(0.7<肝/脾CT比值<1.0)、中度(0.5<肝/脾CT比值≤0.7)和重度(肝/脾CT比值≤0.5)脂肪肝組。
1.3 Real-time PCR檢測lncRNA EXOC7表達水平 采用TRIzol(Invitrogen,Grand Island,NY,USA)提取組織及血清標本中總RNA。將提取的總RNA參照AMV逆轉錄試劑盒說明書提供的方法反轉錄成cDNA。采用2×SYBR Green PCR Master Mix,以cDNA為摸板,進行Real-time PCR(7500型實時熒光定量PCR儀,Applied Biosystems公司,美國)。3次獨立實驗后得到的數據運用2-ΔΔCt方法進行分析。
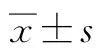
2 結果
2.1 一般資料 共納入120例NAFLD患者,其中非酒精性單純性脂肪肝(NAFL)患者47例(男25例、女22例),NASH患者73例(男43例、女30例)。對照組納入50例患者(男25例、女25例),其中輕型藥物性肝損傷25例,慢性乙型肝炎25例。
兩組一般資料比較,年齡、性別比差異均無統計學意義(P值均>0.05),而BMI、腰臀比、HDL-C、LDL-C、TC、TG、ALT、AST、ALP、GGT、hs-CRP、胰島素敏感指數(ISI)差異均有統計學意義(P值均<0.05)(表1)。
2.2 lncRNA EXOC7表達情況 與對照組相比,NAFL和NASH患者的組織及血清中lncRNA EXOC7表達增高,差異均有統計學意義(P值均<0.05);而lncRNA EXOC7在NAFL與NASH患者組織、血清中的表達差異均無統計學意義(P值均>0.05)(表2)。
2.3 血清lncRNA EXOC7在不同程度非酒精性脂肪肝變性中的表達 lncRNA EXOC7的表達水平隨肝臟脂肪變性及炎癥程度的加重而升高(F=19.96,P<0.05),其在輕、中、重度非酒精性脂肪肝患者血清中的表達均明顯高于對照組(P值均<0.05)(圖1)。
2.4 lncRNA EXOC7表達與臨床生化指標的相關性 相關性分析結果顯示,lncRNA EXOC7表達與TG、LDL-C水平呈正相關(r值分別為0.785、0.847,P值均<0.001)(圖2a、b);而與ISI和HDL-C水平呈負相關(r值分別為-0.709、-0.726,P值均<0.001)(圖2c、d)。
2.5 lncRNA EXOC7表達對NAFLD的診斷價值 ROC曲線分析顯示,lncRNA EXOC7診斷NAFLD的曲線下面積為0.812(95%可信區間:0.599~0.915,P<0.001),敏感度為85.42%,特異度為81.17%(圖3)。

表1 兩組患者一般資料比較

表2 lncRNA EXOC7表達情況比較
注:與對照組比較,1)P<0.05。
圖1不同程度NAFLD患者血清lncRNAEXOC7的表達
3 討論
近年來NAFLD的發病率逐年上升且漸趨低齡化[9]。中國面臨NAFLD和高脂血癥的嚴重威脅,我國各類脂代謝紊亂患者約3億人,患病率約25%。NAFLD是導致肝硬化、門靜脈高壓、肝移植及肝癌的重要原因[10]。對于超重和肥胖者而言,NAFLD的出現,可能提示“惡性肥胖”[11],這類人群更易并發血脂異常癥、糖尿病、高血壓,從而導致冠心病、中風的概率顯著增加。目前,NAFLD發病機制尚未完全闡明,治療缺乏有效藥物[12]。因此,闡明NAFLD發病機制并尋找有效的防治方法是目前臨床亟待解決的難題。
lncRNA是一組長度>200 nt的不具有編碼蛋白功能的RNA轉錄本,在表觀遺傳、轉錄、轉錄后水平發揮生理功能[13]。研究[14]發現lncRNA參與肝臟細胞多種生物學過程,在很多肝臟病理過程中發揮重要作用,與線粒體、內質網功能、能量代謝高度相關。在所有生物過程中,NAFLD發生變化最主要的3種生物過程,即RNA聚合酶Ⅱ啟動、節律過程以及脂肪酸代謝過程,與lncRNA調控的翻譯、羧酸轉運、有機酸轉運密切相關[15]。Chen等[16]發現,lncRNA-NEAT1通過調節miR-146a-5p/ROCK1促進NAFLD肝臟脂質積聚。下調lncRNA SNHG20的表達可通過調節肝Kupffer細胞極化延緩NAFLD向肝細胞癌的發展[17]。lncRNA FRRL2通過ARNTL-SIRT1通路減緩NAFLD的發生[18]。lncRNA NEAT1-Microrna-140 環通過阻斷AMPK/SREBP-1信號促進NAFLD的發生[19]。lncRNA-H19通過直接調節miR130a/PPARγ軸促進NAFLD脂肪合成[20]。通過抑制MAPK信號轉導通路中lncRNA HULC的表達可促進NAFLD大鼠肝纖維化和肝細胞凋亡[21]。lncRNA MIRT2通過海綿吸附miR-34a-5p,從而上調USP10的表達抑制肝脂肪變性[22]。lncRNA MEG3作為內源性競爭性RNA,通過競爭性結合miR-21到低密度脂蛋白受體相關蛋白6調節肝臟的脂肪生成[23]。以上研究均提示lncRNA在NAFLD中發揮著重要的作用。
本研究結果顯示,lncRNA EXOC7在NAFLD患者組織及血清標本中表達明顯增高,且表達水平隨肝臟脂肪變性及炎癥程度的加重而提升;進一步相關性分析發現,lncRNA EXOC7表達與TG、LDL-C呈正相關,而與HDL-C、ISI呈負相關。lncRNA EXOC7診斷NAFLD的ROC曲線下面積為0.812(95%可信區間:0.599~0.915),敏感度為85.42%,特異度為81.17%。以上研究結果提示,lncRNA EXOC7可能是NAFLD防治的潛在新靶點。

