利用CRISPR/Cpf1系統(tǒng)構(gòu)建穩(wěn)定敲除LncRNA458314的腎癌細(xì)胞株及其功能探討
周洋,陳兵海,王誠(chéng)悅
(江蘇大學(xué)附屬醫(yī)院泌尿外科,江蘇 鎮(zhèn)江 212001)
腎癌又稱腎細(xì)胞癌,在人類泌尿系腫瘤中占第二位,外科手術(shù)根治是最主要的治療手段,然而腎癌發(fā)生發(fā)展的分子生物學(xué)機(jī)制仍然未得到闡明[1]。越來(lái)越多的長(zhǎng)鏈非編碼RNA(LncRNA)被證實(shí)參與了細(xì)胞內(nèi)多種重要的調(diào)控過(guò)程。LncRNA在腎癌細(xì)胞中的生物基礎(chǔ)研究進(jìn)展能夠提高腎癌的預(yù)測(cè)、診斷和個(gè)體化治療能力[2]。
基因編輯技術(shù)發(fā)展迅猛,目前已經(jīng)由第1代“鋅指核酸內(nèi)切酶(ZFN)”和第2代“類轉(zhuǎn)錄激活因子效應(yīng)物核酸酶(TALEN)”發(fā)展到第3代“基因組定點(diǎn)編輯技術(shù)”[3]。與前兩代基因編輯技術(shù)相比,第3代基因編輯技術(shù)具有操作簡(jiǎn)便,快捷高效,耗費(fèi)成本低等優(yōu)點(diǎn)[4-5]。正是有了這些優(yōu)勢(shì),第3代基因編輯技術(shù)迅速成為科研和醫(yī)療等領(lǐng)域的有效工具。CRISPR/Cpf1是第3代“基因組定點(diǎn)編輯技術(shù)”的最新代表。本課題組在前期研究中發(fā)現(xiàn),通過(guò)分析和對(duì)比微陣列數(shù)據(jù)集可以找到腫瘤中差異表達(dá)的基因[6]。本研究通過(guò)分析和對(duì)比微陣列數(shù)據(jù)集GSE61763中的樣本實(shí)驗(yàn)數(shù)據(jù)發(fā)現(xiàn)LncRNA458314在腎透明細(xì)胞癌組織樣本中的表達(dá)與在非病理性腎組織樣本中的表達(dá)相比有明顯差異,信噪比為0.88。因此,本研究通過(guò)新基因編輯系統(tǒng)CRISPR/Cpf1來(lái)編輯腎癌細(xì)胞中的LncRNA458314,以探討LncRNA458314在腎癌發(fā)生發(fā)展中的作用。
1 材料與方法
1.1 主要材料
腎癌細(xì)胞株769P來(lái)源于美國(guó)模式培養(yǎng)物集存庫(kù)細(xì)胞公司,在含有10%胎牛血清的1640培養(yǎng)基,5%CO2、37℃恒溫箱中培養(yǎng)。293T細(xì)胞株購(gòu)自漢恒生物科技(上海)有限公司,在含有10%胎牛血清的DMEM培養(yǎng)基,5%CO2、37℃恒溫箱中培養(yǎng)。RNA提取試劑盒購(gòu)買(mǎi)自上海超研生物科技有限公司,反轉(zhuǎn)錄試劑盒及熒光定量PCR試劑盒購(gòu)買(mǎi)自南京諾維贊生物科技有限公司。蛋白質(zhì)印跡實(shí)驗(yàn)使用的一抗pAKT、pERK、LC3A/B、GAPDH及二抗均購(gòu)自美國(guó)CST公司。
1.2 方法
1.2.1 克隆靶向LncRNA458314 CRISPR/Cpf1質(zhì)粒 共分為5個(gè)步驟:① 設(shè)計(jì)兩個(gè)gRNA序列,gRNA1的序列為 5′-ACACTGGAAGCCCCTGAGAGAGA-3′,gRNA2的序列為5′-CAGATTCGTGTCTATGTTCTTCT-3′; ② BSMBI內(nèi)切酶切開(kāi)PY108質(zhì)粒并提純; ③ 將克隆的gRNA序列克隆連接于PY108質(zhì)粒中; ④ 轉(zhuǎn)化; ⑤ 目的質(zhì)粒測(cè)序驗(yàn)證。
1.2.2 制作慢病毒 REV、GAG和VSVG質(zhì)粒的制備:3支搖菌管中分別加入5 μL上述3種菌液和5 mL氨芐西林抗性培養(yǎng)基,然后置于37℃搖床12 h。按小抽試劑盒說(shuō)明書(shū)抽提3種質(zhì)粒后,放于-20℃?zhèn)溆谩?/p>
病毒液制備:三無(wú)(無(wú)血清、無(wú)雙抗、無(wú)谷氨酰胺)DMEM培養(yǎng)基饑餓293T細(xì)胞2 h后換成普通DMEM培養(yǎng)基,然后配置A和B液(A液為200 μL三無(wú)培養(yǎng)基加1.5 μg目的質(zhì)粒和包裝系統(tǒng)混合液3 μg;B液為200 μL三無(wú)培養(yǎng)基加4 μL lip2000并于室溫放置5 min)。將上述A、B液混勻后,室溫放置20 min后加入293T細(xì)胞中。第3天將原培養(yǎng)基換為含有2%血清的DMEM培養(yǎng)基。第5天收集病毒液(3 000 r/min離心10 min,去除沉淀,取上清液),置于-80℃保存。
1.2.3 病毒感染769 P細(xì)胞 第1天種適當(dāng)密度的769P細(xì)胞至6孔板;第2天加入病毒液;第3天補(bǔ)加1 mL培養(yǎng)基,保留原病毒液;第4天消化細(xì)胞,取5、10、20、50和100 μL細(xì)胞懸液分別加入大板中進(jìn)行培養(yǎng);第5天加入濃度為1 μg/ μL的嘌呤霉素10 μL進(jìn)行篩選,大約1~2周后有單克隆出現(xiàn)。挑選17個(gè)單克隆分別置于6孔板培養(yǎng),等待滿板后用于熒光定量PCR檢測(cè)。
1.2.4 實(shí)時(shí)定量PCR檢測(cè)LncRNA458314的表達(dá) 將培養(yǎng)的所有單克隆細(xì)胞用RNA提取試劑盒提取出RNA后,使用分光光度儀檢測(cè)RNA的濃度及純度,再使用反轉(zhuǎn)錄試劑盒將RNA反轉(zhuǎn)錄為cDNA,反轉(zhuǎn)錄反應(yīng)條件為37℃ 15 min,85℃ 5 s。最后按照RT-PCR試劑盒說(shuō)明書(shū)檢測(cè)對(duì)照組769P細(xì)胞和實(shí)驗(yàn)組單克隆細(xì)胞中LncRNA458314 的相對(duì)表達(dá)量,反應(yīng)條件:預(yù)變性95 ℃ 5 min;40個(gè)循環(huán)反應(yīng)95 ℃ 10 s,60 ℃ 30 s;溶解曲線95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。
1.2.5 CCK8實(shí)驗(yàn)檢測(cè)LncRNA458314敲除后769P細(xì)胞的增殖能力 準(zhǔn)備對(duì)照組和實(shí)驗(yàn)組細(xì)胞,通過(guò)細(xì)胞計(jì)數(shù)將96孔板的每個(gè)單孔細(xì)胞固定為1萬(wàn)個(gè),并設(shè)置0、24、48和72 h四個(gè)時(shí)間點(diǎn)。按照CCK-8試劑盒說(shuō)明書(shū)的實(shí)驗(yàn)步驟進(jìn)行操作,分別測(cè)得對(duì)照組及單克隆組各時(shí)間點(diǎn)的光密度(D)值用于分析和作圖。
1.2.6 蛋白質(zhì)印跡檢測(cè)LncRNA458314敲除后769P細(xì)胞pAKT、pERK、LC3A/B蛋白的表達(dá) 收集細(xì)胞后,加入裂解液裂解細(xì)胞30 min,提取蛋白后根據(jù)標(biāo)準(zhǔn)曲線檢測(cè)蛋白濃度,蛋白變性后上樣予SDS-PAGE凝膠電泳,用PVDF膜轉(zhuǎn)膜后,以3%BSA封閉1 h,以兔抗人一抗pAKT、pERK、LC3A/B和GAPDH(1 ∶1 000)4℃ 孵育過(guò)夜,羊抗兔二抗(1 ∶5 000)室溫孵育2 h,使用化學(xué)發(fā)光成像系統(tǒng)曝光。
1.3 統(tǒng)計(jì)學(xué)分析
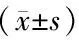
2 結(jié)果
2.1 克隆靶向LncRNA458314 CRISPR/Cpf1質(zhì)粒結(jié)果
使用酶切、連接克隆靶向LncRNA458314 CRISPR/Cpf1質(zhì)粒后進(jìn)行電泳。靶向LncRNA458314 CRISPR/Cpf1質(zhì)粒大小為12.8 kb,見(jiàn)圖1。提取目的質(zhì)粒進(jìn)行測(cè)序,測(cè)序結(jié)果顯示LncRNA458314 CRISPR/Cpf1質(zhì)粒構(gòu)建成功,見(jiàn)圖2。

圖1 LncRNA458314 CRISPR/Cpf1質(zhì)粒電泳圖

圖2 LncRNA458314 CRISPR/Cpf1質(zhì)粒測(cè)序結(jié)果
2.2 敲除單克隆中LnRNA458314的表達(dá)
實(shí)時(shí)定量PCR結(jié)果顯示,17個(gè)單克隆細(xì)胞中的LncRNA458314表達(dá)量較對(duì)照組細(xì)胞均有下調(diào),見(jiàn)圖3。

C:對(duì)照組;1-17:1號(hào)-17號(hào)敲除單克隆
通過(guò)多次實(shí)時(shí)定量PCR檢測(cè)對(duì)比后,挑選了6號(hào)(6#)、13號(hào)(13#)單克隆進(jìn)行后續(xù)實(shí)驗(yàn)。同時(shí)再次對(duì)6#、13#單克隆進(jìn)行實(shí)時(shí)定量PCR檢測(cè),證實(shí)6#、13#單克隆中的LncRNA458314表達(dá)量較對(duì)照組顯著下降(6#:t=-32.237,P<0.01;13#:t=-26.653,P<0.01)。見(jiàn)圖4。

*:P<0.01,與對(duì)照組比較
2.3 LncRNA458314敲除單克隆的增殖能力
CCK8實(shí)驗(yàn)結(jié)果顯示,LncRNA458314下調(diào)后,單克隆6#和13#在72 h時(shí)間點(diǎn)的增殖能力較對(duì)照組明顯下降(6#:t=-3.798,P<0.05;13#:t=-6.411,P<0.01)。見(jiàn)圖5。

*:P<0.05,#:P<0.01,與對(duì)照組比較
2.4 LncRNA458314敲除單克隆pAKT、pERK和LC3A/B的表達(dá)
蛋白質(zhì)印跡結(jié)果顯示,6#和13#單克隆pAKT的表達(dá)水平顯著下降(6#:t=-63.827,P<0.01;13#:t=-113.332,P<0.01);pERK的表達(dá)水平明顯下降(6#:t=-28.545,P<0.01;13#:t=-111.135,P<0.01);LC3A/B的表達(dá)顯著上升(6#:t=24.417,P<0.01;13#:t=43.140,P<0.01)。見(jiàn)圖6。
3 討論
腎癌是一種多基因相關(guān)的腫瘤,通過(guò)研究腎癌相關(guān)LncRNA可以加深人們對(duì)于腎癌發(fā)病機(jī)制的理解,同時(shí)也有利于腎癌的診斷和治療[7]。新基因編輯系統(tǒng)CRISPR/Cpf1中的Cpf1是Cas9的替代者,與Cas9相比,Cpf1有其獨(dú)特的優(yōu)勢(shì)[8]。第一,Cpf1的分子量比 Cas9 小且只需要一個(gè)RNA分子輔助即可[9-10];第二,Cpf1識(shí)別的PAM序列具有特征性,能更好地進(jìn)行基因編輯[11];第三,Cpf1切割DNA形成黏性末端,相比于Cas9 切割 DNA 形成的平末端,能更好地使目的基因插入[12]。目前CRISPR 基因編輯技術(shù)的缺點(diǎn)是可能存在脫靶效應(yīng)[13]。脫靶效應(yīng)的產(chǎn)生原因就是CRISPR/Cpf1在基因編輯中達(dá)到編輯目的后不能及時(shí)終止,從而導(dǎo)致在不必要的位點(diǎn)隨意剪切[14]。對(duì)CRISPR/Cpf1 基因編輯來(lái)說(shuō),精確調(diào)控 Cpf1在什么時(shí)間、什么位置進(jìn)行基因編輯是十分重要的[15]。目前已有研究發(fā)現(xiàn)抗 CRISPR 蛋白可以有效地降低脫靶效應(yīng),其中的一種名叫“AcrllA4”的蛋白能將脫靶效應(yīng)發(fā)生率減少 4 倍左右[16]。我們通過(guò)新基因編輯系統(tǒng)CRISPR/Cpf1成功敲除了腎癌細(xì)胞中的LncRNA458314,并通過(guò)初步研究發(fā)現(xiàn)腎癌的發(fā)生與發(fā)展可能與LncRNA458314相關(guān),對(duì)該LncRNA的進(jìn)一步分析有利于揭示腎癌的發(fā)病機(jī)制,從而可能為腎癌的早期篩查提供新的分子標(biāo)志物。

*:P<0.01,與對(duì)照組比較
本研究結(jié)果表明LncRNA458314敲除后單克隆6#和13#的增殖能力明顯下降。蛋白質(zhì)印跡結(jié)果顯示,下調(diào)腎癌769P細(xì)胞中LncRNA458314的表達(dá)后,pAKT和pERK的表達(dá)水平下降,LC3A/B的表達(dá)上升。AKT在調(diào)控細(xì)胞增殖和凋亡的過(guò)程中起到至關(guān)重要的作用。研究表明AKT通過(guò)磷酸化和滅活多個(gè)靶標(biāo)來(lái)抑制凋亡從而促進(jìn)了細(xì)胞的增殖[17]。LncRNA458314敲除后單克隆6#和13#的pAKT表達(dá)下降,我們推測(cè)LncRNA458314通過(guò)激活pAKT來(lái)促進(jìn)腎癌細(xì)胞的增殖。pERK信號(hào)通路與癌癥診斷和治療密切相關(guān)并且可以響應(yīng)多種細(xì)胞內(nèi)刺激,例如促分裂原、激活生長(zhǎng)因子和細(xì)胞因子等[18]。pERK的表達(dá)在LncRNA458314敲除后單克隆6#和13#中降低,推測(cè)LncRNA458314可能激活了pERK的表達(dá),從而促進(jìn)了腎癌的發(fā)生發(fā)展。研究表明LC3A/B表達(dá)的高低與細(xì)胞自噬的能力有著一定的關(guān)系[19]。LC3A/B表達(dá)量在LncRNA458314敲除后單克隆6#和13#中表達(dá)明顯增加,我們推測(cè)LncRNA458314通過(guò)抑制LC3A/B的表達(dá)進(jìn)而抑制了細(xì)胞自噬。
綜上所述,本研究應(yīng)用新基因編輯系統(tǒng)CRISPR/Cpf1成功敲除了腎癌細(xì)胞769P中的LncRNA458314。實(shí)驗(yàn)初步證實(shí)LncRNA458314可能是促進(jìn)腎癌細(xì)胞增殖的重要基因,LncRNA458314可能通過(guò)調(diào)控pAKT、pERK和LC3A/B發(fā)揮其生物學(xué)作用。
 江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)2020年1期
江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)2020年1期
- 江蘇大學(xué)學(xué)報(bào)(醫(yī)學(xué)版)的其它文章
- 血清IL-33水平對(duì)動(dòng)脈粥樣硬化性腦梗死患者預(yù)后的預(yù)測(cè)價(jià)值
- 基于多重?cái)?shù)據(jù)庫(kù)的腎癌轉(zhuǎn)移相關(guān)基因生物信息分析及功能初探
- RNAi沉默Sox2表達(dá)對(duì)結(jié)直腸癌細(xì)胞5-氟尿嘧啶的增敏作用
- 氣體信號(hào)分子硫化氫在腫瘤發(fā)生發(fā)展與治療中的作用研究進(jìn)展
- 本刊對(duì)來(lái)稿統(tǒng)計(jì)學(xué)分析表述的要求
- 流式細(xì)胞術(shù)檢測(cè)細(xì)胞周期實(shí)驗(yàn)條件的影響因素分析
