金槍魚粉的酶解工藝及其酶解產物功能活性研究
,*
(1.浙江萬里學院生物與環境學院,浙江寧波 315100; 2.浙江醫藥高等專科學校制藥工程學院,浙江寧波 315100)
金槍魚(Tuna)作為深海“魚中之王”,肉質蛋白質高、脂肪低,氨基酸組成與人體需求接近,富含二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)等不飽和脂肪酸[1],是一種營養食材。金槍魚加工制作罐頭和生魚片過程中產生大量的邊角料[2],由于受加工及保藏條件限制,金槍魚邊角料一般經簡單的粗加工生產魚粉被作為飼料、肥料出售。由于金槍魚邊角料中蛋白質含量高,如何將這些蛋白資源高值化利用,對于金槍魚產業的發展具有重要意義。
將金槍魚邊角料烘干打成粉俗稱金槍魚粉,采用酸水解、堿水解、酶解或者是菌酶協同處理方法,可以得到金槍魚的水解多肽和氨基酸。由于酶解法具有反應條件溫和、破壞原有營養物質少、無污染、酶解蛋白水溶性好等特點,越來越多地被應用于水產蛋白粉的研究中[3]。Hsu[4-5]采用木瓜蛋白酶(PA)和蛋白酶XXIII(PR)水解金槍魚黑肌肉副產物,純化蛋白水解產物,評價了其抗氧化性和對乳腺癌細胞MCF-7的抗增殖活性,結果表明,分子量為390~1400 Da的肽組分具有抗氧化和抗增殖活性,并測定了從PA和PR水解產物中分離出的兩個抗增殖肽的氨基酸序列,分別是Leu-Pro-His-Val-Leu-Thr-Pro-Glu-Gly-Ala-Thr(1206 Da)和Pro-Thr-Ala-Gly-Gly-Val-Tyr-Met-Val-Thr(1124 Da),它們顯示了對MCF-7細胞體外的劑量依賴性抑制作用,IC50值分別為8.1和8.8 μmol·L-1,表明金槍魚黑肌肉副產品中的抗氧化和抗增殖酶解物可能是食品和營養應用中的有用成分。
金槍魚副產物來源、酶制劑選擇以及酶解工藝不同都影響著酶解效果。如陳啟航等[6]對金槍魚蒸煮液進行酶解的最佳酶制劑為木瓜蛋白酶,在56 ℃、添加量300 U/g條件下酶解4 h,此時水解度為27.44%±0.04%。王雨生等[7]為了從金槍魚皮制備膠原蛋白肽,從木瓜蛋白酶、中性蛋白酶、堿性蛋白酶、風味蛋白酶中篩選出金槍魚皮酶解的最佳蛋白酶是中性蛋白酶,酶添加量1000 U/g金槍魚皮、酶解4 h,肽得率29.03%。文獻報道[8]利用胰蛋白酶對金槍魚暗色肉酶解制備的酶解液中必需氨基酸含量占總氨基酸含量的42.38%,可作食品營養補充劑。金槍魚副產物的相關酶解產物在飼料、醫藥領域的應用研究均有報道[9-10]。
為了提高金槍魚粉附加值,本研究以金槍魚粉為原料,以水解度(Degree of hydrolysis,DH)為指標,通過適宜于金槍魚粉的酶制劑優選,篩選出合適又經濟的金槍魚粉水解蛋白酶,以單因素實驗和響應面試驗確定金槍魚粉酶解蛋白肽的制備新工藝。在此基礎上,對金槍魚酶解物進行抗氧化性、對酪氨酸酶抑制性、以及抑菌性等功能性實驗,以期為金槍魚粉的高效酶解產業化開發和其綜合應用提供參考。
1 材料與方法
1.1 材料與儀器
金槍魚粉 金槍暗色肉邊角料5 ℃烘干,粉碎過30目篩備用,蛋白質含量為61.56%,寧波豐肽生物科技有限公司提供,冰箱-18~0 ℃保存;胰蛋白酶 0.4萬U·g-1,國藥集團;中性蛋白酶 80萬U·g-1,江蘇銳陽生物科技公司;堿性蛋白酶 20萬U·g-1,寧波豐肽生物科技有限公司;風味蛋白酶 3萬U·g-1,寧波豐肽生物科技有限公司;大腸桿菌 浙江萬里學院微生物實驗室提供;甲醛-水溶液(37%~40%)、硫酸銅、硫酸鉀、硫酸、鹽酸、氫氧化鈉 分析純,國藥集團。
BP121S精密天平 上天精密儀器有限公司;6~16 k低速大容量冷凍離心機 Sigma公司;PH-100A pH計 邦西儀器科技有限公司;SH220N石墨消解儀 上海卓好實驗室設備有限公司;K9860全自動凱氏定氮儀 濟南海能儀器股份有限公司;TU-1810紫外-可見分光光度計 北京普析通用儀器有限公司。
1.2 實驗方法
1.2.1 金槍魚粉的酶解工藝

取一定量的金槍魚粉于適量的純化水中,攪拌均勻后,用6 mol·L-1NaOH溶液調整混合液的pH,再加入適量的酶制劑,恒溫攪拌酶解。酶解結束后于100 ℃滅酶15 min,以4000 r·min-1離心酶解混合液10 min,得到酶解液。
1.2.2 金槍魚粉酶解的酶制劑篩選與單因素實驗
1.2.2.1 酶制劑篩選 取金槍魚粉5 g,按1∶5料液比加蒸餾水,按2500 U·g-1(魚粉)分別添加風味蛋白酶、胰蛋白酶、堿性蛋白酶、中性蛋白酶,酶解6 h(酶解液pH和溫度選擇為各商品酶的最適條件)。以水解度為指標比較各蛋白酶對金槍魚粉的酶解效果。
1.2.2.2 料液比對水解度的影響 取5 g金槍魚粉5份,按料液比為1∶3、1∶5、1∶7、1∶9 (g/mL)加水攪勻,用6 mol·L-1NaOH調pH至10,按2500 U·g-1加入堿性蛋白酶,在55 ℃酶解6 h。其余操作按“1.2.1”項。取酶解液測定水解度。
1.2.2.3 加酶量對水解度的影響 取5 g金槍魚粉5份,按料液比1∶5加水攪勻,加酶量為0.5×104、0.75×104、1×104、1.25×104、1.5×104U·g-1原料,其它酶解條件同“1.2.2.2”。
1.2.2.4 酶解液pH對水解度的影響 取5 g金槍魚粉6份,按料液比1∶5加水攪勻,加入堿性蛋白酶10000 U·g-1原料,用6 mol·L-1NaOH分別調pH至7、8、9、10、11、12,在溫度55 ℃酶解6 h,其它酶解條件同“1.2.2.2”。
1.2.2.5 酶解溫度對水解度的影響 取5 g金槍魚粉5份,按料液比1∶5加水攪勻,加入堿性蛋白酶10000 U·g-1原料,用6 mol·L-1NaOH分別調pH至10,在溫度分別為45、50、55、60、65 ℃下酶解6 h,其它酶解條件同“1.2.2.2”。
1.2.2.6 酶解時間對水解度的影響 取5 g金槍魚粉5份,按料液比1∶5加水攪勻,加入堿性蛋白酶10000 U·g-1原料,在溫度55 ℃,pH為10.0的條件下分別酶解3、6、7.5、9、12 h。其它酶解條件同“1.2.2.2”。
1.2.3 金槍魚粉酶解的響應面試驗優化 在單因素實驗基礎上,以水解度為指標,根據Box-Behnken中心組合試驗法進行3因數3水平試驗設計,確定堿性蛋白酶解金槍魚粉的最佳工藝條件,實驗因素及水平見表1。
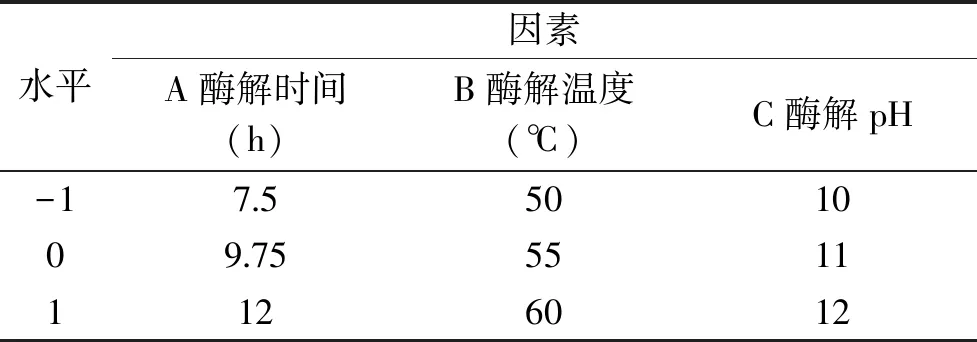
表1 響應面試驗設計因素水平表Table 1 Factors and levels of response surface methodology
1.2.4 水解度測定 總氮含量N(g·100 mL-1)根據GB 5009.5-2010凱氏定氮法測定;氨基酸態氮含量n(g·100 mL-1)根據GB 5009.235-2016甲醛滴定法測定。水解度DH按下式計算[11]:
1.2.5 金槍魚粉酶解液的功效性測定

表3 不同酶對金槍魚粉水解度的影響Table 3 Effects of different kinds of proteases on hydrolysis degree of tuna powder
1.2.5.1 金槍魚粉酶解液樣品制備 按“1.2.3”項優化工藝條件制備,濃縮后得到氨基酸態氮含量為7.57 mg·mL-1的金槍魚粉酶解液。
1.2.5.2 對羥自由基清除率測定 參照文獻[11]。取9 mmol·L-1硫酸亞鐵溶液1 mL、9 mmol·L-1水楊酸-乙醇溶液1 mL于試管中,分別加入稀釋15、20、25、30、35倍的酶解液1 mL,最后加8.8 mmol·L-1過氧化氫溶液1 mL啟動反應,37 ℃反應30 min,于510 nm測吸光度,記為Ax。以1 mL蒸餾水代替酶解液作空白,記為A0。以1 mL蒸餾水代替H2O2作酶解液本底,記為Ax0。
1.2.5.3 總還原力測定 參照文獻[12]。在試管中分別加入0.2、0.4、0.6、0.8、1.0 mL酶解液樣品,用蒸餾水稀釋至1.0 mL,同時取1.0 mg·mL-1維生素C 0.2、0.4、0.6、0.8、1.0 mL并用蒸餾水稀釋至1.0 mL為參照。分別加入0.2 mol·L-1、pH6.6的磷酸鹽緩沖液(PBS)2.5 mL,再加入1%鐵氰化鉀2.5 mL,混勻,于50 ℃水浴20 min,加入10%三氯乙酸1 mL混勻,離心,取2.5 mL上清液,加蒸餾水2.5 mL和0.1%氯化鐵0.5 mL,放置15 min后于700 nm處測吸光度。
1.2.5.4 對酪氨酸酶抑制率測定 參照唐煜括等[12]方法。量取0.2、0.4、0.6、0.8、1.0 mL樣品,再用蒸餾水稀釋至1.0 mL,備用,按表2將PBS緩沖液(pH6.6)、金槍魚酶解液、5 mmol·L-1的L-酪氨酸溶液加好后于37 ℃保溫10 min,再加入100 U·mL-1的酪氨酸酶混勻,于37 ℃保溫30 min后立即測定475 nm吸光度。酶解液對酪氨酸酶抑制率如下計算:
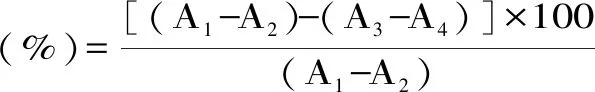

表2 金槍魚酶解液對酪氨酸酶抑制率的反應液組成Table 2 Composition of reaction liquid of tuna lysate against tyrosinase
1.2.5.5 對大腸桿菌的抑制實驗 參照王葉青等[13]方法。取用0.22 μm濾膜過濾除菌后的不同濃度1.52~121.6 μg·mL-1(以氨基態氮濃度計)的金槍魚酶解液100 μL,加入到含有5 mL的LB培養基中,再分別加入50 μL活化好的大腸桿菌菌液(107~108CFU·mL-1),于37 ℃、150 r·min-1振蕩培養24 h,測定540 nm處大腸桿菌培養液的吸光度AX,同時以100 μL無菌蒸餾水代替酶解液作對照A0,計算抑菌率(%)=(A0-AX)×100/A0。
1.3 數據處理
2 結果與分析
2.1 酶制劑篩選
由表3可知,四種蛋白酶對金槍魚粉的水解度為:堿性蛋白酶>風味蛋白酶>中性蛋白酶>胰蛋白酶。由于添加酶制劑的量較低,總體水解度偏低。酶解效果以堿性蛋白酶與風味蛋白酶較好,水解度大于14%。堿性蛋白酶可作用于色氨酸、丙氨酸、苯丙氨酸、亮氨酸等形成的多種肽鍵,酶切位點較多,能較徹底地水解底物蛋白[14],且堿性蛋白酶性價比高,考慮工業化生產成本,選擇堿性蛋白酶為金槍魚粉的酶制劑。
2.2 酶解單因素實驗結果
2.2.1 料液比對水解度的影響 由圖1可知,隨著料液比增加,水解度呈先增大再減小的變化趨勢,在料液比為1∶5時,金槍魚粉酶解液的水解度最大。這是因為料液比對體系的粘稠度有影響,當料液比較小時,酶解液粘度較大,不利于酶制劑和酶解產物的擴散;當料液比較高時,不利于酶與底物充分接觸,也不利于酶解[15]。因此,選擇料液比為1∶5。

圖1 料液比對水解度影響Fig.1 Effects of material liquid ratio on hydrolysis degree
2.2.2 加酶量對水解度的影響 由圖2可知,隨著加酶量增加,水解度增大,當加酶量為10000 U·g-1原料時,蛋白水解度為25.15%±0.30%,之后酶量增加對水解度影響趨于平緩。增加酶制劑用量,可以提高底物與酶的接觸率,加速酶解反應進程,提高水解度。隨著酶解產物濃度的提高,產物與未作用的酶有可能形成復合物,阻礙底物與酶的作用,減緩水解進程[16],因此選用10000 U·g-1原料為最適加酶量。

圖2 加酶量對水解度的影響Fig.2 Effects of enzyme dosage on the degree of hydrolysis
2.2.3 酶解液pH對水解度的影響 由圖3可知,酶解效果受酶解液pH影響大,隨pH的增大水解度增大,在pH為11時,水解度達到最大,當pH為12時,水解度急劇下降。這是因為強堿對堿性蛋白酶的空間結構有極大的破壞作用,使其失去相應的活性[17]所致。本實驗選擇酶解液pH為11。
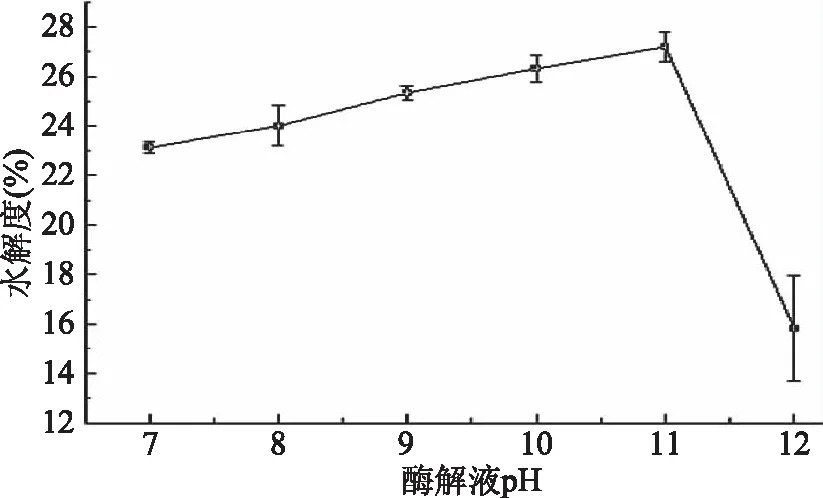
圖3 酶解液pH對水解度的影響Fig.3 Effects of pH value on the degree of hydrolysis
2.2.4 酶解溫度對水解度的影響 由圖4可知,隨著酶解溫度的升高,酶活性增強,酶促反應加快,水解度增大。55 ℃時,水解度達最大值。繼續升高溫度,水解度反而下降。這是因為酶解溫度過高會導致酶分子結構的次級鍵解體,酶蛋白變性,酶活力減弱[18]。因此,堿性蛋白酶酶解金槍魚粉最適溫度為55 ℃。

圖4 酶解溫度對水解度的影響Fig.4 Effects of hydrolysis temperature on the degree of hydrolysis
2.2.5 酶解時間對水解度的影響 由圖5可知,隨酶解時間增加,酶解液的水解度增大,當酶解時間達到9 h時,水解度變化趨緩。因為酶解剛開始時,底物和酶的質量濃度均比較高,接觸面積較大,酶解速度較快,水解度增幅較大;隨著反應進行,酶量減少,酶解液中游離肽不斷積累,水解度趨緩。當酶解時間為7.5、9、12h時,對應的水解度分別是25.85%±0.28%、26.92%±0.42%、26.63%±0.11%,差異不大。所以后續進一步對酶解時間在7.5~12 h進行優化。
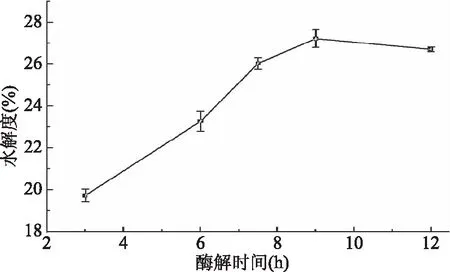
圖5 酶解時間對水解度的影響Fig.5 Effects of reaction time on the degree of hydrolysis
2.3 Box-Behnken響應面優化結果
2.3.1 響應面試驗設計與結果 根據單因素實驗結果,選擇酶解時間、酶解液pH與溫度進行Box-Behnken響應面設計試驗,以水解度為指標,結果見表4。
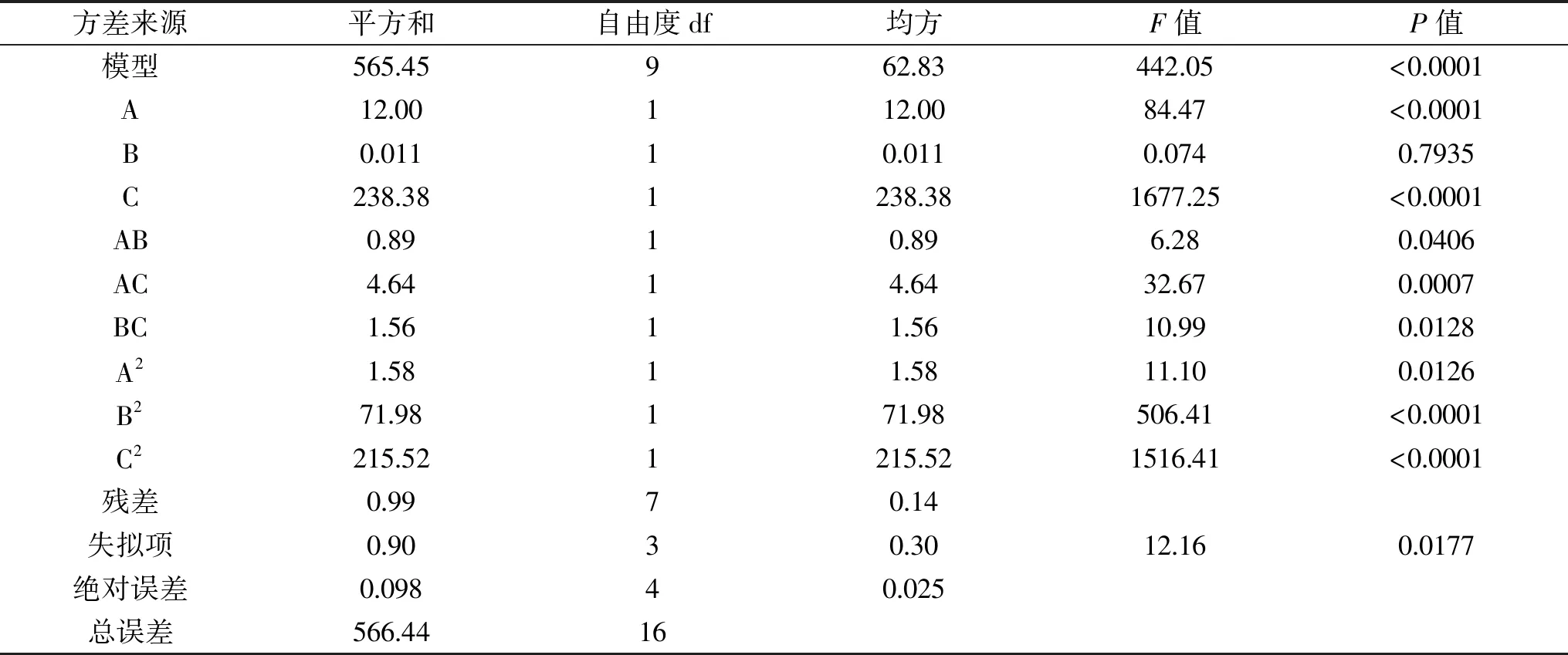
表5 回歸模型的方差分析Table 5 Analysis of variance of regression model
注:P<0.05、P<0.01分別表示差異顯著和極顯著。

表4 響應面試驗結果Table 4 Results of RSM test
2.3.2 數學模型的建立及顯著性檢驗 利用Design Expert 8.0統計軟件對表4的數據進行多元回歸擬合,得到水解度的二次項回歸模型方程為:
DH(%)=29.64-1.22A+0.036B-5.46C-0.47AB-1.08AC+0.63BC-0.61A2-4.13B2-7.15C2
表5為回歸模型的方差分析,該模型的P值小于0.0001,表明二次回歸模型極顯著;失擬項P=0.017>0.01,說明該回歸方程擬合度良好;模型的校正系數表明響應值的變化有97.44%是有所選因數引起的,說明該模型能正確反映水解度與時間、溫度和pH之間的關系。

圖6 酶解溫度與pH的交互作用對金槍魚粉水解度的影響Fig.6 Effect of temperature of enzymatic hydrolysis and pH on hydrolysis degree of tuna powder
酶解時間、酶解溫度和酶解液pH的F值大小為:C>A>B,可知對于水解度DH影響因素強弱順序為:酶解液pH>酶解時間>酶解溫度。一次項A、C影響極顯著(P<0.01),B影響不顯著(P>0.05);二次項A2顯著(P<0.05),B2、C2極顯著(P<0.01);交互項中AC極顯著(P<0.01),AB、BC顯著(P<0.05),表明酶解溫度、酶解時間、以及酶解液pH兩兩相互之間對酶解效率均有協同作用。各因子的交互作用對結果影響見圖6~圖8。由圖6~圖8可知,酶解液pH、酶解時間、酶解溫度兩兩之間的交互作用顯著。
2.3.3 驗證試驗 根據Design Expert 8.0軟件分析得出,最佳工藝參數為:酶解時間8.13 h,酶解溫度55.10 ℃,酶解液pH10.67,模型對水解度的理論預測值30.97%。考慮到試驗的可行性,按照酶解時間8 h,酶解溫度55 ℃,酶解液pH10.5進行5次驗證試驗。得到水解度為29.20%±0.08%,與理論值接近,相對誤差為6.08%。

圖7 酶解時間與溫度的交互作用對金槍魚粉水解度的影響Fig.7 Effect of enzymatic hydrolysis time and temperature on the hydrolysis degree of tuna powder

圖8 酶解時間與pH的交互作用對金槍魚粉水解度的影響Fig.8 Effects of enzymatic hydrolysis time and pH on hydrolysis degree of tuna powder
說明應用響應面法優化堿性蛋白酶水解金槍魚粉的工藝參數是可行的,模型具有較好的可靠性。
2.4 金槍魚酶解液的生物活性
2.4.1 金槍魚酶解液對羥自由基清除結果 由圖9可知,金槍魚酶解液對羥自由基清除率隨酶解液中氨基態氮濃度的增加而增強,當氨基態氮濃度為0.5047 mg·mL-1時,其清除率可達80%,且濃度再增加,其清除率趨于穩定。金槍魚粉酶解產物主要含氨基酸、小分子多肽等,這些物質可與Fe2+結合阻斷羥自由基生成,清除羥自由基。Hsu等[19]從金槍魚煮汁中分離到富含Glu、Ala、Asp的抗氧化活性肽。
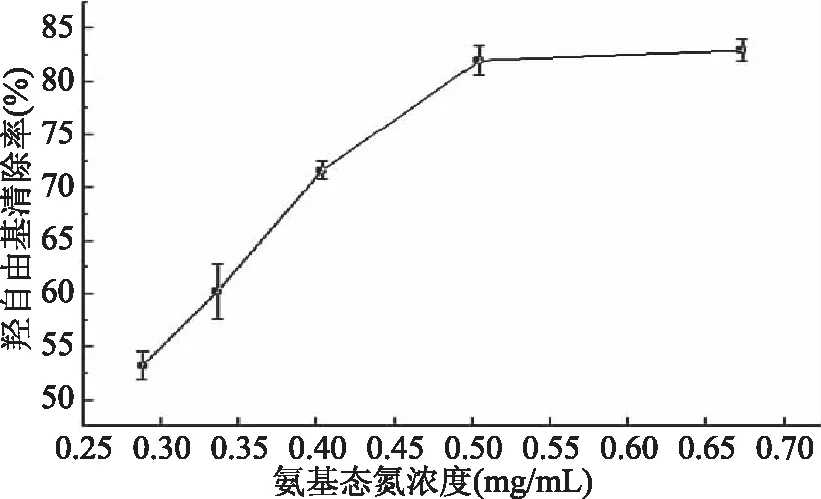
圖9 金槍魚酶解液對羥自由基的清除率Fig.9 Scavenging rate of the enzymatic hydrolysates of tuna to hydroxyl radical
2.4.2 酶解液總還原力 還原力可以判定酶解液是否為優良的電子供體,一般情況下,物質的還原力與抗氧化力呈正相關。由圖10可知,隨著金槍魚粉酶解液中氨基態氮濃度增加,總還原力增強。當氨基態氮濃度為7.57 mg·mL-1時,其還原力與0.4 mg·mL-1維生素C接近。金槍魚粉酶解液的還原力大小與其水解后多肽、氨基酸中羥基增加有關,這些基團有利于與Fe3+結合并將其還原為Fe2+[20]。

圖10 金槍魚粉酶解液與維生素C的總還原力對比Fig.10 Comparison of total reducing power between enzymatic hydrolysate of tuna powder and vitamin C
2.4.3 酶解液對酪氨酸酶的抑制作用 由圖11可知,酶解液濃度對酪氨酸酶的抑制率呈線性關系,線性方程為y=9.749x+16.46(r=0.9617),當酶解液中氨基酸態氮含量為7.57 mg·mL-1時,對酪氨酸酶的抑制率達到了84.8%,其半數抑制率為IC50=3.44 mg·mL-1。酶解液中的小分子多肽可與酪氨酸酶結合,破壞酪氨酸酶的活性中心,導致酪氨酸酶失活[21]。

圖11 金槍魚酶解液對酪氨酸酶抑制作用Fig.11 Inhibition of tuna enzymolysis liquid on tyrosinase
2.4.4 酶解液的抑菌作用 由圖12可知,加入酶解液的培養基,具有抑制大腸桿菌生長的作用,并且抑菌效果隨氨基態氮濃度增加而升高。李慧等[22]的研究結果表明,從黃鰭金槍魚皮酸化后的提取液中分離出分子量為3.4 kDa的多肽,對大腸桿菌表現出強效的抑制作用,且不具有溶血性,是研制藥物、食品和飼料添加劑的潛在物質。本實驗結果表明金槍魚酶解液有抑菌作用,表明含有抗菌多肽。

圖12 金槍魚酶解液對大腸桿菌的抑制作用Fig.12 Inhibition of tuna enzymolysis liquid on E.coli
金槍魚粉酶解液的功能性實驗證明了酶解液具有較好的抗氧化性、酪氨酸酶抑制性和一定的抑菌性,這一結果與文獻[23-24]的研究結果相似。這為其作為功能性食品、飼料添加劑提供了應用依據,也為后續分離純化活性組分奠定了實驗基礎。
3 結論
本研究以金槍魚魚粉為原料,以水解度為評定指標,從胰蛋白酶、中性蛋白酶、堿性蛋白酶、風味蛋白酶中篩選出堿性蛋白酶為金槍魚粉的最適酶,利用單因素實驗和響應面法優化堿性蛋白酶酶解金槍魚粉的工藝,得到最優酶解條件為:料液比1∶5 (g∶mL)、加酶量為1×104U·g-1金槍魚粉、酶解溫度55 ℃、酶解液pH為10.5、酶解時間8 h,此條件下水解度為29.20%±0.08%。
對金槍魚魚粉酶解液的功能性評價發現,酶解液具有較好的抗氧化性,對·OH自由基的清除率、對酪氨酸酶的抑制率均隨氨基酸態氮濃度的增加而增大;當氨基態氮濃度為7.57 mg·mL-1時,其總還原力與0.4 mg·mL-1維生素C接近;酶解液對大腸桿菌的生長有一定抑制作用,在一定濃度范圍內抑菌效果隨氨基態氮濃度增加而升高。
后續將進一步對金槍魚酶解液中多肽進行分離純化研究,為從金槍魚粉酶解液中尋找具有抗氧化功能活性的活性多肽提供物質基礎。

