中藥全蝎白術白頭翁組合品發酵前后水提液不同截留分子量段的活性成分及體外抗腫瘤研究
劉金虎 趙國慶 毛會秀 方園 陶然 張瑞 史磊 王集會
摘 ?????要:比較全蝎白術白頭翁組合發酵品(SAPZFP)與未發酵品(SAPZP)水提液不同截留分子量凍干粉活性成分及體外抗腫瘤活性的差異。分別測定各截留分子量段水溶性氨基酸、蛋白質、多糖的含量,并采用MTT法研究其對乳腺癌細胞株MCF - 7的抑制作用。SAPZFP截留分子量<5、5 ~ 10、>10 kDa凍干粉對乳腺癌細胞株MCF - 7的IC50分別為0.854、0.315、0.071 mg·mL-1;SAPZP的分別為1.128、0.360、0.115 mg·mL-1。SAPZFP截留分子量>10 kDa的抗腫瘤活性顯著,球孢白僵菌雙向固體發酵技術可顯著增強本組合物的體外抗腫瘤活性。
關 ?鍵 ?詞:中藥組合品;超濾;水溶性活性成分;抗腫瘤
中圖分類號:R285.5 ??????文獻標識碼:?A ??????文章編號: 1671-0460(2020)01-0032-05
Study on the Active Constituents?and Anti-tumor Activity in Vitro of Water Extracts?With Different Molecular Weight Cut-off Segments of Chinese Medicine Scorpio,?Atractylodes Macrocephala and Pulsatillachinensis
Mixture?Before and After Fermentation
LIU Jin-hu1,ZHAO Guo-qing1, MAO Hui-xiu1, FANG Yuan1, TAO Ran1, ZHANG Rui1, SHI Lei1, WANG Ji-hui2*
(1. College of Pharmacy, Shandong University of Traditional Chinese Medicine, Shandong?Jinan 250355, China;
2. Center of Experiment, Shandong University of Traditional Chinese Medicine, Shandong Jinan 250355, China)
Abstract: The active constituents and anti-tumor activity in vitro among different molecular weight range of lyophilized powders of SAPZFPs and SAPZPs water extract were compared. The contents of water-soluble amino acid, protein and polysaccharide in various molecular weight ranges?were determined and the inhibitory effect of the drugs on mammary cancer cells strain MCF - 7 was studied by MTT assay. The IC50?of SAPZFP with < 5, 5 ~ 10,> 10 kDa on mammary cancer cells strain MCF - 7 were 0.854, 0.315, 0.071 mg·mL-1, respectively. The IC50?of SAPZP were 1.128, 0.360, 0.115 mg·mL-1, respectively. The anti-tumor activity of SAPZFP with > 10 kDa was significant, and the bidirectional solid fermentation technology of Beauveria bassiana can markedly enhance the anti-tumor activity in vitro.
Key words: Chinese medicine composition; Ultrafiltration; Water-soluble active constituents; Anti-tumor
全蝎白術白頭翁組合發酵品(SAPZFP),是將中藥全蝎、白術、白頭翁按一定配伍比例混合后作為培養基,通過球孢白僵菌(Beauveria bassiana(Bals.)Vuill)雙向固體發酵技術制得的中藥組合發酵品。文獻報道,全蝎的抗腫瘤活性與可溶性蛋白質、多糖[1]、氨基酸[2]的含量有關,有報道白僵菌發酵可提高全蝎的多糖含量[3];白術多糖具有抗腫瘤及調節免疫的作用[4];白頭翁糖蛋白具有免疫增強作用[5]。前期研究表明,在最佳水提工藝條件下,SAPZFP具有體外抗乳腺癌細胞株MCF - 7的活性。據此,本實驗借助超濾膜分離技術,將SAPZFP、SAPZP的水提液分別制備成不同截留分子量段的凍干粉,并對其進行水溶性活性成分含量分析及體外抗腫瘤研究,以確定經球孢白僵菌發酵后是否影響本中藥組合品不同截留分子量段的活性成分含量并增強其體外抗腫瘤活性,進而為后續有效成分的分離純化及發酵技術機制的探究提供理論依據。
1 ?實驗部分
1.1 ?儀器
生物安全柜(蘇凈集團蘇州安泰空氣技術有限
公司);HPS - 5型卷式超濾組件、HPS - 10型卷式超濾組件、MSM - 1812型實驗室用膜分離設備(上海摩速科學器材有限公司);UV9100B型紫外可見分光光度計(北京萊伯泰科儀器有限公司);CKX41型奧林巴斯顯微鏡(Made in Philippines);DNM - 9602型酶標分析儀(北京普朗新技術有限公司)等。1.2 ?試劑
牛血清蛋白(上海伯奧生物科技有限公司);RPMI Medium Modified培養基(HyClone);PBS(1×)PH7.2(SparkJade);胎牛血清(浙江天杭生物科技股份有限公司);MTT(BioFROXX賽國生物科技);胰酶細胞消化液(biosharp);福林酚(上海源葉生物科技有限公司);其它試劑均為國產分析純。
1.3 ?藥材與細胞株
全蝎均為野生成年活蝎,購自山東臨沂,經山東中醫藥大學高德民副教授鑒定為鉗蝎科動物東亞鉗蝎(Buthus martensii?Karsch);白術、白頭翁均購自河北安國中藥材市場,經山東中醫藥大學高德民副教授鑒定符合2015版中國藥典要求;乳腺癌細胞株MCF - 7由山東省立醫院饋贈;球孢白僵菌桃5活化菌種(Beauveria bassiana(Bals.)Vuill)由山東省農業科學院植物保護研究所饋贈。
2 ?實驗方法
2.1 ?SAPZFP的制備
2.1.1 ?全蝎凍干粉的制備
采用凍干非鹽蝎制法[6],取野生成年活蝎,除去雜質,洗凈,于–?80℃凍結,打碎成漿,冷凍干燥即得,并低溫密封保存。
2.1.2 ?PDA培養基的制備
根據張莉等[7]方法,稱定200 g洗凈去皮的馬鈴薯,切成小塊,加水煮爛至能被玻璃棒戳破,用八層紗布過濾,加入20.00 g瓊脂,繼續加熱,攪拌混勻,待瓊脂溶解完全后,加入20.00 g葡萄糖,攪拌均勻,稍冷卻后補水至1000 mL,分裝至大試管中,于115℃滅菌25 min,制成斜面培養基。
2.1.3 ?球孢白僵菌孢子懸液的制備
將球孢白僵菌桃5活化菌種(Beauveria bassiana(Bals.)Vuill)用接種針無菌轉接至PDA培養基,于25 ℃培養7?d后,將二代菌種用無菌水稀釋至1×108個孢子·mL-1,得球孢白僵菌孢子懸液。
2.1.4 ?SAPZFP的制備
精密稱定“2.1.1”項中經鈷 - 60滅菌過的全蝎
凍干粉、白術粗粉、白頭翁粗粉各10.00 g,加入“2.1.3”項中球孢白僵菌孢子懸液,攪拌均勻至適宜濕度,于溫度25 ℃、濕度不低于95% 、光照自然的條件下,約發酵7 d至菌絲長滿后適時取出,冷凍干燥即得,并低溫密封保存。
2.2 ?SAPZFP、SAPZP不同截留分子量段的凍干粉制備
2.2.1 ?超濾原液的制備
根據最佳提取工藝進行超聲水提(待發表資料),取“2.1”項中制備的SAPZFP約20 g,精密稱定,置2 000 mL錐形瓶中,精密加入蒸餾水800 mL,調節pH值為11,于40 ℃下恒溫超聲提取(輸入功率500 W,頻率80 kHz)60 min后,在4 ℃、4 000 r·min-1條件下離心15 min,取上清液先用中速濾紙初步抽濾,以除去水不溶性雜質,再用5 μm水系微孔濾膜預處理,并重復提取一次,兩次濾液合并,并加水定容至4 000 mL,即得SAPZFP的超濾原液。SAPZP同法處理作為對照。
2.2.2 ?超濾系統的預處理
將使用1%甲醛溶液密封保存于冰箱冷藏室的卷式超濾組件放至室溫后,于蒸餾水中浸泡30 min,組裝超濾系統,于室溫、0.1 MPa條件下純水運輸30 min,以洗凈超濾組件的保護劑。
2.2.3 ?超濾原液的膜分離過程
依次用已預處理的公稱分子量截留值為10和5 kDa的超濾系統,于室溫、0.1 MPa條件下對“2.2.1”項中SAPZFP的超濾原液進行超濾,在平衡循環4 倍原液體積后[8],使超濾組件膜表面存在的吸附和解吸附達到平衡,進而完全超濾,得到SAPZFP的< 5、5 ~ 10、> 10 kDa的超濾藥液,于40 ℃旋蒸濃縮后,冷凍干燥備用。SAPZP同法制備。
2.3 ?水溶性活性成分的含量測定
2.3.1 ?水溶性氨基酸的含量測定
采用茚三酮顯色法[9]進行水溶性氨基酸的含量測定。以吸光度A1為縱坐標,甘氨酸質量濃度C1(mg·mL-1)為橫坐標,得甘氨酸標準曲線的回歸方程為A1?= 34.756C1?- 0.006 9(R2?= 0.998 1),質量濃度在0 ~ 0.02 mg·mL-1范圍內線性關系良好。分別取“2.2”項中不同截留分子量段的凍干粉約50 mg,精密稱定,置100 mL容量瓶,用蒸餾水溶解定容,搖勻后精密量取5 mL置于10 mL容量瓶中,用蒸餾水稀釋至刻度、搖勻,得不同截留分子量段的供試品溶液,按照標準曲線繪制方法進行水溶性氨基酸的含量測定,各截留分子量段的供試品溶液平行測定3次,重復2組。
2.3.2 ?水溶性總蛋白的含量測定
采用Lowry法[10]測定水溶性總蛋白的含量,以
吸光度A2為縱坐標,以牛血清蛋白質量濃度C2
(mg·mL-1)為橫坐標,得牛血清蛋白標準曲線的
回歸方程為A2?= 1.839 5 C2?+ 0.004 3(R2?= 0.998 1),
質量濃度在0 ~ 0.4 mg·mL-1范圍內線性關系良好。分別取“2.2”項中不同截留分子量段的凍干粉約50 mg,精密稱定,置100 mL容量瓶,用蒸餾水溶解定容,得不同截留分子量段的供試品溶液,按照標準曲線繪制方法進行水溶性總蛋白的含量測定,各截留分子量段的供試品溶液平行測定3次,重復2組。
2.3.3 ?水溶性總多糖的含量測定
采用苯酚—硫酸法[11]測定水溶性總多糖的含量,以吸光度A3為縱坐標,以葡萄糖質量濃度C3(mg·mL-1)為橫坐標,得葡萄糖標準曲線得回歸方程為:
A3= 9.816 7C3?+ 0.019 4 (R2?= 0.998 2)
質量濃度在0 ~ 0.1 mg·mL-1范圍內線性關系良好。分別取“2.2”項中不同截留分子量段的凍干粉約50 mg,精密稱定,置100 mL容量瓶,用蒸餾水溶解定容,搖勻后精密量取3 mL置于25 mL容量瓶中,用蒸餾水稀釋至刻度、搖勻,得不同截留分子量段的供試品溶液,按照標準曲線繪制方法進行水溶性總多糖的含量測定,各截留分子量段的供試品溶液平行測定3次,重復2組。
2.4 ?SAPZFP、SAPZP不同截留分子量段的凍干粉的體外抗腫瘤研究
2.4.1 ?不同截留分子量段的凍干粉溶液的配制
取SAPZFP與SAPZP不同截留分子量段的凍干粉各約10 mg,精密稱定,溶于RPMI Medium Modified培養基,配成2 mg·mL-1的初始藥物濃度,無菌環境下用0.22 μm針式過濾器濾過后,用RPMI Medium Modified培養基依次2倍稀釋至所需藥物濃度,用于體外抗腫瘤研究。
2.4.2 ?凍干粉溶液對乳腺癌細胞株MCF - 7抑制率的測定
采用MTT法進行體外抗腫瘤研究,按照文獻[12]方法接種細胞,配制陰性對照組、陽性對照組、各劑量加藥組(每個劑量5個復孔),當凍干粉溶液與細胞作用24 h后,進行呈色、比色,根據OD值計算抑制率。
抑制率(%)=
[1 -(OD加藥組-OD調零組)/(OD陰性對照組?- OD調零組)]×100%
2.5 ?統計學分析
全文數據均以![]() 表示,SAPZFP與SAPZP兩樣本的顯著性檢驗,在雙側F檢驗的基礎上,進行雙側t檢驗。全文分析中,以P<0.05表示兩樣本有顯著性差異,P<0.01表示有極顯著性差異。同時,借助SPSS 17.0中logit模型計算體外抗腫瘤研究的IC50。
表示,SAPZFP與SAPZP兩樣本的顯著性檢驗,在雙側F檢驗的基礎上,進行雙側t檢驗。全文分析中,以P<0.05表示兩樣本有顯著性差異,P<0.01表示有極顯著性差異。同時,借助SPSS 17.0中logit模型計算體外抗腫瘤研究的IC50。
3 ?實驗結果
3.1 ?SAPZFP、SAPZP不同截留分子量段的凍干粉的水溶性活性成分比較
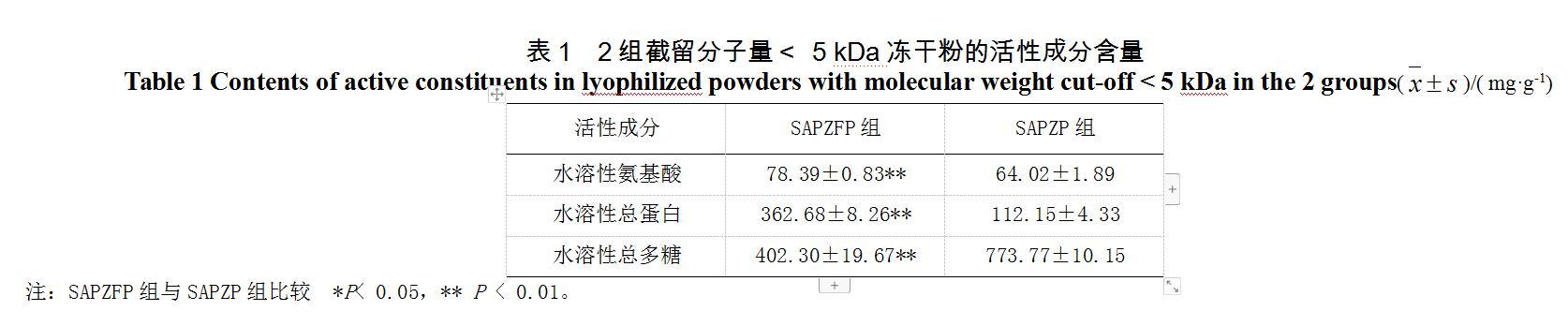
3.1.1 ?截留分子量<5 kDa凍干粉的水溶性活性成分比較
SAPZFP與SAPZP截留分子量<5 kDa凍干粉的水溶性活性成分比較見表1。SAPZFP與SAPZP的各活性成分含量均有極顯著性差異,其中SAPZFP組水溶性氨基酸、水溶性總蛋白含量較SAPZP組升高,水溶性總多糖含量較SAPZP組降低。
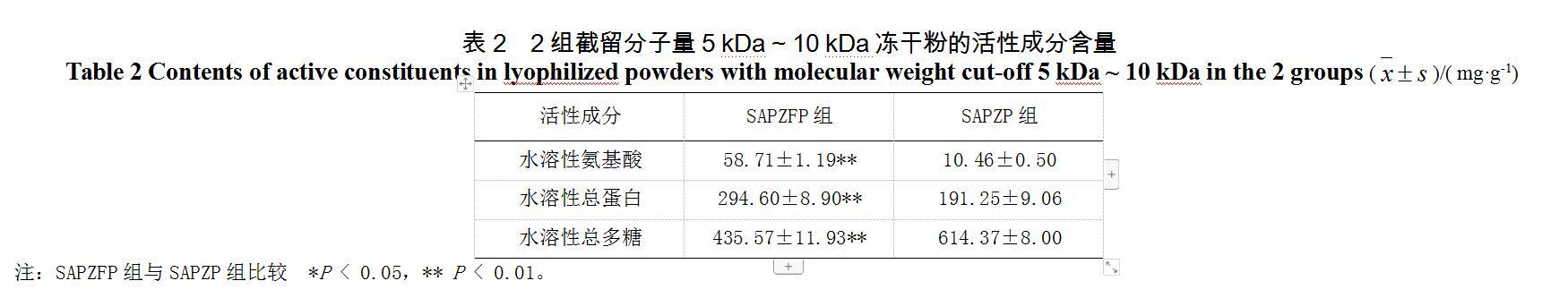
3.1.2 ?截留分子量5 ?~ 10 kDa凍干粉的水溶性活性成分比較
SAPZFP與SAPZP截留分子量5 kDa ~ 10 kDa凍干粉的水溶性活性成分比較見表2。SAPZFP組與SAPZP組的各活性成分含量均有極顯著性差異,其中SAPZFP組水溶性氨基酸、水溶性總蛋白含量較SAPZP組升高,水溶性總多糖含量較SAPZP組降低,兩組截留分子量5 ~ 10 kDa凍干粉的活性成分含量變化規律與截留分子量< 5 kDa凍干粉的活性成分含量變化規律相同。
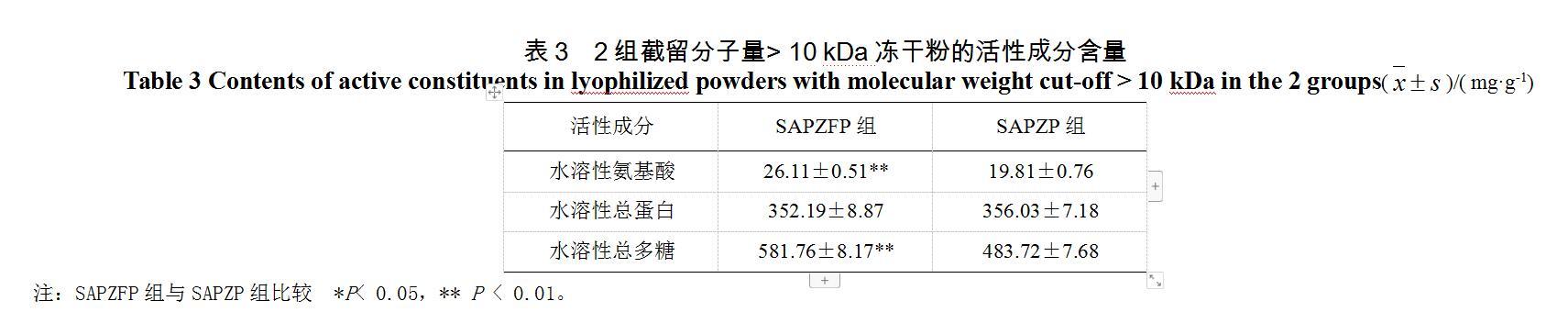
3.1.3 ?截留分子量> 10 kDa凍干粉的水溶性活性成分比較
SAPZFP與SAPZP截留分子量> 10 kDa凍干粉的水溶性活性成分比較見表3。SAPZFP組與SAPZP組比較,水溶性氨基酸、水溶性總多糖含量升高,且具有顯著性差異,而SAPZFP組與SAPZP組的水溶性總蛋白含量無顯著性差異。
3.2 ?SAPZFP、SAPZP不同截留分子量段的凍干粉的體外抗腫瘤研究
3.2.1 ?截留分子量<5 kDa凍干粉對乳腺癌細胞株MCF - 7的抑制作用
SAPZFP與SAPZP截留分子量<5 kDa凍干粉對乳腺癌細胞株MCF-7的抑制作用見表4。在各試驗藥物濃度下,SAPZFP組與SAPZP組對乳腺癌細胞株MCF-7的抑制作用有顯著性差異,SAPZFP組對乳腺癌細胞株MCF - 7的IC50為0.854 mg·mL-1,SAPZP組對乳腺癌細胞株MCF-7的IC50為1.128 mg·mL-1。
3.2.2 ?截留分子量5 ~ 10 kDa凍干粉對乳腺癌細胞株MCF - 7的抑制作用
SAPZFP與SAPZP截留分子量5 ~ 10 kDa凍干粉對乳腺癌細胞株MCF-7的抑制作用見表5。在試驗藥物濃度(0.062 5~1 mg·mL-1)范圍內,SAPZFP組與SAPZP組均對乳腺癌細胞株MCF - 7有抑制作用,且呈現量效關系。SAPZFP組對乳腺癌細胞株MCF - 7的IC50為0.315 mg·mL-1,SAPZP組對乳腺癌細胞株MCF - 7的IC50為0.360 mg·mL-1,兩者具有極顯著性的差異。
3.2.3 ?截留分子量> 10 kDa凍干粉對乳腺癌細胞株MCF - 7的抑制作用
SAPZFP與SAPZP截留分子量> 10 kDa凍干粉對乳腺癌細胞株MCF-7的抑制作用見表6。SAPZFP組對乳腺癌細胞株MCF-7的IC50為0.071 mg·mL-1,SAPZP組對乳腺癌細胞株MCF-7的IC50為0.115 mg·mL-1。在試驗藥物濃度(0.031 25 ~ 0.5 mg·mL-1)范圍內,SAPZFP組與SAPZP組對乳腺癌細胞株MCF-7的抑制作用均呈現量效關系,且SAPZFP組對乳腺癌細胞株MCF-7的抑制率與SAPZP組比較,差異在各藥物濃度下均具有統計學意義(P < 0.01)。
4 ?結論
超濾膜分離技術已在多領域廣泛應用,其原理是依靠膜兩側壓力差為驅動力,借助濾膜的微小孔徑對混合體系實現目的性分離純化和濃縮[8]。在膜分離過程中,不發生相變、無溶劑污染,能夠較好保持分子的生物活性,但是,由于溶質分子形態、溶質與膜材料親和性及架橋作用的影響,不同分子量的溶質只能被大體分開。相關研究表明,全蝎蛋白藥效組分由20 ~ 80個氨基酸組成,分子量分布于3 kDa左右或6 ~ 9 kDa或大于10 kDa[3];周家容等[4]研究表明,白術多糖的分子量多分布于10 kDa以下,且< 6 kDa和10 kDa ~ 30 kDa分子量的多糖具有較好生物活性;陳振華等[5]綜述中兩種白頭翁糖蛋白的相對分子質量均大于10 kDa。故本研究選用公稱分子量截留值為10 kDa和5 kDa的超濾系統進行兩步超濾研究,基本上可將主要活性成分通過超濾加以區分研究。
在各種藥物的篩選中,IC50常作為標志藥效的重要定量指標。文中SAPZFP與SAPZP不同截留分子量段的凍干粉均對乳腺癌細胞株MCF - 7具有抑制作用,其中截留分子量> 10 kDa凍干粉的抗腫瘤活性最強。通過比較,SAPZFP組的各分子量段的IC50均低于SAPZP組,說明球孢白僵菌雙向固體發酵技術可能在提高其抗腫瘤活性方面起到了一定的作用。究其原因首先是發酵過程使球孢白僵菌形成多種極具活性的次生代謝產物和數十種胞外酶,胞外酶使藥性基質的細胞破壁,可增進活性成分溶出,同時可對藥性基質進行結構修飾和生物轉化,從而獲得活性物質。其次,球孢白僵菌產生的蛋白酶可將藥性基質中的蛋白類大分子物質轉化為更多小分子物質,從而產生活性更強的小分子肽類物質[13,14]。真菌在生長的過程中可利用培養基中的營養物質不斷合成自身的菌絲體,這可能是提取物中多糖增加的主要來源。通過對水溶性活性成分分析可知,發酵使截留分子量< 10 kDa的凍干粉水溶性氨基酸、水溶性總蛋白含量升高,水溶性總多糖含量降低;使截留分子量> 10 kDa的凍干粉水溶性氨基酸、水溶性總多糖含量升高,而水溶性總蛋白含量無顯著性差異。據此推測發酵過程使大分子蛋白質部分肽鍵斷裂,產生更多具有游離氨基的多肽類成分;且發酵過程使非糖物質轉化為糖類物質,或小分子寡糖不斷聚合形成更大分子量的多糖。
參考文獻:
[1]孫娟,喬歌,張圣元,等.全蝎藥材不同商品中總多糖含量測定[J].遼寧中醫雜志,2014,41(03):534-536.
[2]梁琨,安叡,尤麗莎,等.柱前衍生化RP-HPLC法測定中藥全蝎中16種氨基酸含量[J].中國新藥雜志,2014,23(06):716-720.
[3]吳福林,董慶海,王涵,等.中藥全蝎研究進展[J].遼寧中醫藥大學學報,2018,20(12):108-111.
[4]周家容,田允波,侯軒.超濾膜分離白術多糖及其抗氧化活性的研究[J].西南大學學報(自然科學版),2009,31(04):79-82.
[5]陳振華,管詠梅,楊世林,等.白頭翁研究進展[J].中成藥,2014,36(11):2380-2383.
[6]孫靜,王集會.全蝎三種產地加工方法的對比研究[J].中國現代中藥,2016,18(07):903-906.
[7]張莉,張蘭,張玉,等.釀酒酵母菌株的篩選與發酵特性分析[J].河南農業科學,2018,47(06):144-148.
[8]李存玉.超微孔過濾原理的研究與應用[D].南京:南京中醫藥大學,2013.
[9]劉金虎,王哲,曹廣超,等.蠐螬粉酶解工藝最佳用酶的初步篩選及體外抗腫瘤活性的研究[J].華西藥學雜志,2018,33(04):454-456.
[10]曹廣超,劉金虎,田志龍,等.超聲法提取虻蟲水溶性蛋白質的工藝研究[J].當代化工,2018,47(05):886-889.
[11]劉春雨,劉玉慧,李曉輝,等.蜈蚣粉發酵前后水溶性活性物質含量對比研究[J].湖南中醫雜志,2016,32(11):167-169.
[12]桑曉,張瑞,王彥多,等.野生與養殖全蝎酶解后主要成分含量及抗腫瘤作用的對比研究[J].中南藥學,2018,16(02):171-174.
[13]吳泊,邵幼姿,薛莉麗,等.芽孢桿菌發酵炮制中藥紅花增強溶血栓藥效研究[J].世界中醫藥,2018,13(07):1759-1762.
[14]李津,宋強.藥用真菌發酵中藥及復方的可行性分析[J].遼寧中醫雜志,2014,41(01):48-49.
![]()

