廣西麻風(fēng)患者HLA-B*13:01基因檢測(cè)預(yù)防DDS綜合征效果分析
段啟志 許鳳妮 李 偉 張 杰 朱邦勇 王硯蕾 王 宏 李 崢 胡冠豪 周志光 黃 耿 韋江平 秦 雁
廣西皮膚病防治研究所,南寧,530003
氨苯砜(又稱二氨基二苯砜)自1908年首次合成以來,因其抗炎、抗菌和抗寄生蟲作用,逐漸被應(yīng)用于麻風(fēng)、皰疹樣皮炎、痤瘡等多種皮膚病的治療,是WHO麻風(fēng)聯(lián)合化療(MDT)的主要藥物之一[1,2]。氨苯砜綜合征(DHS)是氨苯砜引起的藥物超敏反應(yīng)綜合征,其發(fā)生和嚴(yán)重程度與劑量無關(guān)。除部分表現(xiàn)不全的患者外,DHS常同時(shí)累及皮膚、肺、消化、血液等多個(gè)器官和系統(tǒng)。研究表明,DHS在我國(guó)的發(fā)生率約為1%~1.5%,致死率約為9.6%~11.1%,嚴(yán)重威脅患者的生命安全[3,4]。廣西是我國(guó)麻風(fēng)流行的一類地區(qū),近10年來年均發(fā)現(xiàn)麻風(fēng)患者65例。2010-2013年,廣西應(yīng)用MDT治療新發(fā)麻風(fēng)患者時(shí)發(fā)生DHS 8例,死亡1例。2013年,張福仁等[5]對(duì)我國(guó)DHS患者的全基因組關(guān)聯(lián)分析研究表明,HLA-B*13:01基因?yàn)镈HS的易感基因,這意味著DHS的一級(jí)預(yù)防成為可能。廣西于2015年7月1日全面開展“麻風(fēng)病療前易感基因檢測(cè)預(yù)防DHS”項(xiàng)目,對(duì)近年新發(fā)麻風(fēng)患者進(jìn)行HLA-B*13:01基因等相關(guān)檢測(cè),現(xiàn)將結(jié)果報(bào)道如下。
1 資料與方法
1.1 資料來源 資料來源于全國(guó)麻風(fēng)防治管理信息系統(tǒng)(LEPMIS)、各縣(市、區(qū))的各類麻風(fēng)疫情監(jiān)測(cè)表和HLA-B*13:01基因檢測(cè)報(bào)告。
1.2 研究方法
1.2.1 檢測(cè)方法 納入廣西2015年7月1日至2018年12月31日全部新發(fā)麻風(fēng)患者,排除既往曾用氨苯砜治療或砜類藥物過敏的患者,在患者充分知情并簽訂知情同意書后進(jìn)行HLA-B*13:01基因檢測(cè)(標(biāo)本送至山東省皮膚性病防治研究所進(jìn)行檢驗(yàn),即首先應(yīng)用QuickGene DNA試劑盒提取外周血基因組DNA,再應(yīng)用序列特異性寡核苷酸探針進(jìn)行檢測(cè),陽(yáng)性標(biāo)本用GenDx公司的NGSgo進(jìn)行下一代測(cè)序以對(duì)患者進(jìn)行HLA基因分型)、血常規(guī)、肝腎功能等臨床觀察需要的檢測(cè)和葡萄糖-6-磷酸脫氫酶(G6PD)檢測(cè)[6]。
1.2.2 治療方案 HLA-B*13:01基因檢測(cè)陰性和非G6PD缺乏癥者予MDT方案治療,即多菌型(MB)患者應(yīng)用氨苯砜(5歲以下隔日25 mg、5~9歲每日25 mg、10~14歲每日50 mg、15歲及以上每日100 mg,自服)、利福平(單次劑量為:5歲以下150mg、5~9歲300 mg、10~14歲450 mg、15歲及以上600 mg,每月1次,監(jiān)服)、氯法齊明(單次劑量為:5歲以下50 mg、5~9歲100 mg、10~14歲200 mg、15歲及以上300 mg,每月1次,監(jiān)服;5歲以下隔日50 mg、5歲及以上每日100 mg,自服)治療,療程12個(gè)月,少菌型(PB)患者應(yīng)用氨苯砜、利福平治療(劑量同前),療程6個(gè)月。HLA-B*13:01基因檢測(cè)陽(yáng)性、G6PD缺乏癥等不適合MDT方案治療的患者使用替代療法,即視病情將氨苯砜更換為左氧氟沙星(每日400 mg)或克拉霉素(每日500 mg)治療,療程同氨苯砜;若患者要求按MDT方案治療,予以確認(rèn)并詳細(xì)記錄。隨訪8周并判斷是否發(fā)生DHS。
1.2.3 診斷標(biāo)準(zhǔn) DHS現(xiàn)有的診斷標(biāo)準(zhǔn)為改良Richardus標(biāo)準(zhǔn)[7]:①發(fā)熱;②原皮疹加重或新發(fā)皮疹;③全身乏力和/或胃腸道癥狀和/或黃疸;④淺表淋巴結(jié)腫大(腋窩、腹股溝、下頜等);⑤肝功能異常(超過基線2倍)。符合兩條或以上,排除麻風(fēng)反應(yīng)、其他疾病及藥物不良反應(yīng),停用氨苯砜后不良反應(yīng)消失。
1.2.4 回顧性分析2012年1月1日至2015年6月30日新發(fā)麻風(fēng)患者的病歷資料,計(jì)算廣西麻風(fēng)患者中DHS的基線發(fā)生率,并與2015年7月1日至2018年12月31日的數(shù)據(jù)進(jìn)行比較。
1.2.5 統(tǒng)計(jì)學(xué)方法 采用SPSS 22.0統(tǒng)計(jì)軟件進(jìn)行,描述性資料用頻數(shù)與百分比進(jìn)行描述,率的比較用χ2檢驗(yàn),P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 基本資料 2015年7月1日至2018年12月31日,廣西新發(fā)現(xiàn)麻風(fēng)患者127例,排除1例治療前外遷的患者,共納入126例患者進(jìn)行研究,見表1。其中男90例(71.4%),女36例(28.6%);平均年齡(44.4±16.2)歲;壯族55例(43.7%)、漢族49例(38.9%)、瑤族19例(15.1%)、其他民族3例(2.4%);多菌型91例(72.2%),少菌型35例(27.8%)。
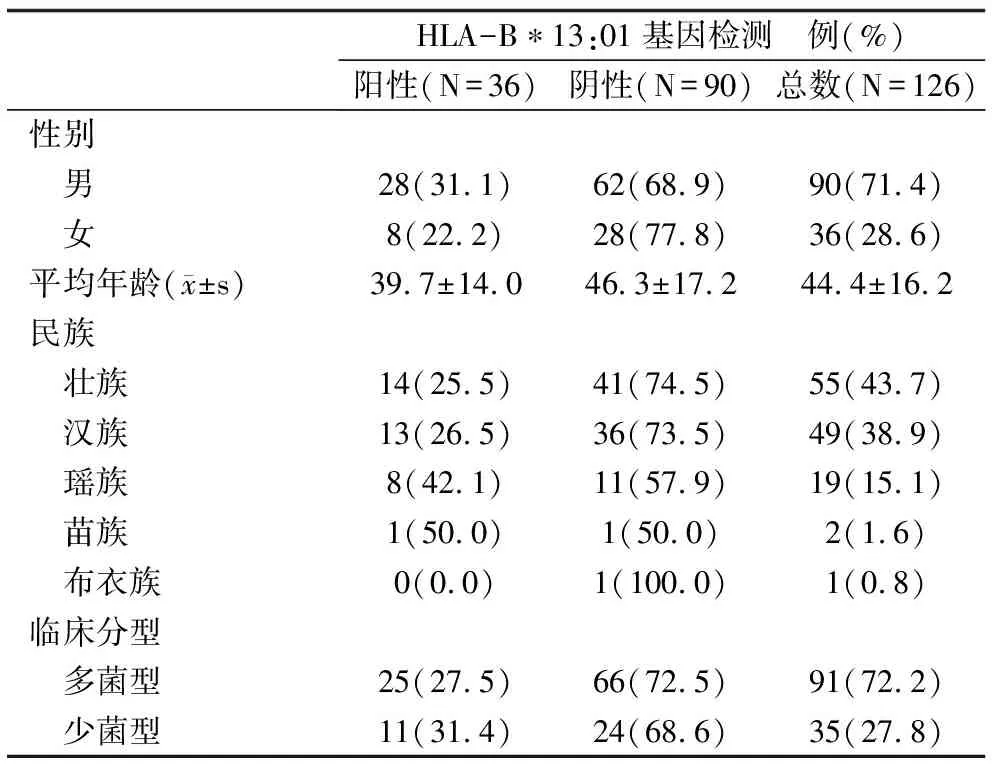
表1 納入病例的基本信息和HLA-B*13:01基因檢測(cè)結(jié)果
2.2 HLA-B*13:01基因檢測(cè)結(jié)果和治療情況 126例患者中,HLA-B*13:01基因檢測(cè)陽(yáng)性36例(28.6%),其中各個(gè)民族檢測(cè)陽(yáng)性率分別為:瑤族42.1%(8/19)、漢族26.5%(13/49)、壯族25.5%(14/55)、其他民族33.3%(1/3),見表1。36例檢測(cè)陽(yáng)性的患者中有6例起始予MDT方案治療,其中5例在隨訪期間更換為替代方案治療。
2.3 藥物不良反應(yīng)發(fā)生情況 在8周隨訪期間,有38例(30.2%)出現(xiàn)50種不良反應(yīng),其中HLA-B*13:01基因檢測(cè)陽(yáng)性的患者有11例(30.6%)出現(xiàn)16種不良反應(yīng),檢測(cè)陰性的患者有27例(30.0%)出現(xiàn)34種不良反應(yīng),見表2。兩組患者不良反應(yīng)的發(fā)生總數(shù)(χ2=0.240,P=0.625)及單個(gè)不良反應(yīng)的發(fā)生數(shù)(χ2=13.735,P=0.132)均無統(tǒng)計(jì)學(xué)差異。有7例患者出現(xiàn)不止1種不良反應(yīng)(其中2例為起始予MDT治療的HLA-B*13:01基因檢測(cè)陽(yáng)性的患者),但并沒有患者符合DHS的診斷。
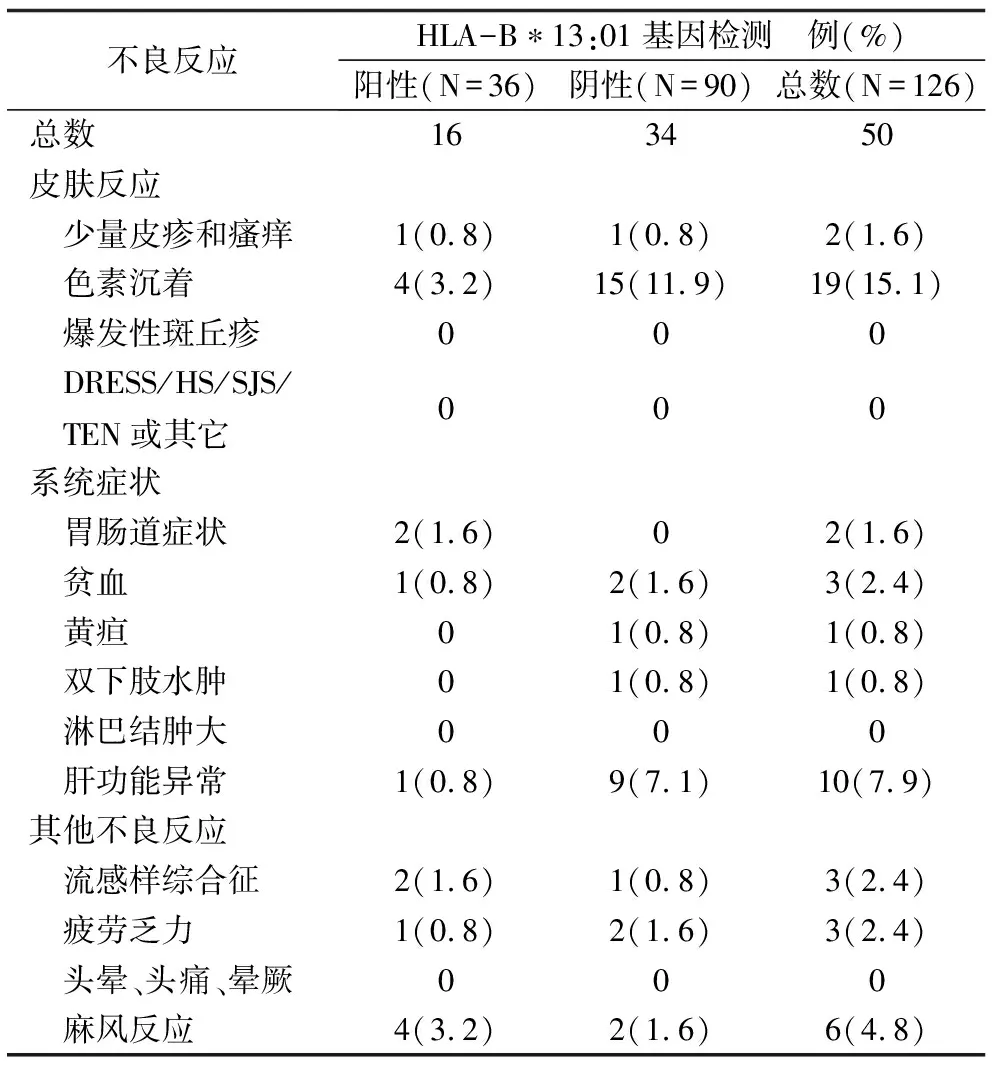
表2 納入病例8周隨訪期間藥物不良反應(yīng)發(fā)生情況
注:診斷為麻風(fēng)反應(yīng)且對(duì)癥治療有效的患者不拆分癥狀。DRESS,drug reaction with eosinophilia and systemic symptoms,伴嗜酸粒細(xì)胞增多和系統(tǒng)癥狀的藥疹;HSS, hypersensitivity syndrome,超敏反應(yīng)綜合征;SJS,Stevens-Johnson syndrome,Stevens-Johnson綜合征;TEN,toxic epidermal necrolysis,中毒性表皮壞死松解癥。
2.4 基線DHS發(fā)生率及統(tǒng)計(jì)比較 2012年1月1日至2015年6月30日,廣西新發(fā)現(xiàn)麻風(fēng)患者182例,排除隨訪時(shí)間不足8周的患者2例,共180例患者,其中8例(4.4%)發(fā)生DHS。而2015年7月1日至2018年12月31日納入的126例患者中沒有患者發(fā)生DHS。全面開展麻風(fēng)易感基因檢測(cè)預(yù)防DHS項(xiàng)目后前后DHS的發(fā)生率具有顯著統(tǒng)計(jì)學(xué)差異(校正χ2=4.137,P=0.042)。
本項(xiàng)目納入的126例患者中,HLA-B*13:01基因檢測(cè)陽(yáng)性者占28.6%,與劉紅等[6]的研究24.3%接近,顯著高于全國(guó)17.3%的平均水平(χ2=10.022,P=0.002)。檢測(cè)陽(yáng)性的患者中,漢族、壯族、瑤族的陽(yáng)性率分別為26.5%、25.5%、42.1%,瑤族患者的陽(yáng)性率最高,但幾個(gè)民族間的陽(yáng)性率差異沒有統(tǒng)計(jì)學(xué)意義(均P>0.05);不同性別(χ2=0.996,P=0.318)、型別(χ2=0.194,P=0.660)的患者檢測(cè)陽(yáng)性率也沒有統(tǒng)計(jì)學(xué)差異。在全國(guó)的研究當(dāng)中,漢族、壯族、苗族、彝族的檢測(cè)陽(yáng)性率分別為14.2%、19.9%、38.6%、12.9%[6]。廣西壯族麻風(fēng)患者HLA-B*13:01基因攜帶率與全國(guó)壯族患者水平無明顯差異(χ2=0.645,P=0.422),但漢族患者的攜帶率顯著高于全國(guó)水平(χ2=5.629,P=0.018)[6]。有研究對(duì)貴州布依族、陜西漢族、西藏藏族和新疆維吾爾族的健康志愿者進(jìn)行HLA-B*13:01基因分型,發(fā)現(xiàn)該基因攜帶率分別為11%、8%、1%、2%[8]。與之相比,廣西漢族麻風(fēng)患者的攜帶率明顯高于陜西漢族志愿者(χ2=9.327,P=0.002);而本項(xiàng)目布依族患者僅有1例,無法進(jìn)行比較。李焱等[9]對(duì)廣東漢族人進(jìn)行HLA-B基因多態(tài)性研究,發(fā)現(xiàn)HLA-B*13:01的表現(xiàn)頻率為16.5%,低于本項(xiàng)目數(shù)據(jù),但差異無明顯統(tǒng)計(jì)學(xué)意義(χ2=3.132,P=0.077)。見表1、表3。
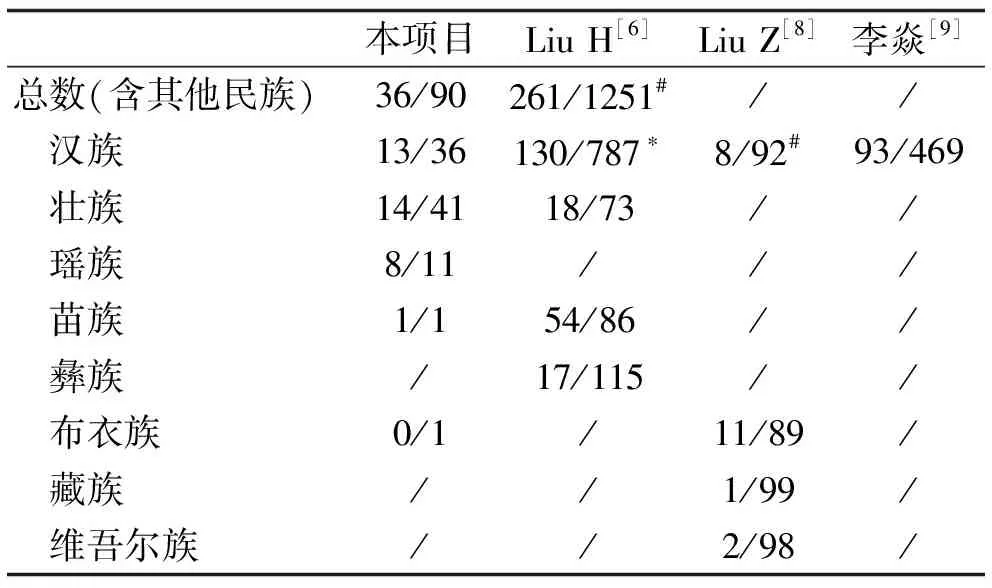
表3 本項(xiàng)目和既往文獻(xiàn)HLA-B*13:01基因檢測(cè)結(jié)果比較(陽(yáng)性/陰性)
注:*本項(xiàng)目數(shù)據(jù)與之相比P<0.05;# 本項(xiàng)目數(shù)據(jù)與之相比P<0.01
3 討論
本項(xiàng)目組對(duì)廣西近年的新發(fā)現(xiàn)麻風(fēng)患者進(jìn)行研究,發(fā)現(xiàn)HLA-B*13:01基因陽(yáng)性率顯著高于全國(guó)平均水平,表明廣西是HLA-B*13:01基因高攜帶地區(qū)。由于HLA-B*13:01基因?yàn)镈HS的易感基因,這可能意味著廣西DHS的發(fā)生風(fēng)險(xiǎn)高于全國(guó)平均水平[5]。廣西不同民族的HLA-B*13:01基因陽(yáng)性率的差異無統(tǒng)計(jì)學(xué)意義,這可能與各民族納入病例數(shù)過少有關(guān)。從民族分類上看,廣西壯族麻風(fēng)患者HLA-B*13:01基因攜帶率與全國(guó)壯族患者水平無明顯差異,但漢族麻風(fēng)患者的攜帶率顯著高于全國(guó)漢族患者水平和陜西健康志愿者水平,這可能與該基因南高北低的地域分布有關(guān)[6]。廣西漢族麻風(fēng)患者HLA-B*13:01基因攜帶率與鄰近的廣東漢族人臍帶血大樣本研究檢測(cè)出的攜帶率有差異,但無顯著統(tǒng)計(jì)學(xué)意義,這可能與樣本量差距過大有關(guān),也可能與該基因的地域分布有關(guān)。
隨訪期間,HLA-B*13:01基因檢測(cè)陽(yáng)性組和陰性組患者不良反應(yīng)的發(fā)生總數(shù)及單種不良反應(yīng)的發(fā)生數(shù)均無統(tǒng)計(jì)學(xué)差異。包含起始予MDT方案治療的6例HLA-B*13:01基因檢測(cè)陽(yáng)性的患者在內(nèi)的所有患者均未發(fā)生嚴(yán)重皮膚反應(yīng)。這些不良反應(yīng)被認(rèn)為與麻風(fēng)反應(yīng)、其他疾病以及利福平、氯法齊明以及左氧氟沙星等替代藥物有關(guān),而與氨苯砜無關(guān)。結(jié)合診斷標(biāo)準(zhǔn)及其他研究,本項(xiàng)目組考慮以上患者均未發(fā)生DHS[10]。此外,1例HLA-B*13:01基因檢測(cè)陽(yáng)性的患者予MDT方案治療完成并判愈,隨訪至今已有4年余,并未發(fā)生DHS。有學(xué)者認(rèn)為無論HLA-B*13:01基因檢測(cè)陽(yáng)性與否均可起始試予MDT方案治療。但由于目前該基因檢測(cè)陽(yáng)性又要求予MDT方案治療的病例數(shù)過少,而DHS危害性大,本課題組認(rèn)為該基因檢測(cè)陽(yáng)性的患者仍首先推薦替代方案治療。
張福仁等[5]研究表明,HLA-B*13:01基因用于檢測(cè)我國(guó)DHS風(fēng)險(xiǎn)時(shí)敏感性為85.5%,特異性為85.7%,該基因缺失可使DHS的風(fēng)險(xiǎn)由1.4%降至0.2%。泰國(guó)、韓國(guó)、日本等亞洲國(guó)家和地區(qū)的研究也表明HLA-B*13:01基因和DHS具有相關(guān)性,HLA-B*13:01基因是DHS易感基因的機(jī)制可能是氨苯砜與該基因抗原識(shí)別位點(diǎn)結(jié)合后改變了與后者結(jié)合的自身肽類,也可能是激活特異性細(xì)胞毒性T細(xì)胞引發(fā)了后續(xù)效應(yīng)[11-14]。因此,理論上,對(duì)廣西新發(fā)麻風(fēng)患者進(jìn)行療前HLA-B*13:01基因檢測(cè),檢測(cè)陽(yáng)性的患者在MDT中剔除氨苯砜,將大大降低DHS的發(fā)生率。實(shí)際隨訪中并未發(fā)現(xiàn)有患者發(fā)生DHS,結(jié)果與基線DHS發(fā)生率比較有顯著統(tǒng)計(jì)學(xué)差異,說明療前HLA-B*13:01基因檢測(cè)能顯著降低廣西DHS的發(fā)生率,結(jié)論與全國(guó)的研究相同[6]。本研究中廣西HLA-B*13:01基因檢測(cè)陽(yáng)性率為28.6%,然而既往DHS發(fā)生率為4.4%,說明DHS的發(fā)生可能有其他因素的影響。有研究表明,除HLA-B*13:01外,HLA-DRB1的氨基酸變異也可能與DHS有關(guān)[15]。理論上HLA-B*13:01基因檢測(cè)陰性的患者仍有可能發(fā)生DHS,但本項(xiàng)目并未觀察到該現(xiàn)象,這可能與納入病例數(shù)過少有關(guān)。由于近年廣西麻風(fēng)的發(fā)病率呈下降趨勢(shì),本項(xiàng)目組將繼續(xù)對(duì)廣西新發(fā)麻風(fēng)病人進(jìn)行進(jìn)一步研究和隨訪。
綜上所述,廣西是HLA-B*13:01基因高攜帶地區(qū),應(yīng)用HLA-B*13:01基因檢測(cè)預(yù)防DHS的發(fā)生是有效的。本項(xiàng)目組將繼續(xù)擴(kuò)大樣本量進(jìn)行進(jìn)一步研究。

