人牙髓干細胞、牙周膜干細胞表型及生長特性分析
龐真貞 李碩 劉欽贊 李曄 王良
牙周膜干細胞是從牙周膜組織中分離出的干細胞,是牙周組織功能首選中西細胞,具有自我更新能力,可分化為牙骨質、牙周膜以及牙槽骨[1,2]。傳統的牙周病治療主要是消除病因,難以修復已喪失的牙周組織。牙髓干細胞具有多向分化的潛能,它除了能形成礦化結節能力的細胞外,經過不同細胞因子的誘導,還能夠分化為脂肪、骨、軟骨、肌肉、血管內皮、肝、神經等細胞系類型[3,4]。牙髓組織位于牙齒內部的牙髓腔內,是牙體組織中唯一的軟組織[5]。通過對人牙髓細胞的研究,發現了一種與骨髓間充質干細胞有著極其相似的免疫表型及形成礦化結節能力的細胞,細胞中形態呈梭形,可自我更新和多向分化,有較強的克隆能力[3]。這些由牙髓組織中分離出的成纖維狀細胞稱為牙髓干細胞(dental pulp stem cells)。目前認為牙周膜干細胞與牙髓干細胞是口腔乃至全身多種組織再生極有應用前景的兩種間充質干細胞,本文分析2種干細胞的表型及生長特性。
1 材料與方法
1.1 材料 2018年7至12月選擇18~25歲因正畸拔除完整第三磨牙10顆。
1.2 納入與排除標準 (1)納入標準:牙齒健康,雙尖牙或第三磨牙,患者對治療知情同意,對本研究也知情同意。(2)排除標準:合并根尖病,齲齒,牙周病。
1.3 試劑與儀器 20%胎牛血清,DMEM,細胞篩網。
1.4 干細胞純化擴增方法[6]
1.4.1 牙周膜干細胞:拔除后置入含3倍抗體的PBS液中,在超凈臺,用PBS液從牙根到牙冠方向沖洗5次,清除血污,滅菌手術刀片刮根中下1/3牙周膜組織,置入離心管,加消化液,37℃下消化30 min,每5分鐘搖晃離心管1次。加2 ml含20%胎牛血清,1 000 r/min離心,5 min,去上清,轉入35 mm培養皿,37℃,5%CO2,培養,組織塊貼壁過夜,第2天補加1.5 ml 原代細胞培養液。待細胞匯合至80%,進行傳代。
1.4.2 牙髓干細胞:取上述刮牙周膜組織牙齒,切開牙冠,暴露牙髓,取出牙髓,浸入3倍雙抗PBS中,后續操作同上,待細胞匯合至80%,傳代。
1.4.3 細胞純化、擴增:分別收集培養的處于對數生長期的牙周膜細胞與牙髓細胞上清液,作為適應性培養基;對培養細胞消化、離心、去上清,加適應性培養基,吹打,過細胞篩,制成單個細胞超過懸液90%,調增細胞密度為每毫升10~15個,接種與96孔培養板,每孔100 μl,培養24 h、48 h,標記單個細胞孔,補至每孔200 μl,第6天,半量換液,隨后每2天換1次。7~14 d,細胞數≥50為出現細胞克隆,待克隆細胞至孔底1/2~2/3后,用0.25%胰酶消化,離心,去上清,移至48孔培養板,繼續培養,至24孔、12孔、6孔,轉入6 cm、10 cm培養皿、T25培養瓶,繼續培養,至細胞覆蓋瓶底80%,胰酶消化,離心,去上清,轉入T75瓶培養,得到第8代干細胞,制備為單細胞懸液,細胞密度超過1×107/ml,備用。
1.5 分析方法
1.5.1 細胞生長測定:將細胞懸液調為密度1×104/ml,接種至96孔板,分為12組,每組6個復孔,分別培養1~12 d,每天取1組,棄培養液,每孔加基礎培養基,5%CO2,37℃培養4 h,酶標儀492 nm處測A值,重復3次,取平均值,比較同一時間兩種細胞OD值。
1.5.2 流式細胞儀:制備細胞混懸液,密度為1×106/ml,分別裝入EP管中,標記,每組6個管,加入濃度為0.2 mg/ml的STRO-1、CD29、CD34、CD44、CD45、CD73、CD90、CD105、CD146、CD166對應的同型抗體濃度。4℃避光孵育50 min,PBS重懸,離心,棄上清,加PBS重懸,過濾,流式細胞儀測定分析。
1.5.3 細胞集落檢測:參考文獻[7]。對數生長期的細胞,常規消化傳代,制作為細胞懸液,分散細胞使單給細胞超過95%,按照每皿5 μl含50、100、200細胞的濃度,接種至培養皿中,37℃,5%CO2培養,根據pH值變化更換新鮮培養液,培養3周,棄原液,PBS液洗滌,多聚甲醛固定,PBS洗滌,加甲苯胺藍染色15 min,PBS洗滌,干燥,計數細胞克隆集落,集落為細胞數≥50個,計算集落形成率(集落數/接種細胞數)×100%。

2 結果
2.1 細胞生長增殖情況比較 牙髓干細胞培養3 d出現快速生長,第9天后進入平臺期;牙周膜干細胞在培養4 d后開始快速生長,第8天就進入平臺期。在3~12 d時,牙髓干細胞細胞增殖A值顯著高于牙周膜干細胞,差異有統計學意義(P<0.05)。見表1。
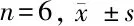
類別1 d2 d3 d4 d5 d6 d牙髓干細胞 0.23±0.080.26±0.080.50±0.100.69±0.121.02±0.231.41±0.32牙周膜干細胞0.24±0.080.25±0.070.38±0.110.42±0.120.79±0.211.08±0.30P值>0.05>0.05<0.05<0.05<0.05<0.05類別7 d8 d9 d10 d11 d12 d牙髓干細胞 1.52±0.411.61±0.441.73±0.481.75±0.511.76±0.501.77±0.51牙周膜干細胞1.29±0.321.40±0.351.43±0.321.44±0.331.45±0.311.45±0.30P值<0.05<0.05<0.05<0.05<0.05<0.05
2.2 2種細胞中STRO-1、CD29、CD44、CD73、CD90、CD146、CD105、CD34、CD45表達率比較 牙周膜干細胞和牙髓干細胞中STRO-1、CD29、CD44、CD73、CD90、CD146、CD105均呈高表達。牙周膜干細胞和牙髓干細胞中STRO-1、CD29、CD44、CD73、CD90、CD146、CD105、CD34、CD45表達率比較差異無統計學意義(P>0.05)。見表2。
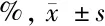

類別STRO-1CD44CD29CD90CD34CD45CD73CD146CD105牙周膜干細胞92.13±13.8190.32±15.5293.0±15.5795.94±16.632.03±0.712.31±0.6897.43±17.4395.53±15.9497.99±14.48牙髓干細胞 92.05±14.5090.41±14.9692.7±14.9396.10±17.212.25±0.732.20±0.6598.02±18.1596.12±16.2897.62±15.53
2.3 2種細胞中集落形成率比較 牙髓干細胞的集落形成率為(4.56±0.88)%顯著高于牙周膜干細胞的(2.21±0.63)%,差異有統計學意義(P<0.05)。見表3。
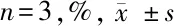

類別集落形成率牙周膜干細胞2.21±0.63牙髓干細胞 4.56±0.88?
注:與牙周膜干細胞比較,*P<0.05
3 討論
3.1 牙髓干細胞與牙周膜干細胞 干細胞(stem cells)是一類具有自我更新、自我復制能力的多潛能細胞[8]。在一定條件下,它可以分化成多種APSC多能細胞,是一類具有自我復制和多向分化潛能的原始細胞。多能干細胞(Ps)具有分化出多種細胞組織的潛能,但失去了發育成完整個體的能力,發育潛能受到一定的限制[9]。
人牙周膜干細胞是來源牙周膜的成體干細胞,有較強的更新能力,可進一步分化為不同功能特性的細胞[10,11]。人牙周膜干細胞可分化為牙槽骨、牙骨質、牙周膜,對維持牙周膜穩定、修復牙組織[12,13]。人牙周膜干細胞有高度的增殖能力以及自我更新的能力,除了可分化為牙骨質、牙槽骨、牙周膜外,研究顯示,其還可以分化為成骨細胞、軟骨細胞、膠原細胞、脂肪細胞、牙骨質細胞[14,15]。人牙周膜干細胞來源與牙周膜細胞群,原代培養成本低,操作簡單,一般分離人牙周膜干細胞有3種方法,包括組織塊法,酶解組織塊法、酶聯合消化法,本研究應用酶解組織塊法。組織塊法培養原代時間長,酶聯合消化法酶消化時間不容易確定,并且與酶解組織塊法比較,原代培養成功率,但是克隆率要高。
牙髓干細胞無論從數量上,還是分離培養方法上,要優于牙周膜干細胞,并且其在神經方面的分化潛能,使其有成為干細胞庫的潛能。牙髓屬于結締組織,有一定的修復再生能力,牙髓干細胞體外培養發現其具有高度增生能力與自我更新能力。牙髓干細胞具有與骨髓基質干細胞相似的免疫表型,并且前者具有更高的增生率。牙髓干細胞具有形成礦化結節能力,形態為梭形,除了自我更新,還具有多向分化的功能,可分化為成牙本質細胞、骨細胞、神經細胞、脂肪細胞等。牙髓干細胞用于牙周組織在上、牙髓組織再生、頜面部骨組織缺損修復等具有較好的安全性。并且動物模型研究顯示,牙髓干細胞還可用于軟骨、神經、角膜等再生[15]。目前對牙髓干細胞的研究還處于早期階段,對其應用也較為局限,但其在再生醫學工程、組織工程方面具有較好的應用潛能[16]。
3.2 牙髓干細胞與牙周膜干細胞的生長特性 在臨床應用中,因牙周膜干細胞數量少,培養相對困難,并且來源有限,極大限制其轉化的進程,而與之相比,牙髓干細胞無論從數量上,還是分離培養方法上,都明顯優于牙周膜干細胞,因此具有成為該細胞庫的潛能[17,18]。牙髓屬于結締組織,有一定的修復再生能力,因成牙本質細胞屬于終末細胞,一旦分化,就不再分裂,因此,一般認為牙本質細胞受損后,牙髓內未分化前提細胞能分化為成牙本質細胞[19-22]。目前認為牙髓干細胞可能來自血管周圍微環境[23-25]。本研究結果也顯示,牙髓干細胞培養3 d出現快速生長,在第9天后進入平臺期;牙周膜干細胞在培養4 d后開始快速生長,在第8天就進入平臺期。2組在3~12 d時,牙髓干細胞細胞增殖A值顯著高于牙周膜干細胞。提示牙髓干細胞的增殖速度要快于牙周膜細胞,并且增殖時間更長。通常認為消化酶法獲得的牙髓干細胞具有更高的細胞增值率,成骨分化能力,成牙本質分化能力,但組織塊法獲得的牙髓干細胞具有形態更均勻的優勢。氧濃度對維持干細胞可塑性、以及增殖能力發揮重要作用。環境氧濃度可損傷間充質干細胞的DNA,導致遺傳不穩定型,而低氧濃度有利于維持干細胞的微環境,增加其安全性。一般認為在5%的氧濃度時,牙髓干細胞具有較強的增殖潛能。
3.3 牙髓干細胞與牙周膜干細胞表型 CD34、CD45是造血干細胞表面標志物,本研究顯示,在牙髓干細胞與牙周膜干細胞中,兩者均呈低表達。CD29屬于黏附因子表型,在干細胞高表達。STRO-1是一種IgM單克隆抗體,主要存在于骨髓,是骨髓間充質干細胞的特異性表面標志。本研究中,人牙周膜干細胞與人牙髓干細胞均呈高表達。CD44、CD73、CD90、CD105、CD146、CD166是干細胞具有典型性的標志物,其中CD44是間充質細胞未分化細胞標志。CD73表達于間充質干細胞,可促進干細胞增殖,抑制干細胞衰老,CD90可促進干細胞快速增殖。表達與滑膜間充質干細胞的CD105可促使其分化為成軟骨的能力。本研究中,人牙周膜干細胞與人牙髓干細胞均呈高表達,提示兩種細胞均具有干細胞特征。牙髓干細胞表達多種干細胞標志物,也證實其多相分化的可能性。延髓干細胞在體外培養,可礦化為礦化結節,其還可以分化為脂肪細胞。有研究顯示,牙髓干細胞在mRNA水平與蛋白水平表達神經前提細胞標志以及膠原細胞標志,其還能產生多種神經營養因子,提示其具有分化為神經細胞的潛能[23]。
綜上所述,牙髓干細胞增殖速度較牙周膜細胞增殖更快,在牙髓組織修復、牙齒組織工程中具有廣闊的應用前景。

