鱘魚軟骨酶解條件優化及酶解物的體外抗腫瘤活性
武瑞赟 杜怡麗 黃雨霞 李鵬飛 鄭海濤 李平蘭
(中國農業大學 食品科學與營養工程學院,北京 100083)
癌癥也稱作惡性腫瘤,近年來發病率呈現逐年上升的趨勢[1-2]。在癌癥治療的漫長過程中,藥物的毒副作用明顯,已成為急需解決的問題。因此,研究與開發高效低毒的生物活性物質成為研究的熱點。
目前研究較多的生物活性物質為多糖類[3]、黃酮類[4]以及生物堿類[5]。長期以來,人們認為蛋白質只有變成氨基酸才能夠被人體吸收,且僅僅能夠為人體提供氮源和氨基酸[6]。然而已有研究證明,2~6個氨基酸組成的寡肽可被機體吸收和利用[7];新的研究還發現,當體內缺少一些調節生理功能的肽時,會導致機體機能的改變[8],適當補充某些生物活性肽如抗菌肽[9]、膠原多肽[10]等對于調節機體免疫力,促進人體健康具有重要的作用。因此,新型生物活性肽類資源的挖掘受到廣泛關注,已成為近年來研究的又一個熱點。骨膠原多肽是膠原或者明膠經過蛋白酶降解處理得到的產物,具有較強的水溶性,易被機體吸收[11-12],且具有抗氧化、抗腫瘤活性及抑制DPP-4酶等多種[13]功能。鱘魚(Sturgeon)是現存起源最早的硬鱗軟骨脊椎動物之一[14],除頭蓋骨外,其余全為軟骨,約占魚體的10%左右[15]。軟骨中富含蛋白質等多種營養成分,其中膠原蛋白占比很大。目前鱘魚骨作為加工副產物未進行精深開發,主要用于飼料的生產,利用率低,附加值少。因此,研究與開發功能性的鱘魚骨膠原肽具有潛在的市場應用前景。
本研究擬采用堿性蛋白酶和中性蛋白酶聯合使用的方法,對鱘魚骨制備骨膠原多肽的酶解條件進行研究;利用細胞模型,考察骨膠原多肽對癌細胞增殖的抑制能力,并探究其對癌細胞中參與凋亡的關鍵酶活性的影響以及作用方式,以期為鱘魚骨膠原多肽功能研究及產品開發應用提供理論依據。
1 材料與方法
1.1 試驗材料
人結直腸癌細胞Caco-2、人乳腺癌細胞MCF-7、人肝癌細胞HeGp2、人肺癌細胞A549、人宮頸癌細胞HeLa,中國醫學科學院基礎醫學研究所贈予;人工養殖西伯利亞鱘和史氏鱘雜交鱘魚,北京市農科院水產技術研究所十渡鱘魚繁育基地提供。
DMEM培養基、磷酸鹽緩沖液(Phosphate buffered saline,PBS),美國Corning公司;胰蛋白酶-乙二胺四乙酸消化液(0.25%),北京索萊寶科技有限公司;細胞增殖Cell Counting Kit-8(CCK-8)試劑盒、細胞膜電位檢測試劑盒、caspase-1、caspase-3活力檢測試劑盒,上海碧云天生物技術有限公司;堿性蛋白酶(2.30×105IU/g),中性蛋白酶(7.68×104IU/g),購自諾維信(中國)生物技術有限公司;木瓜蛋白酶(1.00×105IU/g),胰蛋白酶(2.50×105IU/g),購自寶如億(北京)生物技術有限公司;胃蛋白酶(8.00×105IU/g),購自寶如億(北京)生物技術有限公司。L-亮氨酸,北京酷來搏科技有限公司;三氯乙酸,牛血清蛋白,碳酸鈉,酒石酸鉀鈉,硫酸銅,Folin-酚乙液,上海百賽生物技術股份有限公司;四硼酸鈉,西隴科學股份有限公司;5-氟脲嘧啶(5-fluorouracil,5-FU),武漢制藥集團股份有限公司。
1.2 儀器與設備
電子分析天平FA1004,上海天平儀器廠;紫外可見分光光度計UV-1800,上海美譜達儀器有限公司;pH計EF28,上海梅特勒-托利多儀器有限公司;恒溫磁力攪拌器IT-07A-3,上海一恒科學儀器有限公司;微量臺式離心機Sorvall Legend Micro 17,賽默飛世爾科技公司;Imark酶標儀,美國Bio-Rad公司。
1.3 方法
1.3.1鱘魚軟骨粉制備
鱘魚軟骨經煮沸剔除殘留肉渣后,浸泡于95%乙醇中脫脂后晾干,經24 h冷凍干燥后磨粉制得所需的鱘魚軟骨粉。
1.3.2鱘魚骨酶解物肽得率測定
將三氯乙酸(TCA)沉淀法與 Folin-酚法結合測定肽得率。
取原溶液及酶解液各5 mL,加入5 mL 30%的TCA,靜置20 min 后4 000 r/min離心15 min,取 1 mL 稀釋一定倍數的上清液,加入5 mL Folin-酚甲液后混勻。在25 ℃條件下保溫10 min,之后加入0.5 mL Folin-酚乙液并且立刻振蕩均勻,在 25 ℃ 條件下保溫30 min,保溫結束后測定500 nm的吸光值,代入標準曲線中,計算出樣品中多肽的含量。肽得率即酶解得到的多肽與原樣品中總的肽含量的比值,計算公式為:

1.3.3蛋白酶種類篩選
選取5種酶解魚骨常用酶,以肽得率為考察指標,在各酶理論最適酶解條件(表1)下處理鱘魚軟骨粉,選出適宜的酶種類。

表1 各酶理論最適酶解條件Table 1 Optimal conditions for enzymatic hydrolysis by theory
以骨粉與水質量比為1∶25將骨粉溶于去離子水中,分別取相同體積的骨溶液,按表1條件各添加1×105IU/g的相應蛋白酶,酶解3 h后置于沸水中滅酶10 min,經4 000 r/min,10 min離心收集上清液,測定鱘魚軟骨粉酶解液中肽含量。
1.3.4單因素試驗
在堿性蛋白酶與中性蛋白酶酶活力比為1∶1的條件下,以酶解時間(1、3、5、7、9 h)、酶解溫度(35、40、45、50、55 ℃)、骨粉與水質量比(1∶5、1∶15、1∶25、1∶35、1∶45)、加酶量(0.5×105、1×105、1.5×105、2×105、2.5×105IU/g)為變量,研究不同酶解條件對鱘魚骨肽得率的影響,然后固定以上最優條件,考察堿性蛋白酶與中性蛋白酶在不同的酶活力比下對肽得率的影響。酶解時先加入堿性蛋白酶,調節溶液pH至8.0(堿性蛋白酶最適pH),經過一半時間后加入中性蛋白酶,調節溶液pH至7.0(中性蛋白酶最適pH)。
1.3.5酶解條件正交試驗優化
在蛋白酶初篩試驗的基礎上,選擇肽得率最高的兩種酶對鱘魚軟骨粉進行酶解,選擇加酶量、骨粉與水質量比、酶解時間、酶解溫度和堿性蛋白酶與中性蛋白酶酶活力比5個因素,以肽得率為考察指標,設計5因素5水平L25(55)正交試驗(表2)。用IBM SPSS Statistics.V22設計正交試驗并進行方差分析。

表2 正交試驗因素與水平表Table 2 Orthogonal test factors and level table
1.3.6細胞復蘇培養及細胞增殖檢測
細胞從液氮罐中取出,迅速置于37 ℃水浴中,不斷搖動細胞凍存管快速解凍。將解凍后的細胞快速轉移至15 mL的離心管中,加入DMEM培養液重懸細胞后,轉移至無菌的細胞培養瓶中,于37 ℃、5% CO2條件下培養,待細胞長至80 %以上,進行傳代,傳至3 代以上后用于試驗。
細胞經胰蛋白酶消化后,輕輕吹打使其分散成單個細胞,進行細胞計數,將細胞懸液加入96 孔細胞培養板中,細胞數為5×103個/孔;置于37 ℃、5% CO2培養箱中貼壁過夜培養;棄去原細胞培養液,處理組每孔加入100 μL不同質量濃度的鱘魚骨膠原多肽(50、100、200、400、800、1 000 μg/mL),另設不添加任何受試物只加有細胞的對照組和不加細胞的空白組,同時設置50 μg/mL 5-氟脲嘧啶(5-fluorouracil,5-FU)為陽性對照組。每個質量濃度設6 個平行,繼續培養24 h。藥物處理結束,每孔添加10 μL的CCK-8試劑,于37 ℃避光反應4 h;用酶標儀于450 nm波長處測定吸光度,細胞抑制率(U)的計算公式如下:
式中:M處理、M對照、M空白分別為處理組、對照組和空白組于450 nm波長處測定的吸光度,nm。
1.3.7caspase-1、 caspase-3活力測定
細胞以5×105個/mL種于6 孔培養板中,在DMEM完全培養基中培養,待細胞貼壁12 h后,加入不同質量濃度的骨膠原多肽樣品,另設不加任何刺激物的對照組。培養24 h后,胰蛋白酶消化細胞,經PBS洗滌1次后,裂解細胞測定caspase-1、caspase-3活力。在冰浴條件下,加入細胞裂解液,冰浴裂解15 min后,4 ℃、12 000 r/min離心20 min,收集上清液。向收集好的上清液中加入底物,37 ℃孵育2 h,用酶標儀在405 nm測定吸光度。最終的caspase酶活力單位定義為每微克蛋白樣品在37 ℃、2 h內作用于底物所產生的物質的量。
1.3.8線粒體膜電位(JC-1)檢測
細胞以5×105個/mL種于6 孔培養板中,在DMEM完全培養基中培養,待細胞貼壁12 h后,加入不同質量濃度的骨膠原多肽樣品,另設不加任何刺激物的對照組。培養24 h后,胰蛋白酶消化細胞,經PBS洗滌1次后,加入1 mL JC-1染色工作液,充分混勻。置于細胞培養箱中37 ℃孵育20 min。吸除上清液,用JC-1染色緩沖液(1倍)洗滌2次。加入2 mL細胞培養液后在475~520 nm處使用熒光分光光度計檢測。
1.4 數據分析
測量數據由統計軟件SPSS 16.0進行單因素方差分析檢測不同數據間是否存顯著差異。試驗數據以平均值±標準差表示。
2 結果分析
2.1 標準曲線的繪制
精密稱取牛血清蛋白(BSA)配制成濃度為 250 μg/mL 的BSA標準溶液,向各管試管中依次加入 Folin-酚甲液并混勻。將試管置于25 ℃保溫10 min,加入 Folin-酚乙液后立即振蕩混勻,在 25 ℃ 下保溫30 min,在500 nm下測定吸光度。繪制標準曲線見圖1,線性方程為y=0.001 5x+0.017,相關性R2=0.998 8,表明線性關系良好。

圖1 牛血清蛋白標準曲線
Fig.1 Standard curve of BSA
2.2 酶解鱘魚軟骨粉蛋白酶的篩選
蛋白酶解的主要目的是生成具有更多功能特性的肽類,但在蛋白酶解同時,會生成少量氨基酸。因而如何計算水解過程中多肽得率是廣泛關注的問題。三氯乙酸(TCA)作為一種蛋白質沉淀劑可以沉淀蛋白質以及較長的肽段。蛋白質的多肽鏈在酶解反應中會隨著反應的進行逐漸被切成大小不等的片段,在TCA中的溶解指數就會增大。TCA溶解指數就特定的底物而言可以定性地反映蛋白質的分裂情況,溶解指數越高,表明較短肽段的含量越高。試驗將三氯乙酸(TCA)沉淀法與Folin-酚法結合測定肽得率,以多肽得率為指標,探究適合鱘魚軟骨酶解的酶解條件。
首先分別測定了堿性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶和胃蛋白酶在其理論條件下酶解鱘魚軟骨粉蛋白的肽得率,結果見圖2。堿性蛋白酶在其理論酶解條件下酶解效果最好,酶解后肽得率可達(51.74±1.63)%,其次是中性蛋白酶(36.05±0.26)%,因此選擇堿性蛋白酶和中性蛋白酶作為下一步研究用酶。

J,堿性蛋白酶;Z,中性蛋白酶;Y,胰蛋白酶;M,木瓜蛋白酶;W,胃蛋白酶。柱形上方不同字母表示在0.05水平上有顯著性差異,下圖同。
J,alkaline protease; Z,neutral protease; Y,trypsin; M,papain; W,pepsin. The letter above the column indicates that there is significant difference at 0.05 level. The same bellow.
圖2 蛋白酶酶解肽得率
Fig.2 Determination of the yield of peptidyl hydrolyzed by protease
2.3 單因素試驗
采用控制變量的方法,探究不同因素對肽得率的影響,以期為正交試驗的設計提供依據。試驗結果見圖3。
2.4 正交試驗優化
2.4.1正交試驗設計
根據單因素試驗結果,選取加酶量(A)、料液比(B)、酶解時間(C)、酶解溫度(D)和堿性蛋白酶與中性蛋白酶酶活力比(E)5個因素,每個因素5個水平,以酶解后骨膠原多肽得率為考察指標,進行L25(55)正交試驗確定制備鱘魚骨膠原多肽各因素的最佳條件。

圖3 酶解條件對鱘魚骨膠原多肽得率的影響
Fig.3 Effect of hydrolysis on the yield of sturgeon bone collagen polypeptide
表3 正交試驗方案及結果
Table 3 Orthogonal test scheme and results

試驗號Test number因素水平 FactorABCDE肽得率/%Peptide yield12251232.70±0.6025521562.60±0.8033452166.01±0.6645243172.24±0.4751555351.27±1.0865354482.98±0.3372145460.07±0.4383235557.12±1.1093124236.75±0.61101111142.15±0.69114153568.03±1.29124214355.56±1.42132534164.07±1.01141444553.95±0.31155132373.53±0.96163341365.58±1.12174431464.53±1.45181333234.31±0.13193513446.98±0.32201222437.12±0.24212423351.07± 0.09224325160.76±1.14232312550.01±1.18245415232.19±1.61254542239.02±0.66K1218.8280.53206.89247.56295.23K2247.92232.04248.30265.69174.97K3272.44283.64293.56283.63297.01K4297.9267.75290.86293.31301.68K5333.54273.94320.99271.41301.71R16.815.8922.305.9124.14
注:A、B、C、D、E為試驗因素,具體含義見表2,下表同。
Note:A,B,C,DandEare the test factors and the specific meaning is shown in
Table 2. The same in the following table.
正交試驗方案及極差分析結果見表3,方差分析結果見表4。
由表3極差分析中R值比較可知,影響肽得率的因素順序為E>C>A>D>B,即堿性蛋白酶與中性蛋白酶酶活比>酶解時間>加酶量>酶解溫度>骨粉與水質量比。由表4極差分析中K值可初步得到各因素最優水平分別為A5B3C5D4E5,由方差分析結果可知,A、C、E這3個因素對肽得率具有極顯著影響(P<0.01),B、D兩因素對其影響不顯著(P>0.05)。

表4 正交試驗結果方差分析Table 4 Analysis of variance of orthogonal test results
2.4.2骨膠原肽最佳酶解條件的驗證
結合酶解條件正交試驗的極差及方差分析結果,考慮到復合酶酶解中多種酶會在蛋白中產生多種作用位點,相比單酶反應,能夠得到更多多肽,最優酶解工藝為A5B3C5D4E5,即加酶量1.5×105IU/g、骨粉與水質量比1∶25、酶解時間5 h、酶解溫度55 ℃、堿性蛋白酶與中性蛋白酶酶活比為1∶2時酶解。該條件下測得肽含量為(72.36±2.33)%。
2.5 鱘魚骨膠原多肽對癌細胞增殖活性的影響
對于毒性小、高活性的天然抗腫瘤藥物的發現與評價一直是研究熱點。在這些研究中,研究者們評價抗腫瘤活性所使用的細胞種類很多,包括結腸癌細胞(HT-29,DLD-1),乳腺癌細胞(MCF-7),膠質瘤細胞(U87),前列腺癌細胞(PC-3,DU-145,H-1299),胃癌細胞(AGS)與宮頸癌細胞(HeLa)等[19-20]。Gouic等[21]從金槍魚蛋白酶解物中分離得到肽,發現它們對人乳腺癌細胞 MCF-7的增殖具有明顯的抑制作用。賈盈露等[22]利用酶解法,從沙蠶中分離純化出多肽PAP,并發現PAP可以抑制人肺癌細胞A549的增殖。
本研究利用CCK-8試劑盒測定并計算不同質量濃度(ρ)的骨膠原多肽以及5-FU分別作用于5株癌細胞24 h后的細胞存活率,結果見圖4。不同質量濃度的骨膠原多肽對5種癌細胞都存在一定的抑制作用,尤其對人乳腺癌細胞MCF-7、人結直腸癌細胞Caco-2以及人肺癌細胞A549,骨膠原多肽都在一定程度上降低了細胞的存活率,且抑制率呈現劑量依賴效應,最大抑制率陽性對照5-FU的抑制率,說明鱘魚骨膠原多肽具有抑制細胞增殖的潛力。
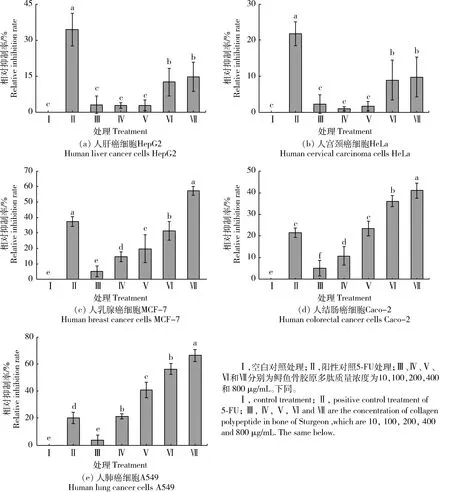
圖4 鱘魚骨膠原多肽對癌細胞增殖的影響
Fig.4 Effect of sturgeon bone collagen polypeptide on proliferation of cancer cells
2.6 鱘魚骨膠原多肽對癌細胞凋亡的影響
抑制細胞增殖的途徑很多,其中凋亡是最常見,也是最主要的途徑,細胞凋亡分為早期凋亡、中期凋亡以及晚期凋亡,不同時期,蛋白酶表達不同。Slattery等[23]發現LL-37是通過激活caspase非依賴性的凋亡通路抑制人結腸癌細胞的生長;化療藥物紫杉醇、阿霉素等都可通過激活caspase途徑誘導凋亡[24]。選擇抑制效果較好的1株癌細胞——人肺癌細胞A549,通過檢測處理前后,其各時期具有代表性的酶活力大小,進而闡明作用機理。
2.6.1鱘魚骨膠原多肽對癌細胞中caspase-1酶活力的影響
Caspase(Cysteine-requiring Aspartate Protease)是1個在細胞凋亡過程中起重要作用的蛋白酶家族[25]。caspase 1是caspase家族中唯一可以剪切IL-1b前體蛋白或IL-18前體產生相應成熟的細胞因子的酶,并可以產生20和10 ku的蛋白片段,這2個片段可以形成異源二聚體,并進一步由2個異源二聚體形成四聚體,從而調節細胞凋亡。試驗結果顯示,隨著鱘魚骨膠原多肽濃度的增加,細胞中caspase-1酶活力增加,當肽質量濃度為400 μg/mL時,酶活力可達216 IU/μg,且具有劑量效應關系(圖5),表明骨膠原多肽處理細胞后,可以引起細胞早期凋亡。

圖5 鱘魚骨膠原多肽對癌細胞中caspase-1酶活力的影響
Fig.5 Effect of sturgeon bone collagen polypeptide on caspase-1 enzyme activity in cancer cells
2.6.2鱘魚骨膠原多肽對癌細胞中線粒體膜電位(JC-1)的影響
本試驗采用熒光檢測酶標儀對骨膠原多肽處理人肺癌細胞A549后的細胞線粒體膜電位電勢進行了測定。試驗結果表明(圖6),隨著處理濃度的增加,膜電位電勢Δψm呈現下降趨勢,當濃度為 400 μg/mL 時,Δψm僅為239.875,低于陽性對照433.875。線粒體膜電位的下降是細胞凋亡早期的一個標志性事件。凋亡機制的深入研究表明,幾乎在所有誘導劑引起的各種類型的細胞凋亡中,如腫瘤壞死因子誘導的單核細胞凋亡等,均出現Δψm下降,并且由于膜電位電勢的改變可以引起膜通透性的改變,進而促使細胞凋亡的發生,因此,Δψm下降為凋亡早期階段[26]。

圖6鱘魚骨膠原多肽對癌細胞中線粒體膜電位(JC-1)的影響
Fig.6 Effect of sturgeon bone collagen polypeptide on mitochondrial membrane potential (JC-1) in cancer cells
2.6.3鱘魚骨膠原多肽對癌細胞中caspase-3酶活力的影響
caspase-3(Cysteine-requiring Aspartate Protease 3)也稱凋亡執行酶,最終可以直接誘導細胞發生凋亡,屬于細胞晚期凋亡酶[27-28]。Black等[29]在SD大鼠的IRI的心肌細胞中發現,與對照組相比,在凋亡心肌細胞中caspase-3酶活增加顯著,但僅為80.33%;Du等[30]在研究大豆異黃酮對2型糖尿病小鼠睪丸細胞凋亡的抑制作用中發現,在高血糖環境下小鼠睪丸細胞凋亡增多,同時細胞中的caspase-3酶活力增強。本研究對鱘魚骨膠原多肽處理細胞后,細胞中的caspase-3酶活進行了測定,結果顯示隨多肽濃度的增加而增加,最大酶活可達149.90 IU/μg,顯著高于空白對照組(40.08 IU/μg)和陽性對照組5-FU(66.56 IU/μg),說明鱘魚骨膠原多肽可以促進凋亡酶活性的增加,誘導細胞晚期凋亡的發生(圖7)。
3 討 論

圖7 鱘魚骨膠原多肽對癌細胞中caspase-3酶活力的影響
Fig.7 Effect of sturgeon bone collagen polypeptide on caspase-3 enzyme activity in cancer cells
癌癥是由于細胞中DNA突變,不能正常的調控細胞增殖和凋亡,細胞異常分裂形成癌細胞。抑制癌細胞增殖是抗癌的主要途徑之一。關于食源性抗腫瘤蛋白酶解物和多肽的研究很多,如從鳳尾松分離的多肽Cr-ACP1[31]、分離自小牛脾臟的脾多肽[32]等都被證明具有很好的抗腫瘤效果,但其中來源是水產品的較少,Liang 等[33]考察海洋膠原肽對自然衰老過程中自發腫瘤的影響,發現攝入海洋膠原肽后雌雄SD大鼠自發腫瘤率有一定程度的下降,表明海洋膠原肽長期喂養對SD大鼠自發腫瘤的發生及發展具有一定的抑制作用,并在一定程度上可以延長生存時間;Tao等[34]發現白僵菌素作為一種環肽,可降低線粒體膜電位,促進細胞色素C釋放,激活 caspase系統,從而殺傷腫瘤細胞,進一步的構效分析發現,抗腫瘤肽限定為包含12~100個氨基酸殘基且富含堿性氨基酸(賴氨酸,精氨酸,組氨酸)的短肽。本研究利用堿性蛋白酶和中性蛋白酶復合酶解,通過正交優化試驗獲得了較高得率的鱘魚骨膠原多肽,肽含量為(72.36±2.33)%。生物活性檢測結果顯示,鱘魚骨膠原多肽可以激活細胞中的凋亡蛋白酶caspase-1,形成細胞早期凋亡現象,進而誘導PT孔打開,線粒體跨膜電位下降,激活凋亡執行酶caspase-3,酶活性增加,促進細胞凋亡。初步驗證了鱘魚骨膠原多肽可以誘導人肺癌細胞A549凋亡,為鱘魚等水產品的精深加工及增值利用提供了新的思路與途徑。

