凡納濱對蝦養殖池塘硝化細菌的分離鑒定及脫氮效果研究
張達娟,張樹林,戴 偉,孔 欣,王澤斌,畢相東
( 1.天津農學院 水產學院,天津 300384; 2.天津市水產生態及養殖重點實驗室,天津 300384 )
隨著我國水產養殖集約化、高密度養殖模式的日益擴張,打破了池塘原有的生態平衡,長期養殖方式不當造成水體老化,因殘餌、生物排泄物以及動植物尸體的分解,消耗氧氣的同時產生大量有害物質,使養殖池塘生態環境遭到了嚴重的破壞[1-2]。養殖水體中氮的污染以氨氮和亞硝態氮的污染最為嚴重,易造成水質惡化,養殖生態遭到嚴重破壞,進而危害養殖動物,導致病害頻發、水產品質量下降。有研究表明,養殖水體中高含量氨氮及亞硝態氮是魚、蝦發病的直接或間接因素[3-4]。廣大水產養殖工作者一直致力于養殖水質的生物修復及改善養殖環境,開發出了水生植物修復、浮床植物修復以及微生物修復等技術[5],其中微生物修復技術因具有無污染、無殘留、綠色安全可靠的特點而被廣泛使用[6-9]。
養殖水體中氮循環需要經過氨化作用、亞硝化作用、硝化作用和反硝化作用來完成[5,10],這一系列反應中,微生物起著至關重要的驅動作用。研究表明,光合細菌、芽孢桿菌(Bacillus)、硝化細菌、乳酸桿菌(Lactobacillus)等在養殖水體氨氮和亞硝態氮去除中應用十分廣泛,而且也是最為經濟生態環保的方法。在養殖池塘中投放一定量的光合細菌、硝化細菌等有益菌,能顯著去除水體中氨氮、亞硝態氮和有機物,增加水中溶解氧,穩定水體pH,弧菌(Vibrio)和氣單胞菌(Aeromonas)等致病菌所占比例明顯降低[11-13]。此外,由于益生菌的大量繁殖,在池內形成優勢種群,提高了水體的微生物多樣性,抑制了病原微生物的繁殖,減少疾病的發生[14]。根據水產養殖可持續發展的觀點,建立潔凈養殖模式,合理利用復合微生物制劑有效地控制養殖動物病害的發生是保持水產養殖業健康、穩定發展的重要方式。
自第一株好氧反硝化細菌被分離后,國內外已有諸多相關研究,旨在有效去除水體的氨氮和亞硝酸態氮,改善水產養殖條件。本研究通過對凡納濱對蝦(Litopenaeusvannamei)養殖池塘水體和底泥中細菌進行分離、純化、鑒定,并對自然水體的凈化作用的模擬試驗,旨在篩選有益菌,為其應用于水產養殖、調節水質提供理論依據。
1 材料與方法
1.1 樣品來源
在天津寧河區凡納濱對蝦養殖池塘采集泥樣和水樣,帶回實驗室后立即進行分離培養。
1.2 菌種分離及純化
按配方[7]配制異養硝化培養基。細菌分離方法[15]:取水樣和泥樣懸濁液各1 mL,進行梯度稀釋,得到10-1~10-5的稀釋液,吸取10-3、10-4、10-5不同稀釋倍數的水樣和泥樣菌懸液各0.1 mL涂布在固體培養基上,30 ℃,恒溫培養2~3 d。再將培養得到的不同形態特點的細菌分別進行劃線分離,直至得到單一的菌落為止。
1.3 細菌形態學鑒定
將分離得到的菌株進行革蘭氏染色,并在顯微鏡下觀察、記錄菌落形態特點[16-17]。
1.4 16S rDNA序列測定及同源性比較
將分離菌株送往上海生工生物測序公司,測定菌株的16S rDNA序列,將結果與美國國立生物技術信息中心數據庫中的模式菌株16S rDNA基因序列做同源性比較。
1.5 分離細菌對模擬養殖水體的凈化效果測定
取養殖用水,抽濾后,分裝到15個錐形瓶中,每瓶250 mL,向各水樣瓶中分別接入5株分離得到的菌株(每株菌設3個平行),每個水樣瓶中菌株的最終密度為2×107cfu/mL。接種后,將水樣置于30 ℃、120 r/min培養箱中培養48 h,每8 h取50 mL水樣測定水體硝態氮、亞硝態氮及氨氮的質量濃度,測定方法參照《水和廢水監測分析方法》[18]進行。
1.6 數據分析
細菌對模擬養殖水體的凈化效果試驗數據以平均值±標準差表示,在統計軟件SPSS 19.0中利用單因素方差分析對數據進行分析比較,P<0.05具有顯著差異,P<0.01具有極顯著差異。
2 結果與分析
2.1 分離細菌形態及染色
分離出形態不同的細菌5株,編號分別為A1、A2、A3、A5、A6,除A6為革蘭氏陽性菌外,其他菌株均為革蘭氏陰性菌。主要形態學特點見表1。
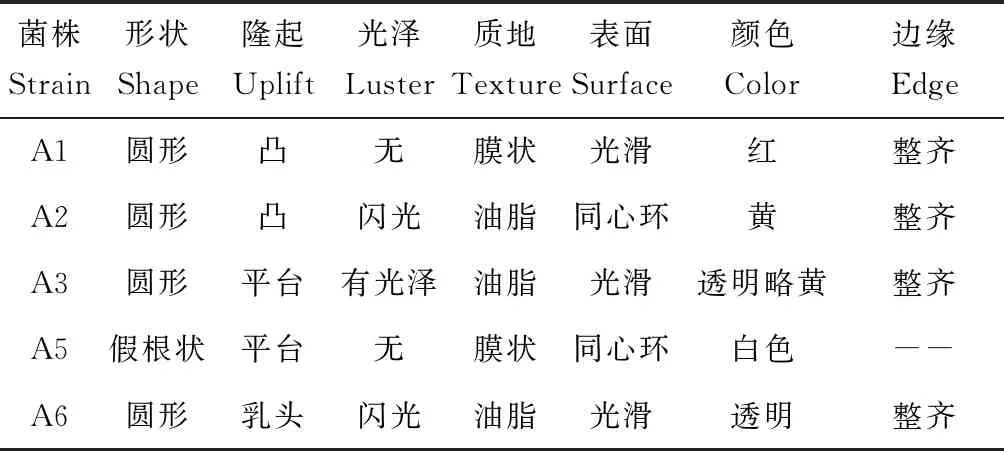
表1 菌株的菌落形態特征Tab.1 The morphological characteristics of strain colonies
2.2 細菌分子生物學的初步鑒定
各株細菌的16S rDNA序列測定發現,菌株A1、A2、A3、A5、A6分別與門多薩假單胞菌(Pseudomonasmendocina)、嗜氨甲基桿菌(Methylobacteriumaminovorans)、放射根瘤菌(Rhizobiumradiobacter)、施氏假單胞菌(Pseudomonasstutzeri)和氧化微桿菌(Microbacteriumoxydans)的同源性最高,根據其生物學分析初步鑒定結果見表2。
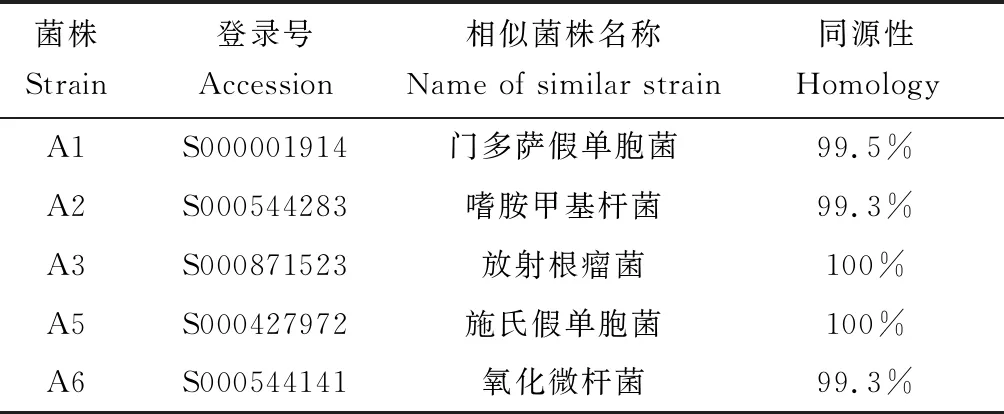
表2 菌株的16S rDNA同源性比較Tab.2 Homological comparison of 16S rDNA sequence in different strains
2.3 不同菌株對養殖水體的凈化能力
分離鑒定出的5株菌對養殖水體的氨氮均有一定的去除作用(圖1、圖2)。培養開始時,水體的氨氮含量約為0.08 mg/L,在8 h時,施氏假單胞菌處理組中氨氮質量濃度為0.038 mg/L,降低了0.042 mg/L,顯著低于其他處理組(P<0.05)。隨著培養時間的延長,施氏假單胞菌對氨氮的去除率始終維持在較高水平;接入菌株40 h后,除放射根瘤菌和氧化微桿菌處理組外,其他組中氨氮含量均顯著降低(P<0.05),門多薩假單胞菌、嗜胺甲基桿菌及施氏假單胞菌對氨氮的去除率均高于80.0%,顯著高于放射根瘤菌和氧化微桿菌(P<0.05)。
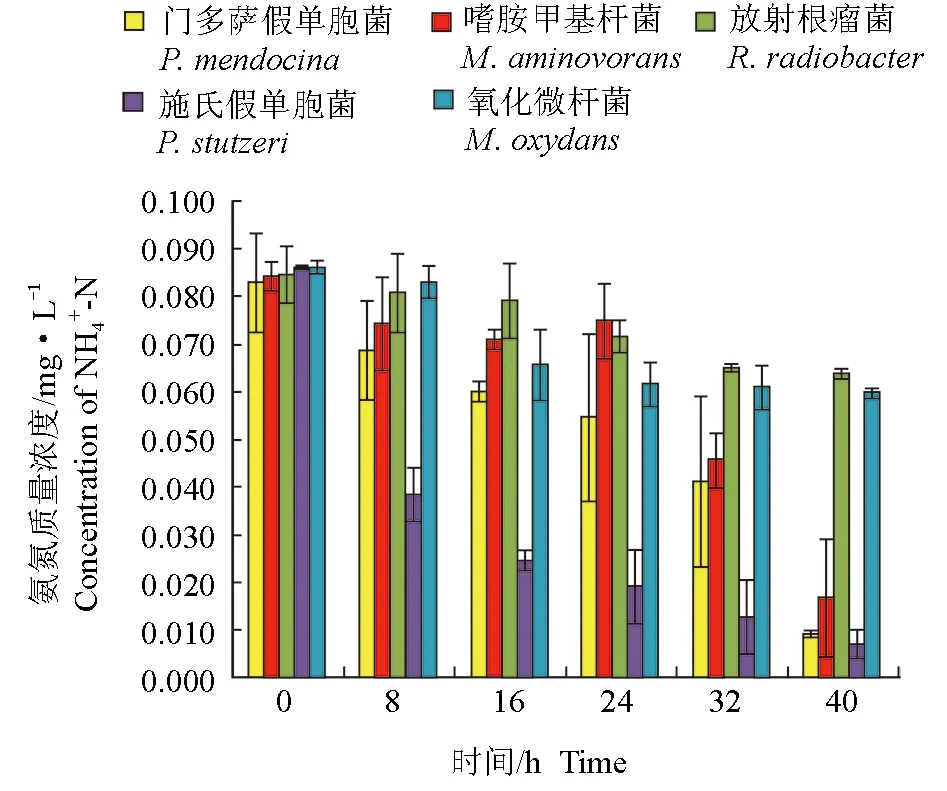
圖1 接入菌株后不同時間養殖水體中氨氮含量變化Fig.1 The content of NH4+-N in cultured water after inoculation of bacterial strains in different time
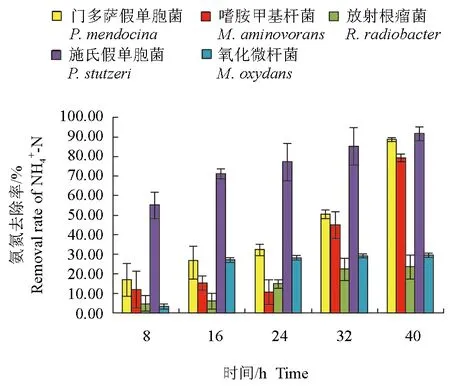
圖2 不同時間各菌株對養殖水體中氨氮的去除率Fig.2 The NH4+-N removal rates of each strain in culture water in different time
分離純化的5株細菌對亞硝態氮均有一定的去除作用(圖3、圖4)。培養開始時,養殖水體的亞硝態氮含量約為0.15 mg/L,培養8 h后,接種嗜胺甲基桿菌的自然水體中亞硝態氮含量最低,為0.051 mg/L,嗜胺甲基桿菌對亞硝態氮的去除率達84.90%,顯著高于其他菌株(P<0.05)。試驗結束時,接種的門多薩假單胞菌、嗜胺甲基桿菌和施氏假單胞菌養殖水體中亞硝態氮含量均顯著低于其他菌種,分別為0.007、0.022 mg/L和0.004 mg/L,3株細菌對亞硝態氮的去除率分別達95.08%、95.02%和97.39%,顯著高于其他菌株(P<0.05)。
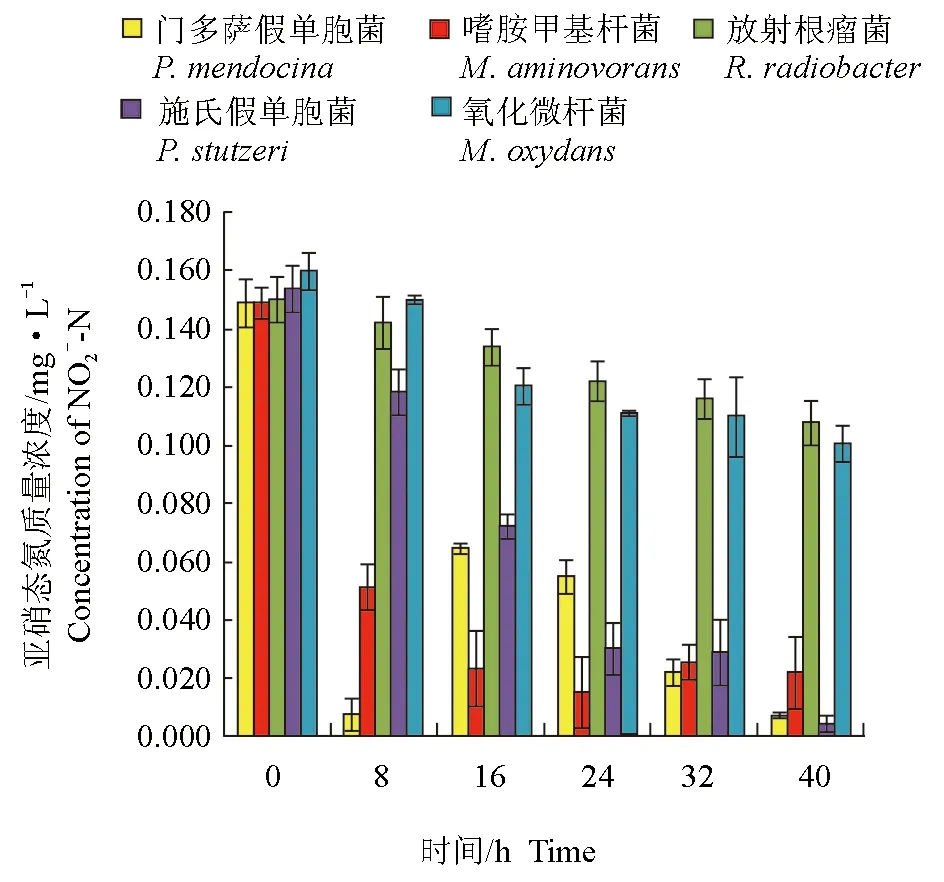
圖3 接入菌株后不同時間養殖水體亞硝態氮含量變化Fig.3 The content of NO2--N after inoculated strains in culture water in different times
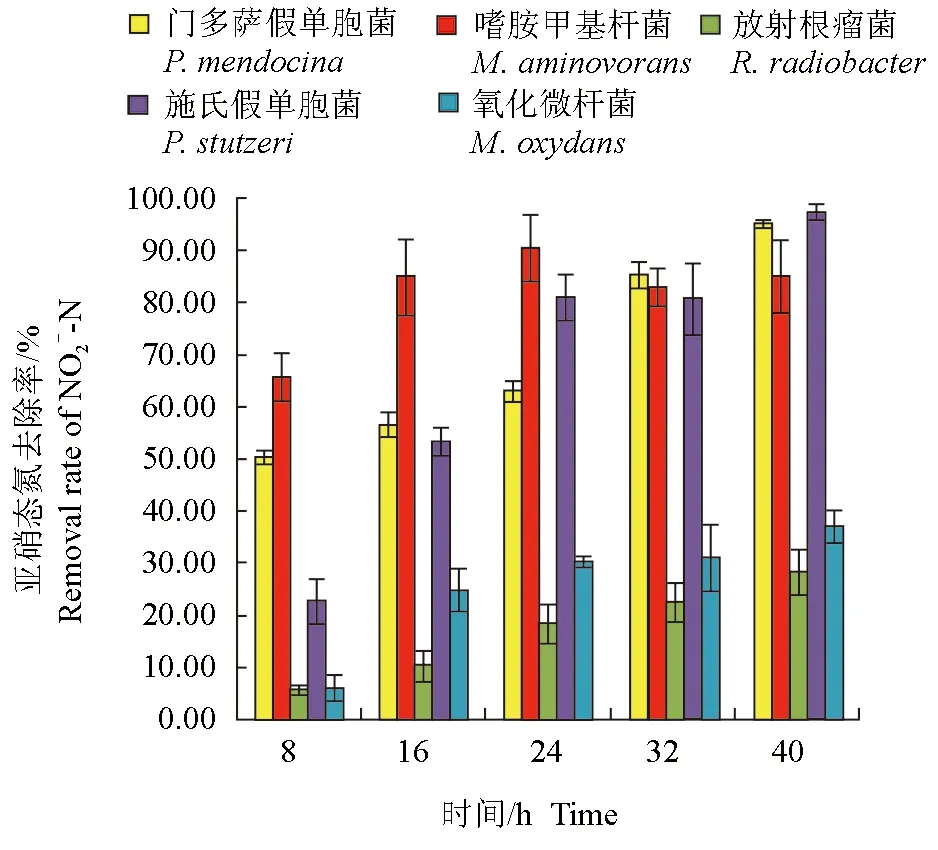
圖4 不同時間各菌株對養殖水體中亞硝態氮的去除率Fig.4 The NO2--N removal rates of each strain in culture water in different times
養殖水體的硝態氮含量為0.30 mg/L,培養8 h后,接種門多薩假單胞菌的養殖水體中硝態氮含量最低,為0.1506 mg/L,門多薩假單胞菌對硝態氮的去除率達51.03%,顯著高于其他菌株(P<0.05)。培養16 h后,接種放射根瘤菌的自然水體中硝態氮含量最高,為0.2790 mg/L,對硝態氮的去除率僅為8.88%,顯著低于其他菌株(P<0.05)。試驗結束時,接種門多薩假單胞菌和施氏假單胞菌的自然水體中硝態氮含量顯著低于其他菌種(P<0.05),分別為0.0283 mg/L和0.0274 mg/L,兩株細菌對氨氮的去除率分別為90.49%和91.22%,顯著高于其他菌株(P<0.05)(圖5、圖6)。
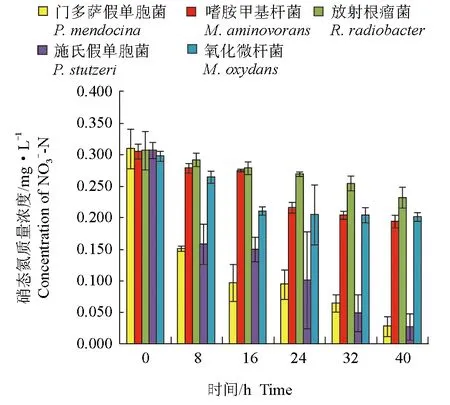
圖5 接入菌株后不同時間養殖水體硝態氮含量變化Fig.5 The content of NO3--N after inoculated strains in culture water in different times
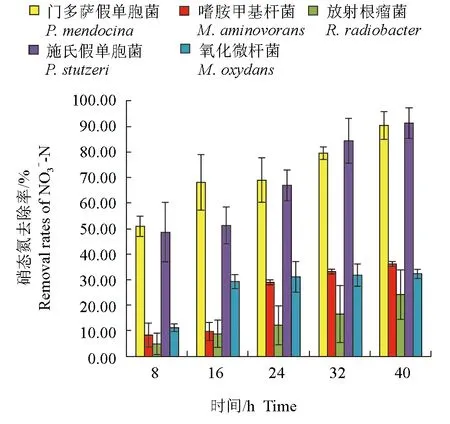
圖6 不同時間各菌種對水樣中硝態氮的去除率Fig.6 The NO3--N removal rates of each strain in culture water in different time
3 討 論
3.1 假單胞菌對水質的凈化作用
生物脫氮指微生物在適宜條件下,將水體中的有機氮和無機氮轉化為氣態氮,從而排出水體的過程[5],以此為基礎衍生的生物脫氮技術因其無污染、綠色安全、脫氮徹底等優點而被認為是最經濟有效、可行的水體除氮方法[19]。迄今已有利用地衣芽孢桿菌(B.licheniformis)[20]、硝化細菌[21]、反硝化細菌[22]、不動桿菌(Acinetobacter)[23]、假單胞菌(Pseudomonas)[8,24]等細菌進行生物脫氮的報道,但在其產物和脫氮能力上存在差異。
本試驗的門多薩假單胞菌和施氏假單胞菌均為重要脫氮細菌,也是重要的反硝化細菌[25]。傳統的生物脫氮理論認為,反硝化在有氧的條件下不能進行,氧氣的存在阻止了亞硝態氮和硝態氮接受電子,后有研究發現亞硝態氮、硝態氮和氧氣均可作為電子受體進行反硝化作用[26],而施氏假單胞菌就能在極高的氧氣條件下進行反硝化作用[27]。池塘水體和底泥是反硝化細菌存在和生長的重要場所,其種類和數量直接影響著池塘的氮循環。林娜等[28]在池塘水體和底泥中分別篩選出6株和8株好氧反硝化細菌,且以假單胞菌為主,其中一株菌Ochrobactrumsp.在2 d內的脫氮率超過80%。楊俊忠等[29]利用富集分離的方法,在魚池中分離到假單胞菌HSN-62等22株反硝化細菌,且假單胞菌在12 h內對硝酸鹽的去除率高達96%。本試驗中,門多薩假單胞菌和施氏假單胞菌在16 h內對硝酸鹽的去除率分別為68.15%和51.20%,顯著高于其他菌株(P<0.05),而16 h對于亞硝態氮的去除率分別為53.36%和56.29%,亦顯著高于其他菌株(P<0.05),但低于楊俊忠等[29]的試驗結果,這可能是菌株之間的差異性所致。施氏假單胞菌可顯著降低亞硝態氮和硝態氮含量,是因為它能將二者作為唯一氮源進行脫氮,尤其是亞硝態氮的存在可以顯著促進施氏假單胞菌的nirS和nosZ基因表達,而這兩個基因是控制假單胞菌亞硝態氮還原酶以及一氧化二氮還原酶的重要基因[26]。
3.2 分離的其他菌株在水質凈化中的作用
氧化微桿菌為嗜堿性微生物,可在pH 5~12內生長[30],常用于降解污染物[31]和生物脫硫[32]等。王亞南等[33]在海水養蝦場底泥中分離出微桿菌屬細菌,本試驗也分離出一株氧化微桿菌,表明這類細菌能夠在養蝦池底泥中分布。對蝦投放的餌料成分中含有有機硫化合物和硫酸鹽,殘餌及生物排泄物等沉積在池塘底部,造成硫化物的積累,氧化微桿菌可以利用硫化物代謝產生H2S,但對氮素利用率卻較低,這類細菌雖然在養殖池塘菌群中所占比例較少,但具有較強的適應性和穩定性。此外,本試驗分離出1株放射根瘤菌,屬于根瘤菌屬種類,是生活在土壤中的革蘭氏陰性菌,具有生物固氮作用[34],對鹽漬[35]、重金屬[36]、多氯聯苯和多環芳烴[37]等污染土壤有修復作用,但對氮素的清除作用較小。嗜胺甲基桿菌通常分離于污泥、河水中,它可以實現工業化處理甲醇或重污染廢水,使廢水達到排放指標[38]。馬立周等[39]在甲醇污染的土壤中分離純化到該細菌,并對其培養條件進行初步優化。本研究首次在養殖池塘中分離出該菌株。
在水產養殖中,以復合有益菌為代表的微生態制劑是從天然環境中篩選分離出的菌種,經過培養后制成的活菌菌劑。本試驗中分離的假單胞菌、氧化微桿菌是常用的微生態制劑種類。從微生態平衡看,有益微生物和病原菌之間存在對營養、能量和空間的爭奪,可在一定程度上抑制病原菌;有益菌可通過自身分泌的代謝物質調整微生態平衡;同時還具有改善水質、提高機體免疫力的作用。相對其他抗病途徑而言,微生態制劑因具有綠色、環保、安全等特點,仍是抗生素最有潛力的替代品,但由于一些菌體穩定性差、活性難維持、對突發病作用甚微、使用技術較難掌握等弱點,微生態制劑組成菌株和組合方式仍需進一步研究。
通過對凡納濱對蝦養殖池塘水質和底泥中細菌進行分離純化后得到5株菌,分別為門多薩假單胞菌、嗜胺甲基桿菌、放射根瘤菌、施氏假單胞菌和氧化微桿菌。門多薩假單胞菌和施氏假單胞菌對氨氮的去除率分別為88.83%和91.73%;對亞硝態氮的去除率分別為95.08%和97.39%;對硝態氮的去除率分別為90.49%和91.22%,表現出較好的去除效果,在凈化養殖水體水質中有顯著效果,可作為潛在的益生菌株進一步考察應用。

