基于轉錄組測序的不同光學分光膜下生菜葉片的基因表達差異分析
周念念 高潔 丁明珠 安玉蘭 翟克清 史加銀 甘德芳 劉文
摘? 要:新型光伏農業(yè)是在滿足農作物生長的光照需求下進行光伏發(fā)電。為研究不同光學分光膜下生菜葉片的差異基因表達情況,以‘阿迪娜生菜為試驗材料,利用轉錄組測序(RNA-seq)技術分析在覆蓋紅藍濾光膜(RBFF)和遠紅光截止膜(RICF)條件下生菜葉片的基因表達水平。結果表明,RBFF條件下有2685個基因存在差異表達,其中有1380個上調表達基因,1305個下調表達基因。RICF條件下有3264個基因差異表達,其中上調表達基因有881個,下調表達基因2383個。進一步分析發(fā)現(xiàn),1498個差異表達基因在RBFF和RICF條件下均表達,1187個基因在RBFF條件下差異表達,1766個在RICF條件下差異表達。從上述差異表達基因中篩選出10個可能與光脅迫相關的基因,實時熒光定量驗證轉錄組數(shù)據(jù)的可靠性。結果表明,大部分基因的表達情況與測序結果一致,說明轉錄組數(shù)據(jù)是可靠的。光響應相關基因的表達分析結果顯示,RBFF覆蓋下大部分基因在覆蓋15?d時大量表達,達到表達高峰。RICF下的3個基因表達量較高,其余的表達量較低,大部分基因在?15~21?d時達到表達高峰。本研究為進一步挖掘生菜基因組中光響應基因以及揭示生菜對光響應的分子機制提供理論依據(jù)和數(shù)據(jù)支持。
關鍵詞:生菜;光學分光膜;轉錄組分析;實時熒光定量PCR(qRT-PCR)
中圖分類號:Q949.783.5;Q786???? 文獻標識碼:A
Abstract: New photovoltaic agriculture can generate photovoltaic power under the light demand of crop growth. To study the differential gene expression in lettuce leaves under different spectrophotometric films, the ‘Adina lettuce variety was used as the experimental material, and the gene expression level of lettuce leaves under the conditions of red and blue filter film (RBFF) and far infrared cut-off film (RICF) was analyzed by the transcriptome sequencing (RNA-seq) technique. The results showed that 2685 genes were differentially expressed in RBFF, including 1380 up-regulated genes and 1305 down-regulated genes; 3264 genes were differentially expressed in RICF, of which 881 were up-regulation and 2383 down-regulation. Further analysis revealed that 1498 differentially expressed genes were expressed in both RBFF and RICF, 1187 genes were differentially expressed in the RBFF, while 1766 were differentially expressed in RICF. Ten genes related to light stress were screened from the differentially expressed genes, and the reliability of transcriptome data was verified by qRT-PCR. The results of expression analysis of light response related genes showed that most of the genes under red-blue filter film were expressed in large quantities, and the expression reached peak at 15 d; under far infrared cut-off film, the expression of three genes was higher, while the expression of others was lower. The expression of most genes reached peak at 1521 d. This study would provide a theoretical basis and data support for further exploring photoresponsive genes in the lettuce genome and revealing the molecular mechanism of the lettuce response to light.
Keywords: lettuce; optical spectrophotometric film; transcriptome analysis; quantitative real-time?PCR (qRT-PCR)
生菜(Lactuca sativa L.)又名葉用萵苣,菊科萵苣屬萵苣種的葉用萵苣變種,為1、2年生草本植物[1-3]。生菜富含維生素、花青素和礦物質等營養(yǎng)成分,同時具有醫(yī)療保健功效[4-7],是目前植物工廠試驗和生產的主栽類型和模式植物,適合水培,可在弱光條件下培養(yǎng)[8-10]。隨著市場經濟的發(fā)展、人們生活水平的提高,消費者對蔬菜的品質要求越來越高,培育營養(yǎng)價值高、口味好、無公害的綠色蔬菜逐漸成為消費者和科研人員追逐的目標[11]。目前對生菜的研究大多集中在栽培管理技術[12-14]、提高生菜營養(yǎng)品質[15]等方面,對生菜轉錄組測序的研究報道較少。
轉錄組是特定的組織或者細胞在某一發(fā)育階段或功能狀態(tài)下轉錄出來的所有RNA的集合[16]。轉錄組研究是研究基因結構、功能和表達的重要方法,也是表型關聯(lián)研究的重要手段[17]。轉錄組測序作為轉錄組學研究的關鍵技術,對深入探索植物的分子機制具有重要作用。光在植物生長發(fā)育過程中起至關重要的作用,也是生菜生長發(fā)育過程中的關鍵因素之一[18]。在生菜整個生長期進行連續(xù)光照,能夠顯著提高生菜的產量,促進可溶性糖、抗氧化物質的合成[19]。有研究表明,藍光對生菜花青素的合成具有重要作用[20]。周智等[21]研究表明,4∶1的紅藍光質比有利于擬南芥生長發(fā)育,減少藍光比例對擬南芥的根系生長及葉綠素積累有一定的促進作用。
光伏農業(yè)作為一種新型的農業(yè)發(fā)展方式,在滿足作物生長光需求的前提下,將多余的光反射集中于晶硅電池上用于發(fā)電,實現(xiàn)植物生長和光伏發(fā)電兩不誤[22]。本研究利用自主研發(fā)的新型納米光學分光膜,分別為紅藍濾光膜(Red and blue filter film, RBFF)和遠紅光截止膜(Far infrared cut-off film, RICF)。其中,RBFF是將太陽光中適合光合作用的紅藍光光譜分選出來用于植物生長,其余光譜反射用于發(fā)電。同時,為探討遠紅光對植物生長的影響,研制出了RICF,除遠紅光外,其余光譜全部透過。前期預實驗測定了這2種光學膜覆蓋下生菜的生理生化指標、生物酶活性以及營養(yǎng)品質等指標的變化,在此基礎上,本研究通過對不同光學膜覆蓋下的生菜葉片進行轉錄組測序,從中挖掘生菜響應光脅迫的相關基因,為更進一步探索生菜對光響應的分子機制研究提供數(shù)據(jù)支撐。
1? 材料與方法
1.1? 試驗材料及處理
試驗在中國科學技術大學先進技術研究院玻璃溫室中進行,試驗所用生菜品種為‘阿迪娜,種子由瑞克斯旺(中國)種子有限公司提供。種子播于穴盤內,育苗24 d?后,移栽至玻璃溫室,2?d后分別采用普通玻璃板(common glass, CG,光強660?μmol/(m·s))、RBFF(由納米材料制成,粘附于普通玻璃板上,只透過紅光和藍光,光強440?μmol/(m·s),其余光譜收集用于發(fā)電。)、RICF(粘附于普通玻璃板上,除了遠紅光外,其他光全部透過,光強700?μmol/(m·s),目的探討缺失遠紅光對蔬菜生長的影響)覆蓋培養(yǎng)。蓋膜9?d(多云)后,于下午取樣,每個處理分別取3株葉片等量混勻,液氮速凍,?80?℃保存,用于后續(xù)的RNA提取、cDNA文庫構建和測序。測序由深圳華大基因股份有限公司完成。
1.2? 生菜總RNA提取、cDNA文庫構建和測序
RNA提取由深圳華大公司完成,用Agilent 2100?Bioanalter(Agilent RNA 6000?Nano Kit)檢測總RNA的濃度、RIN值、28S/18S比值,RNA純度使用紫外分光光度計NanoDropTM進行。構建
cDNA文庫時先用帶有Oligo dT的磁珠富集含有poly A尾巴的mRNA,然后用打斷buffer把獲得的RNA片段化,用隨機N6引物進行反轉錄,再用DNA聚合酶Ⅰ和RNase H合成第二鏈cDNA。補平雙鏈DNA末端并磷酸化5端,將合成的雙鏈DNA連接到配對的接頭上,利用特異性引物進行PCR擴增富集。使用華大基因公司BGISEQ?500平臺對cDNA文庫進行上機測序。
1.3? 差異表達基因的qRT-PCR驗證
提取與測序同批的生菜樣品總RNA,用PrimeScriptTM RT Reagent Kit gDNA Eraser(TaKa?Ra)試劑盒反轉錄成cDNA。利用IDT(Integrated DNA Technologies)進行引物設計,Primer?design進行引物校正,引物序列見表1。實時熒光定量PCR體系采用iTaqTM Universal SYBR Green Supermix (BIO-RAD)和CFX96TM Real-Time System檢測系統(tǒng),反應程序如下:50?℃ 2 min,95?℃ 10?min,95?℃ 15 s,60?℃ 1 min,共35個循環(huán)。對隨機選取10個DEGs進行表達分析,以Lsactin為內參基因[4],以普通玻璃板覆蓋的為對照,采用2??CT估算待測差異基因的表達水平。
1.4? 光響應相關基因的表達分析
翟克清等[23]通過生菜覆膜20、35 d的生理指標測定,發(fā)現(xiàn)蓋膜20 d酶活性變化較35 d的大,且與對照組相比,蓋膜20 d處理的生菜葉片細胞超微結構和葉綠體結構有顯著差異。為檢測不同光響應基因對不同光學分光膜覆蓋的反應,分別于蓋膜后9(多云)、15(多云)和21 d(晴)下午取‘阿迪娜生菜葉片,提取總RNA,經反轉錄成cDNA。選取光響應相關基因的同源基因LSAT_9X83701(PHYA)、LSAT_6X401(PHYB)、LSAT_8X31220(PIF3)、LSAT_3X58041(PIF4)、LSAT_3X81620(PAP1)、LSAT_2X122581(LHY)及LSAT_2X76880(CHS),以其特異性引物進行qRT-PCR,以普通玻璃板覆蓋的為對照,數(shù)據(jù)處理及分析同上。
1.5? 數(shù)據(jù)處理
通過轉錄組測序獲得原始數(shù)據(jù)(raw reads)
后,使用華大自主研發(fā)的過濾軟件SOAPnuke進行過濾,對過濾后的clean reads進行質量統(tǒng)計,以確定所獲得的數(shù)據(jù)能否用于后續(xù)分析。用HISAT軟件將3個樣品經過濾得到的clean reads比對到公布的萵苣參考基因組序列(https:// www. ncbi.nlm.nih.gov/genome/352)。統(tǒng)計reads在參考序列上的分布情況以及覆蓋度。使用Bowtie2軟件將clean reads比對到參考序列以統(tǒng)計基因比對率,再使用RSEM計算基因和轉錄本的表達水平,得到FPKM (Fragments Per Kilobase Million)值。根據(jù)基因的表達量(FPKM)值計算該基因在不同樣本間的差異表達倍數(shù)。將FDR(False Discovery Rate)≤0.001且倍數(shù)差異在2倍以上的基因默認定義為差異表達基因(Diff?er?en?tially Expression Gene, DEG),采用Poss?ionDis方法進行差異檢測。最后在差異表達基因的基礎上,進行GO和KEGG功能富集分析。
2? 結果與分析
2.1? 測序原始數(shù)據(jù)分析
3個樣品(CG、RBFF、RICF)測序得到的raw reads的數(shù)量分別為72?160?422、69?726?782和69 726 610,經過濾去除低質量、接頭污染以及未知堿基含量過高的reads,分別得到65 699 706(6.57 Gb)、66 180 828(6.62 Gb)和65 498 632(6.55 Gb)個clean reads,Q20的百分比大于97%(表2),低質量(Quality < 20)的堿基比例較低,說明測序質量較好,可用于后續(xù)分析。
2.2? 生菜樣品與參考基因組的比對分析
使用BGISEQ-500平臺對3組樣品進行測序,每個樣品平均產出6.58 Gb數(shù)據(jù)。將clean reads比對到參考基因組序列,樣品比對基因組的平均比對率為91.99%,比對基因集的平均比對率為69.12%(表3)。樣品間的相關性比較結果顯示,RBFF與CG之間的相關性系數(shù)為0.917,RICF與CG之間的相關性系數(shù)為0.901(圖1)。另外,樣品一共檢測到11 430個新轉錄本,其中預測編碼的轉錄本為9060個,非編碼轉錄本為2370個。
2.3? 差異基因表達量分析
差異表達基因數(shù)目統(tǒng)計可以看出,與對照組(CG)相比,RBFF條件下有2685個基因存在差異表達,其中1380個上調表達基因,1305個下調表達基因。RICF條件下有3264個基因存在差異表達,其中881個上調表達基因,2383個下調表達基因(圖2)。
差異基因的維恩圖分析表明(圖3),1498個差異表達基因在RBFF和RICF條件下均表達,1187個基因在RBFF條件下差異表達,1766個在RICF條件下差異表達。根據(jù)試驗處理方案及數(shù)據(jù)結果顯示,初步推測1187、1766個基因中可能存在調節(jié)遠紅光和紅藍光響應的相關基因(圖3)。
2.4? 差異基因的功能注釋
為進一步了解生菜對紅藍光及遠紅光響應的分子機制,對DEGs進行Gene Ontology(GO)富集分析。GO分為分子功能(molecular function)、細胞組分(cellular component)和生物過程(biological process)3大類。其差異表達基因
分布在3大類中的45個類別,包括代謝過程、細胞過程、細胞壁、催化活性和結合等。另外,大多數(shù)差異基因與細胞組分相關,而參與生物過程的差異基因相對較少。在細胞組分中,以參與膜、膜組分、細胞、細胞組分、細胞器構成的富集最明顯。參與生物過程的差異基因主要富集在代謝過程和細胞過程這2個類別。而催化活性和結合是RBFF和RICF條件下分子功能差異基因富集的主要類別(圖4)。
2.5? 差異表達基因Pathway功能分析
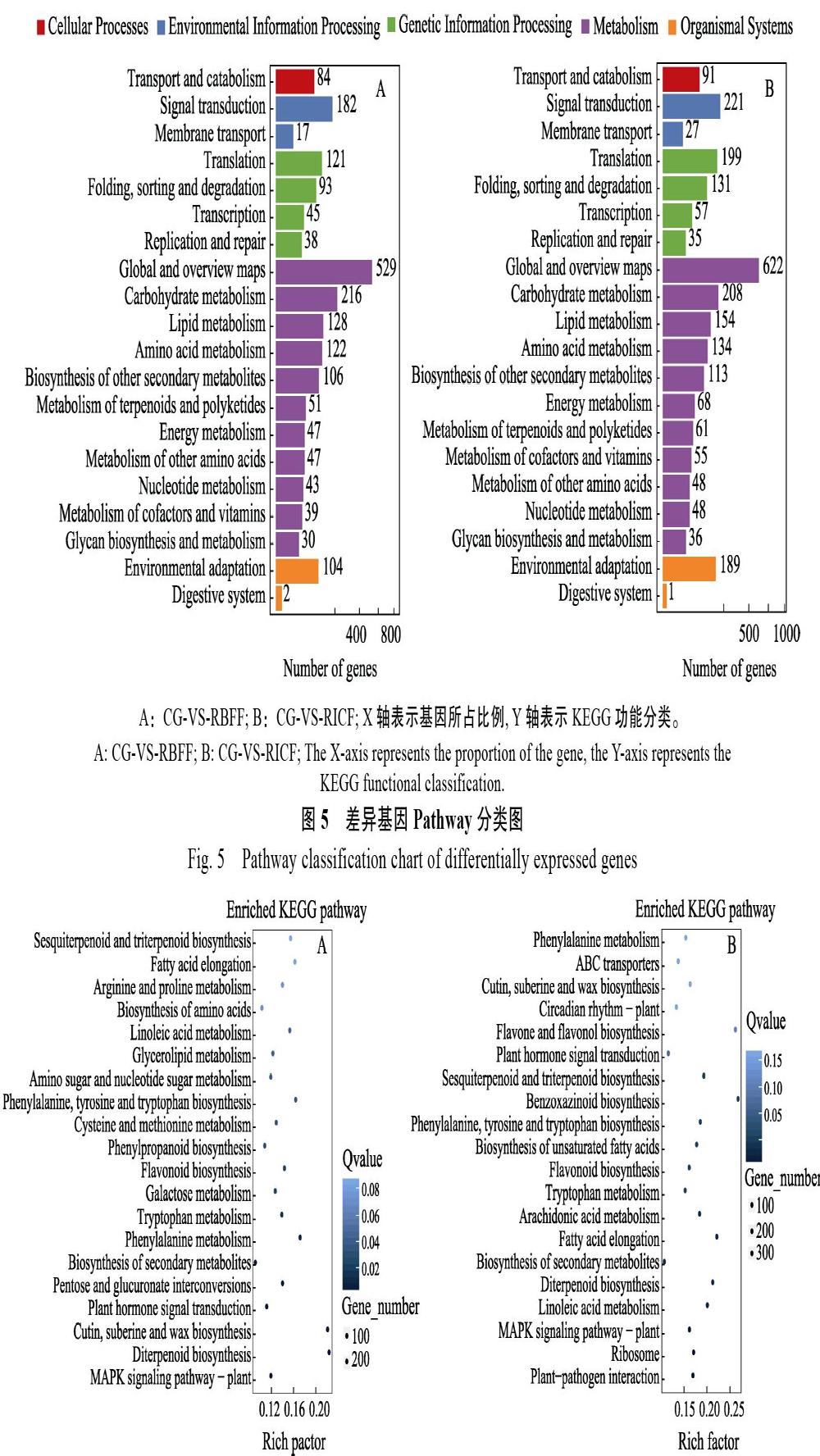
KEGG代謝通路將差異基因映射到5大類一級通路中,其中涉及代謝通路的基因最多。RBFF和RICF下分別是1358和1547個,分別占注釋到KEGG中的基因比例68%和62%。其次是遺傳信息處理(圖5)。另外,與CG相比,RBFF條件下富集結果最明顯的通路是角質、木栓和蠟的生物合成以及二萜生物合成。次生代謝產物的生物合成過程DEGs的數(shù)目最多,富集因子值很小。RICF條件下,苯并噁嗪類生物合成的富集因子值最大,富集結果最明顯。DEGs數(shù)目最多的也是次生代謝產物的生物合成這一過程(圖6)。
2.6? qRT-PCR驗證
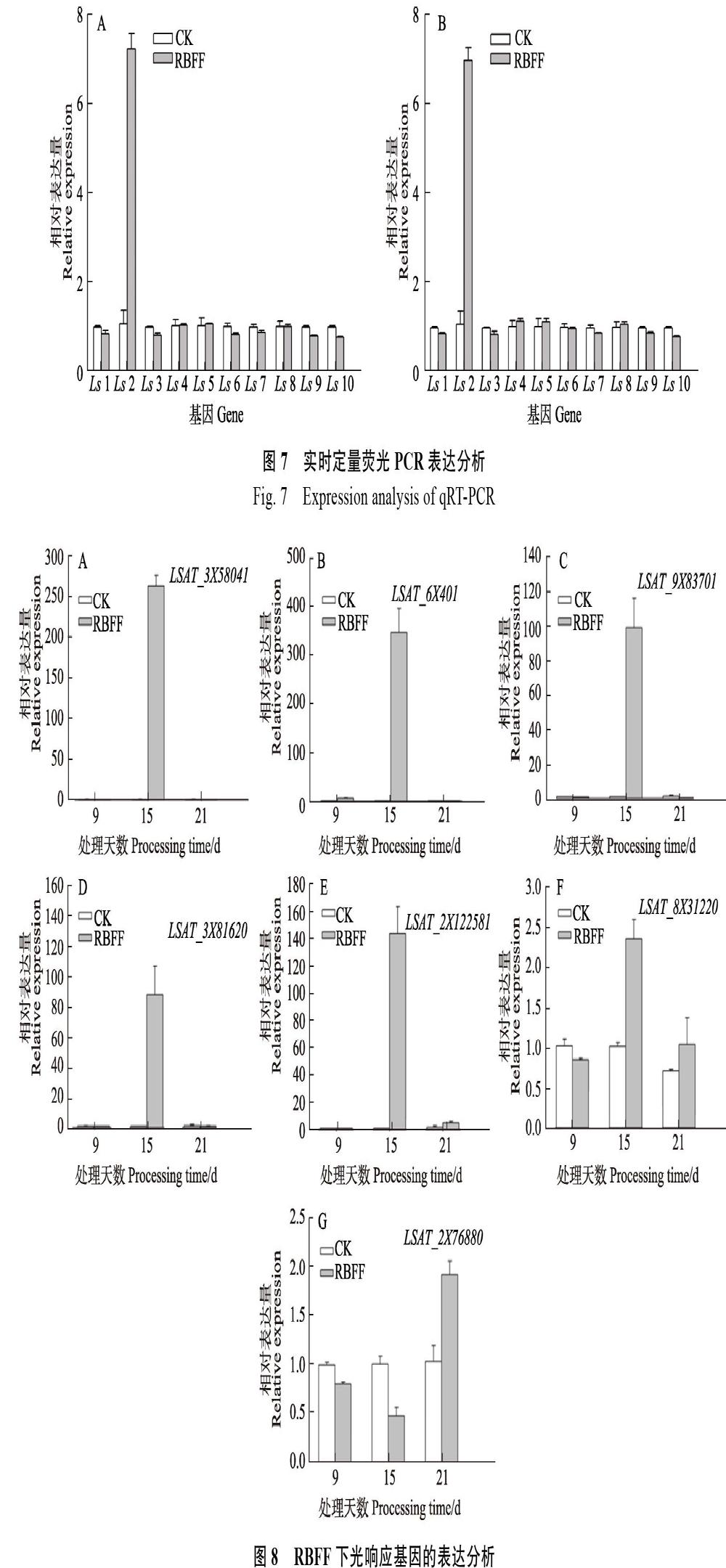
試驗選取了10個差異表達基因作為驗證測序數(shù)據(jù)可靠性的候選基因,其中大部分是與光信號途徑相關的基因,其中PHYA、PHYB屬于光敏色素基因家族,PIF3和PIF4 是與光敏色素A、B 等相互作用的因子。MYB轉錄因子PAP1及查爾酮合成酶基因CHS參與花青素合成途徑,RbcL參與植物光合作用關鍵基因,LHY是植物生長節(jié)律關鍵基因等。利用IDT(Integrated DNA Technologies)設計特異性引物進行實時熒光定量PCR,結果表明,在RBFF和RICF覆蓋下的生菜,10個基因的表達情況近乎一致,即Ls2(PHYB)基因的表達量最高,Ls2、Ls4(PAP1)、Ls5(LHY)、Ls8(PMA)均呈現(xiàn)上調表達,而Ls1(PIF4)、Ls3(PHYA)、Ls6(PIF3)、Ls7(Pme3)、Ls9(CHS)、Ls10(RbcL)均下調表達。大部分基因的表達與測序結果一致,說明轉錄組數(shù)據(jù)結果可靠(圖7)。
A:CG-VS-RBFF;B:CG-VS-RICF;X軸代表富集因子值(Rich Factor),是注釋上某一通路的前景值(差異基因個數(shù))與注釋上某一通路的背景值(所有基因個數(shù))之商,數(shù)據(jù)越大,說明富集結果越明顯。Y軸代表通路名稱,圖中圓點的顏色代表Q-value,顏色越淺值越大,越深值越小,值越小代表富集結果越顯著;圓點的大小代表DEGs數(shù)目,點越大代表數(shù)目越多,越小代表數(shù)目越少。
A: CG-VS-RBFF; B: CG-VS-RICF. The X-axis represents the enrichment factor value (Rich Factor), which is the quotient of the foreground value (number of differential genes) of a pathway on the annotation and the background value (number of all genes) of a pathway on the annotation, and the larger the data, the more obvious the enrichment results. The Y-axis represents the path name. The color of the dots in the figure represents the Q-value, and the lighter the color, the greater the value, the deeper the smaller, the latter represents the more significant the enrichment results; the size of the dots represents the number of DEGs, and the larger the number represents, the smaller the number represents.
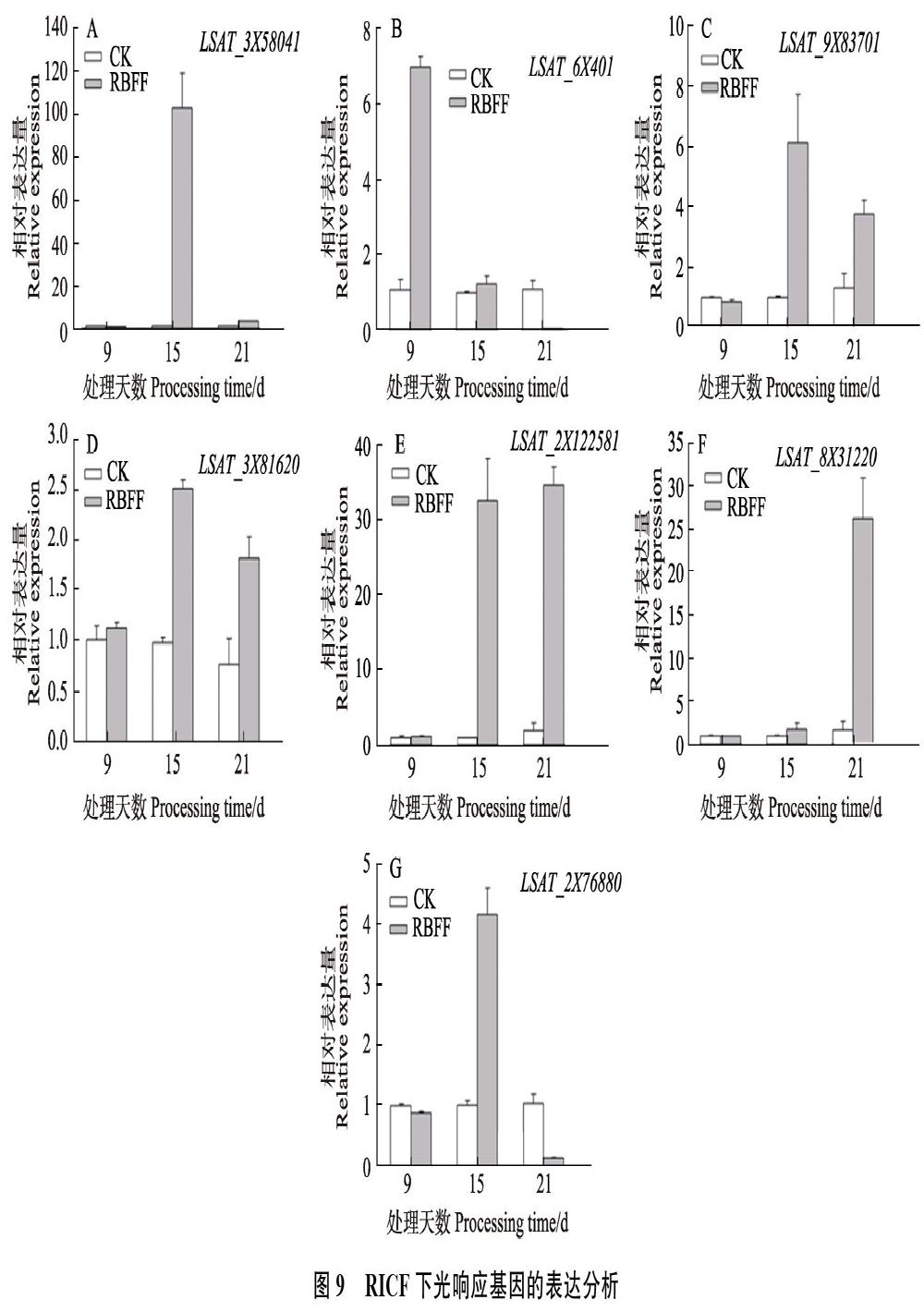
2.7? 不同分光膜下光響應相關基因的表達分析
RBFF覆蓋9、15和21?d時,不同光響應基因的表達情況不同(圖8)。其中,生菜PIF4、PHYB、PHYA、MYB75(同PAP1)、LHY的同源基因(LSAT_3?X?58041、LSAT_6X401、LSAT_ 9X83701、LSAT_3X?81620、LSAT_2X122581)大量表達,在覆蓋15?d時表達量最高,其表達量值分別為263.7、311.2、108.6、87.5和144.9。PIF3的同源基因LSAT_8X31220和CHS的同源基因LSAT_2X?7??6880整個過程表達量都比較低,LSAT_2X76880覆蓋9和15?d時呈現(xiàn)下調表達。LSAT_9X83701和LSAT_8X31220在覆蓋9?d時下調表達,其余情況均為上調表達。
RICF覆蓋9、15和21?d時,LSAT_3X58041在覆蓋9?d時呈現(xiàn)下調表達,覆蓋15?d時大量表達,表達量值達114.7。LSAT_2X122581在覆蓋15和21?d時表達量較高,LSAT_8X31220在覆蓋21?d時有較高的表達量。LSAT_6X401、LSAT_9X83701、LSAT_3X81620和LSAT_2X76?880表達量都比較低,其中LSAT_6X401覆蓋9?d時表達量稍高,其余以覆蓋15?d是表達量稍高(圖9)。
3? 討論
光照是影響植物生長發(fā)育的重要因素之一,紅光和藍光是植物光合作用中葉綠素吸收利用最多的光,能夠有效提高光合效率[24]。研究報道,紅光有利于植物營養(yǎng)物質的積累,藍光能夠促使植物花期提前,而紅藍光混合比單個紅光或藍光更有利于植物生長,且不同的植物對紅藍光混合比例的要求也不同[25-26]。黃薪歷等[27]在研究紅光和遠紅光對番茄生長發(fā)育的影響時指出,紅光和遠紅光的相對強度發(fā)生變化會影響植物的生長發(fā)育。目前,有關紅藍光影響生菜生長發(fā)育的研究較多,但生菜對紅藍光響應的機理尚不明確。
光既是植物體進行光合作用必不可少的條件,也是植物體生長發(fā)育和代謝調節(jié)等生命活動的關鍵環(huán)境因子,植物體接收光信號主要是由光受體完成[28]。研究發(fā)現(xiàn)的光受體有:感受藍光或近紫外UV-A區(qū)域光的隱花色素(Cryptoch-o?m?e?s),感受藍光的向光色素(Phototropins),感受藍綠光的ZTLS家族(Zeitlupes),感受紫外UV-B區(qū)域光的UV-B受體[29]以及感受紅光、遠紅光的光敏色素(phytochrome, PHY)。其中PHYA是遠紅光感受器,PHYB是紅光感受器。這些光受體感知外界的光信號后,通過相關光響應因子及途徑來調控植物體的光形態(tài)建成等生理過程[30]。本研究中RBFF和RICF兩組試驗,PHYB都表現(xiàn)為上調表達,說明生菜在紅光照射時,PHYB表現(xiàn)為高表達。PHYB是植物體內感受紅光和遠紅光的光受體,主要以紅光吸收型(Pr)、遠紅光吸收型(Pfr)2種形式存在,通過調節(jié)紅光與遠紅光可逆轉換過程來影響植物體的形態(tài)建成以及生理反應,其轉換水平與紅光、遠紅光的光強比值有關[27, 31-33]。低紅光/遠紅光比值使PHYB轉變?yōu)闊o活性的Pr形式,高紅光/遠紅光比值可使PHYB轉化為有活性的Pfr形式[28, 31]。推測本研究中PHYB表達上調可能是在紅光照射的條件下,PHYB的轉換調節(jié)作用引起的。另外,KEGG生物通路分析發(fā)現(xiàn),光敏色素B(PHYB)和光敏色素相關作用因子4(PIF4)可能既存在相互獨立的調控途徑,又存在相互協(xié)作共同參與植物體細胞伸長來響應光信號。研究表明,PHYB還能通過調節(jié)幼嫩葉片的氣孔發(fā)育來響應成熟葉片對光信號的感知,植物體主要是由光敏色素家族中的PHYB和光敏色素相互作用因子4(Phyto?c?h?r?o?m?e?-inte?racting factor 4, PIF4)對光信號進行響應[34-35]。光敏色素作用因子(PIF)在光敏色素介導的光響應過程中起至關重要的作用[30],PIF與PHY的協(xié)同作用會影響植物體的光形態(tài)建成,還參與植物對抗逆信號的響應過程[28]。Casson等[35]研究指出,除了與PIF4相互作用以響應光信號,PHYB也可能通過與PIF4無關的途徑獨立地對光信號作出響應,這與本研究中KEGG途徑分析結果類似。
研究發(fā)現(xiàn),有2類基因參與調控花青素的生物合成過程,一類是用于編碼各種酶的結構基因,一類是用于調控結構基因在特定時間和空間特異性表達的調控基因,稱作轉錄因子[36]。研究較多的是MYB轉錄因子,且其調控作用已在玉米、矮牽牛、葡萄等植物中得到證實[37]。陳靜等[31]研究表明,光敏色素在花青素的合成過程中起關鍵作用,不同紅光/遠紅光比例會影響花青素合成途徑。其中,MYB家族PAP1(Production of anthocyanin pigment 1)是與花青素合成途徑相關的基因[38-39]。劉軼等[40]研究表明,AtPAP1是調控花青素合成的關鍵基因,不需要其他轉錄因子的輔助,能單獨調控花青素的轉錄表達。本研究KEGG途徑分析結果表明,PAP1除了能獨立調控花青素的轉錄表達,還可能與查耳酮合酶(Ch?alcone synthase,CHS)基因共同調節(jié)UV-B受體的生物途徑。王曼等[41]發(fā)現(xiàn),誘導CHS表達的主要光受體是CRY1。擬南芥PAP1-D突變體中,CHS表達會引起花青素顯著積累[36]。目前對PAP1與CHS之間調控關系的研究尚不明確,探究這2個基因的相互作用對光脅迫研究意義重大。
光響應相關基因的表達分析表明,RBFF覆蓋的生菜,大部分光響應基因在覆蓋15?d呈現(xiàn)大量表達,表明其基因在此階段對紅藍光的缺乏比較敏感。而RICF覆蓋的生菜,PIF4、LHY、PIF3同源基因LSAT_3X58041、LSAT_2X122581和LSAT_8X31220分別在15?和21?d大量表達,可能是對缺失遠紅光比較敏感的基因。另外,PIF4同源基因LSAT_3X58041和LSAT_2X-122581在2種膜覆蓋15?d時的表達量都比較高,說明這2個基因能同時響應紅藍光和遠紅光脅迫。本研究得到的DEGs以及部分光響應基因的表達模式,可用來分析和挖掘生菜基因組中對紅藍光及遠紅光響應的相關基因以及它們之間的聯(lián)系,為揭示生菜對光響應的分子機制提供理論依據(jù)和數(shù)據(jù)支持。
參考文獻
孫金才, 陳卉卉, 趙川川. 鮮切生菜的保鮮工藝研究[J]. 食品與生物技術學報, 2015, 34(4): 402-406.
李清光. 鮮切生菜品質控制技術研究進展[J]. 食品工業(yè), 2018, 39(12): 226-229.
陳子敬. 生菜LsFT和LsSOC1基因的克隆及功能分析[D]. 北京: 中國農業(yè)大學, 2018.
劉丹丹. 外源硒對紫色生菜生理特性及花青素合成調控的研究[D]. 南京: 南京農業(yè)大學, 2016.
王? 波, 沈其榮, 賴? 濤, 等. 不同銨硝比營養(yǎng)液對生菜生長發(fā)育影響的研究[J]. 土壤學報, 2007, 44(3): 561-565.
班兆軍, 張晶琳, 袁秋萍, 等. 不同包裝膜對生菜貯藏期品質的影響[J]. 食品科技, 2018, 43(5): 31-36.
潘文娟. 生菜成熟度識別及采后品質質量研究[D]. 合肥: 合肥工業(yè)大學, 2015.
劉慶鑫, 方? 慧, 李宗耕, 等. 自然光植物工廠多層立體栽培補光對生菜產量和品質的影響[J]. 中國農業(yè)大學學報, 2019, 24(1): 92-99.
Truco M J, Antonise R, Lavelle D, et al. A high-density integrated genetic linkage map of lettuce (Lactuca spp.)[J]. Theoretical and Applied Genetics, 2007, 115(6): 735-746.
Higashi T, Aoki K, Nagano A J, et al. Circadian oscillation of the lettuce transcriptome under constant light and light- ark conditions[J]. Frontiers in Plant Science, 2016, 7: 1114.
郭新波. 生菜特殊營養(yǎng)品質評價與代謝工程強化研究[D]. 上海: 復旦大學, 2013.
申領艷, 閆鳳岐, 康少輝, 等. 張承壩上地區(qū)結球生菜1年2茬安全高效栽培模式和標準化田間管理技術[J]. 蔬菜, 2019(3): 45-47.
牛小朋. 生菜栽培技術[J]. 蔬菜, 2012(9): 13-14.
雷喜紅, 李? 蔚, 孫朝華, 等. 蔬菜工廠化生產(八) 高品質生菜水培生產技術[J]. 中國蔬菜, 2019(2): 87-91.
陳曉麗, 楊其長, 張? 馨, 等. LED綠光補光模式對生菜生長及品質的影響[J]. 中國農業(yè)科學, 2017, 50(21): 4170-4177.
石文芳. 基于RNA-seq測序的梅花轉錄組分析[D]. 北京: 北京林業(yè)大學, 2012.
王楚彪, 盧萬鴻, 林? 彥, 等. 轉錄組測序的發(fā)展和應用[J]. 桉樹科技, 2018, 35(4): 20-26.
Demotes-Mainard S, Peron T, Corot A, et al. Plant responses to red and far-red lights, applications in horticulture[J]. Environmental and Experimental Botany, 2016, 121: 4-21.
查凌雁, 劉文科. 晝夜連續(xù)照射LED紅藍光對不同品種生菜生長和品質的影響[J]. 中國農業(yè)氣象, 2018, 39(7): 453-461.
Baek G Y, Kim M H, Kim C H, et al. The effect of LED light combination on the anthocyanin expression of lettuce[J]. IFAC Proceedings Volumes, 2013, 46(4): 120-123.
周? 智, 張永麗, 王變變, 等. 熒光粉激發(fā)型LED光對擬南芥生長發(fā)育的影響[J]. 植物學報, 2018, 53(4): 502-508.
張昕昱, 張智深, 張放心, 等. 基于植物光合作用的太陽光譜分離技術進展[J]. 照明工程學報, 2018, 29(4): 17-21.
翟克清, 張昕昱, 周念念, 等. 光學干涉膜下生菜的生理指標變化及品質分析[J]. 浙江農業(yè)學報, 2019, 31(9): 1493-1501.
Pfündel E, Baake E. A quantitative description of fluorescence excitation spectra in intact bean leaves greened under intermittent light[J]. Photosynthesis Research, 1990, 26(1): 19-28.
王? 君, 仝宇欣, 楊其長. LED光源紅藍光配比對生菜光合作用及能量利用效率的影響[J]. 農業(yè)工程學報, 2018, 34(14): 234-240.
聞? 婧, 楊其長, 魏靈玲, 等. 不同紅藍LED組合光源對葉用萵苣光合特性和品質的影響及節(jié)能評價[J]. 園藝學報, 2011, 38(4): 761-769.
黃薪歷, 于? 捷, 艾楷棋, 等. 紅光和遠紅光對番茄生長發(fā)育的影響[J]. 西北農林科技大學學報(自然科學版), 2018, 46(3): 111-118, 127.
姜? 敏, 李? 魏, 董? 錚, 等. 光敏色素對植物抗逆反應的調控研究進展[J]. 生物技術通報, 2017, 33(7): 15-21.
Wu L, Yang H Q. CRYPTOCHROME 1 is implicated in promoting R protein-mediated plant resistance to Pseudomonas syringae in Arabidopsis[J]. Molecular Plant, 2010, 3(3): 539-548.
岳? 晶, 管利萍, 孟思遠, 等. 光敏色素信號通路中磷酸化修飾研究進展[J]. 植物學報, 2015, 50(2): 241-254.
陳? 靜, 陳啟林, 翁? 俊, 等. 不同紅光/遠紅光比例(R/FR)的光照影響番茄幼苗葉片中花青素合成的研究[J]. 西北植物學報, 2004, 24(10): 1773-1778.
Smith Harry. Physiological and ecological function within the phytochrome family[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1995, 46(1): 289-315.
Whitelam G C, Smith H. Retention of phytochrome-medi?a?ted shade avoidance responses in phytochrome-deficient mutants of Arabidopsis, cucumber and tomato[J]. Journal of Plant Physiology, 1991, 139(1): 119-125.
Casson S, Hetherington A. Phytochrome B is required for light-mediated systemic control of stomatal development[J]. Current Biology, 2014, 24(11): 1216-1221.
Casson S A, Franklin K A, Gray J E, et al. Phytochrome B and PIF4 regulate stomatal development in response to light quantity[J]. Current Biology, 2009, 19(3): 229-234.
田愛梅, 張恩慧, 許忠民, 等. 白芨MYB類轉錄因子PAP1基因的克隆與表達分析[J]. 西北農業(yè)學報, 2014, 23(3): 123-127.
賈趙東, 馬佩勇, 邊小峰, 等. 植物花青素合成代謝途徑及其分子調控[J]. 西北植物學報, 2014, 34(7): 1496-1506.
Tohge T, Nishiyama Y, Hirai M Y, et al. Functional genomics by integrated analysis of metabolome and transcriptome of Arabidopsis plants over-expressing an MYB transcription factor[J]. Plant Journal, 2005, 42(2): 218-235.
Borevitz JO, Xia Y, Blount J, et al. Activation tagging identifies a conserved MYB regulator of phenylpropanoid biosynthesis[J]. The Plant Cell, 2000, 12(12): 2383-2393.
劉? 軼, 鄭唐春, 代麗娟, 等. 擬南芥AtPAP1基因植物表達載體構建及在煙草中遺傳轉化分析[J]. 植物生理學報, 2017, 53(7): 1199-1207.
王? 曼, 王小菁. 藍光和蔗糖對擬南芥花色素苷積累和CHS基因表達的影響[J]. 熱帶亞熱帶植物學報, 2004, 12(3): 252-256.

