拮抗放線菌菌株FS-4發(fā)酵工藝篩選
段雅婕 梅志剛 孫德權(quán) 李偉明 龐振才 胡會剛
摘? 要:FS-4是1株對香蕉枯萎病菌有較好拮抗作用的放線菌。以高氏一號培養(yǎng)基為基礎(chǔ),通過單因素和響應(yīng)面實驗進行了相關(guān)優(yōu)化,對FS-4菌株的發(fā)酵工藝進行篩選。結(jié)果表明:0.5%蛋白胨,2.4%蔗糖,0.05%的磷酸氫二鉀、氯化鈉和硫酸鎂,發(fā)酵溫度28?℃,初始pH為7為最佳培養(yǎng)基配方及最優(yōu)發(fā)酵條件。發(fā)酵62 h后,發(fā)酵液中抑菌物質(zhì)活性達到最高水平,對香蕉枯萎病菌的抑菌圈直徑達到27.1 mm。
關(guān)鍵詞:放線菌菌株FS-4;發(fā)酵工藝;響應(yīng)面法
中圖分類號:Q949.748.5????? 文獻標識碼:A
Abstract: The screening of antagonistic bacteria from soil microorganisms in the areas with banana Fusarium wilt is of great practical significance for controlling this disease. In this report, a strain, designated FS-4, was isolated from healthy banana rhizosphere soil in the area affected by Fusarium wilt. Based on Gauses No. 1 synthetic medium, the optimization of medium, single factor experiments and response surface experiments were conducted to maximize the production of the antibacterial substances of actinomycete FS-4. The best fermentation medium and fermentation conditions were as follows: sucrose 2.4%, peptone 0.5%, K2HPO4 0.05%, NaCl 0.05%, MgSO4 0.05%, fermentation temperature 28 ℃, initial pH 7. Under the conditions, the inhibition zone diameter of actinomycete FS-4 fermentation filtrate reached 27.1 mm on the test plates of Bacillus subtilis after 62 h incubation
Keywords: actinomycetes FS-4; fermentation conditions; response surface method
由尖孢鐮刀菌(Fusarium oxysporum f. sp. cubense)侵染引起的枯萎病是香蕉種植中的毀滅性病害,對相關(guān)產(chǎn)業(yè)的健康發(fā)展具有重要影響[1]。抗病育種、化學(xué)農(nóng)藥、輪作等方法在對香蕉枯萎病的防治中均存在不同的缺陷,難以規(guī)模化推廣應(yīng)用。利用包括拮抗微生物在內(nèi)的生物防治方法具有安全、環(huán)保、經(jīng)濟效益高等優(yōu)點,是當前該類病害防治研究中的熱點[2]。FS-4是本團隊從香蕉枯萎病發(fā)病田土壤中分離篩選出的1株放線菌,其對香蕉枯萎病菌具有較好拮抗作用[3-4]。
本團隊采用16S rDNA 序列分析其放線菌為曼尼普爾鏈霉菌(Streptomyces manipurensis),命名為曼尼普爾鏈霉菌FS-4(Streptomyces manipurensis FS-4)[3-4]。采用國際鏈霉菌規(guī)劃中的標準培養(yǎng)基(1976),28?℃培養(yǎng)7~21 d,觀察FS-4菌株培養(yǎng)特征。結(jié)果發(fā)現(xiàn):FS-4菌株能使硝酸鹽還原,淀粉水解,能產(chǎn)生H2S、黑色素、尿素酶和酪氨酸酶,但不能使明膠液化、牛奶胨化與凝固。生長pH范圍為5.0~10.0,最適生長pH為7.0。最適生長溫度為28~32?℃,不能生長在NaCl含量大于3%的培養(yǎng)基。FS-4菌株對香蕉枯萎病1號(Foc 1)和4號(Foc 4)小種均有拮抗作用,對香蕉枯萎病菌1號小種的拮抗性較弱,顯著低于香蕉枯萎病菌4號小種,2者的抑菌帶寬度分別為12.07和15.12 mm。
菌株FS-4在人工培養(yǎng)條件下生長緩慢,制約了相關(guān)研究工作的進行。響應(yīng)面分析法通過研究響應(yīng)輸出結(jié)果與影響因子之間的數(shù)學(xué)關(guān)聯(lián)模式,經(jīng)由設(shè)計者在所關(guān)心的試驗區(qū)域內(nèi)以系統(tǒng)的方式進行試驗,最終得到所設(shè)想的響應(yīng)值和影響因子變化趨勢,是一類包含了數(shù)學(xué)應(yīng)用、統(tǒng)計處理和試驗設(shè)計的分析工具[5],近年來在微生物發(fā)酵工藝研究中得到廣泛應(yīng)用。為更好地開展FS-4拮抗作用機理及其田間應(yīng)用研究,本研究采用響應(yīng)面分析法開展FS-4菌株的發(fā)酵工藝篩選研究。
1? 材料與方法
1.1? 材料
拮抗放線菌菌株FS-4和香蕉枯萎病菌菌株Foc 4由中國熱帶農(nóng)業(yè)科學(xué)院南亞熱帶作物研究所提供。高氏1號培養(yǎng)基和營養(yǎng)肉湯培養(yǎng)基參照王小琴等[6]的方法制備,相關(guān)試劑均為國產(chǎn)分析純。
1.2? 方法
1.2.1? 菌株發(fā)酵和拮抗活性評價? 參照段雅婕等[3]和柯春亮等[4]的方法進行。
1.2.2? 液體發(fā)酵培養(yǎng)基及發(fā)酵條件的單因素分析[7-11]? 以高氏1號培養(yǎng)基為基礎(chǔ),分別以不同碳源(葡萄糖、蔗糖、玉米粉、乳糖)代替基礎(chǔ)培養(yǎng)基中的碳源(可溶性淀粉)。制備無菌發(fā)酵濾液后,采用牛津杯法評價拮抗物質(zhì)活性。獲得最佳碳源后,將含量調(diào)整為1%、2%、3%、4%和5%,篩選出最佳含量。在明確最佳碳源及其含量后,以0.1%的硫酸銨、硝酸鈉、酵母粉、蛋白胨代替原基礎(chǔ)培養(yǎng)基中硝酸鉀,篩選出最佳氮源。將最佳氮源含量調(diào)整為0.1%、0.2%、0.3%、0.4%、0.5%,確定最佳含量。
將氯化鈉、磷酸氫二鉀和硫酸鎂含量分別調(diào)為0.025%、0.050%、0.075%、0.100%、0.125%,篩選出最佳含量。設(shè)置培養(yǎng)基初始pH為 5、6、7、8和9,發(fā)酵溫度為22、25、28、31和34?℃,發(fā)酵時間為48、72、96、120和144 h,分別篩選出最佳參數(shù)。
1.2.3? 響應(yīng)面分析法優(yōu)化發(fā)酵培養(yǎng)基及發(fā)酵條件? 在單因素實驗的基礎(chǔ)上,選取蔗糖、蛋白胨、時間作為考察因素,以抑菌圈大小為響應(yīng)值,采用3因素3水平對放線菌FS-4最佳發(fā)酵條件進行響應(yīng)面分析(表1)[12]。
1.3? 數(shù)據(jù)處理
利用Design-Expert軟件進行3因素3水平的Box-Behnken實驗設(shè)計。所有實驗均為3次重復(fù),使用SPSS19.0軟件進行統(tǒng)計學(xué)方差分析。
2? 結(jié)果與分析
2.1? 單因素實驗結(jié)果
2.1.1? 碳源種類及含量對放線菌FS-4產(chǎn)抑菌物質(zhì)的影響? 以高氏一號培養(yǎng)基為基礎(chǔ)進行碳源的優(yōu)化[13],分別以蔗糖、乳糖、玉米粉、葡萄糖、可溶性淀粉作為碳源。結(jié)果表明,以蔗糖為碳源的培養(yǎng)基,發(fā)酵液的抑菌圈直徑最大達到20.5 mm,表明蔗糖最有利于放線菌FS-4產(chǎn)生抑菌物質(zhì)(圖1)。在對蔗糖5個不同濃度處理的評價中,發(fā)現(xiàn)含量為2%時,發(fā)酵液產(chǎn)生的抑菌物質(zhì)活性最強(圖2)。
2.1.2? 氮源種類及濃度對放線菌FS-4產(chǎn)抑菌物質(zhì)的影響? 以高氏1號培養(yǎng)基為基礎(chǔ),進行了5種氮源的篩選[14-15]。以蛋白胨為碳源時,抑菌圈直徑最大,效果最好(圖3),而且當?shù)鞍纂撕繛?.4%時,發(fā)酵液的抑菌物質(zhì)活性最高(圖4)。
不同小寫字母表示差異分析達到5%顯著水平。
2.1.3? 氯化鈉、磷酸氫二鉀、硫酸鎂含量對放線菌FS-4產(chǎn)抑菌物質(zhì)的影響? 在高氏1號培養(yǎng)基的基礎(chǔ)上進行了無機鹽濃度的優(yōu)化,結(jié)果表明,3種無機鹽的不同濃度對放線菌FS-4抑菌物質(zhì)的活性影響不大(圖5)。
不同小寫字母表示差異分析達到5%顯著水平。
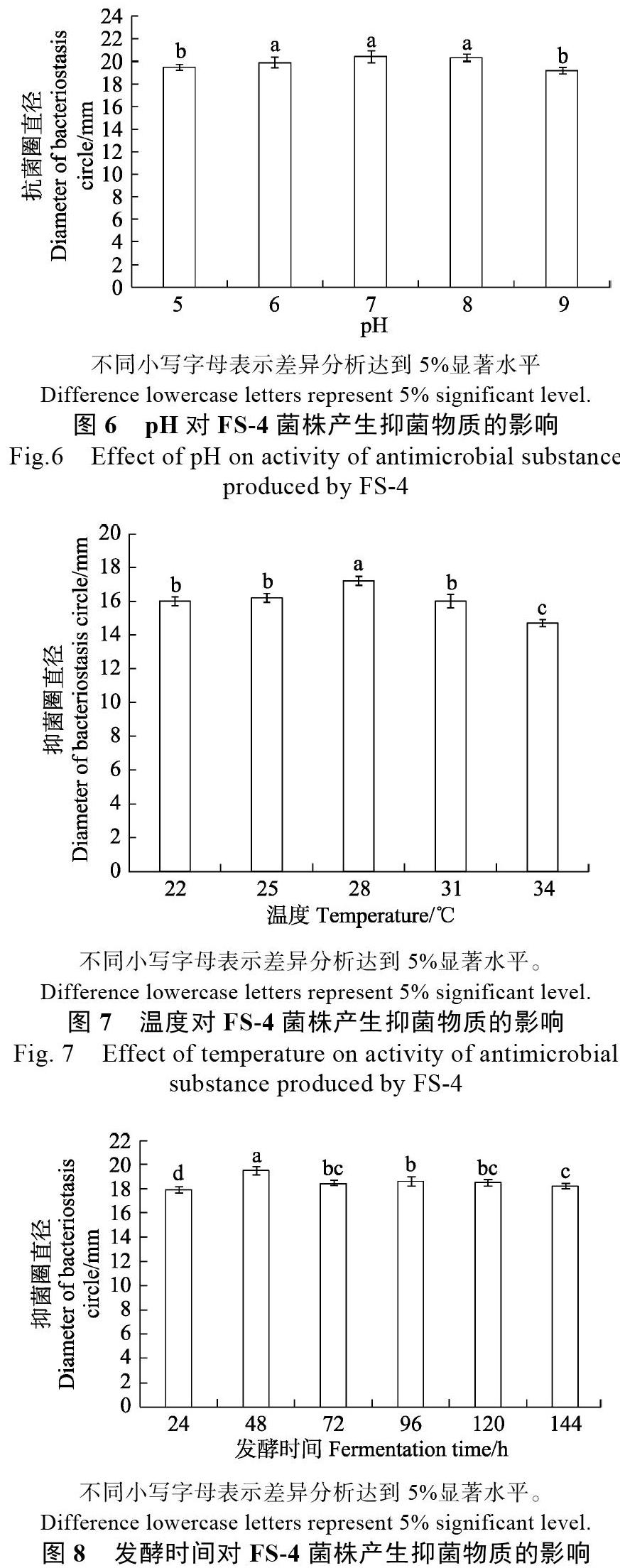
2.1.4? 初始pH、發(fā)酵溫度、時間對放線菌FS-4產(chǎn)抑菌物質(zhì)的影響? 圖中抑菌圈的直徑反映發(fā)酵液中抑菌物質(zhì)的活性。篩選結(jié)果表明,初始pH在6~8、發(fā)酵溫度在22~31?℃范圍內(nèi),無菌發(fā)酵液拮抗物質(zhì)活性活性最高,而48 h為發(fā)酵最適時間(圖6,圖7和圖8)。
2.2? 響應(yīng)面優(yōu)化結(jié)果及分析
2.2.1? 響應(yīng)面結(jié)果? 如表2所示,本研究對17個實驗點進行分析。其中,12個點是析因點,5個點(實驗號分別為1、5、8、10和17)用于計算實驗誤差的中心實驗點。
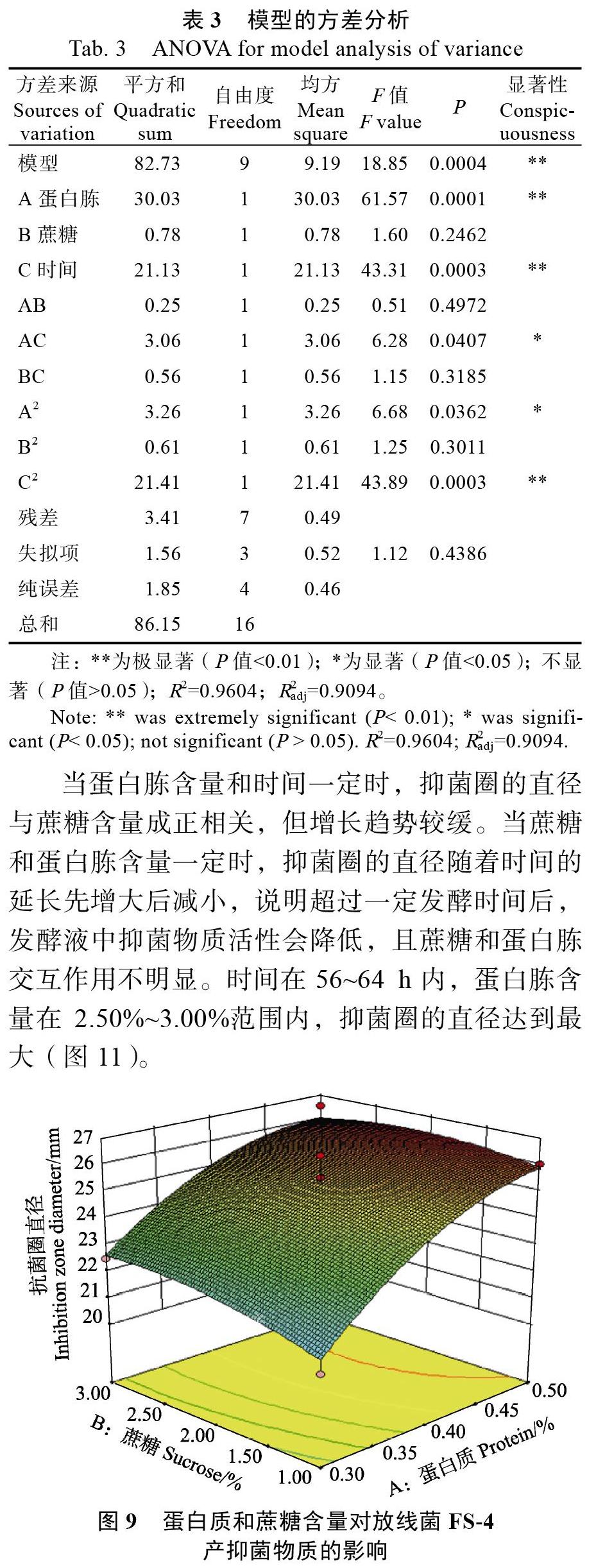
對回歸方程模型進行方差分析,結(jié)果如表3所示。回歸方程模型極顯著,表明模型建立可信。模型的決定系數(shù)為0.9604,表明3.96%的實驗數(shù)據(jù)不適合預(yù)測模型。模型的校正系數(shù)為0.9094,說明模型擬合程度良好,只有9.06%的實驗數(shù)據(jù)的變異性不能解釋。失擬項的P值是0.4386,不具有統(tǒng)計學(xué)差異,說明模型不需要引入更高次數(shù)的項。一次項A和C,二次項C2都達到極顯著水平,交互項AC,二次項A2都達到顯著水平。還可以得知3個因素對抑菌圈直徑大小的影響順序為:蛋白胨>蔗糖>時間。
2.2.3? 響應(yīng)面的分析與優(yōu)化[17-18]? 根據(jù)建立的回歸模型得到響應(yīng)曲面圖(圖9)。當時間一定時,抑菌圈的直徑隨著蛋白胨和蔗糖含量的增加而變大,蛋白胨比蔗糖對抑菌圈直徑影響更大,兩者的交互作用不明顯。蔗糖含量在2.50%~3.00%,蛋白胨含量在0.45%~0.50%范圍內(nèi),抑菌圈的直徑達到最大(圖9)。
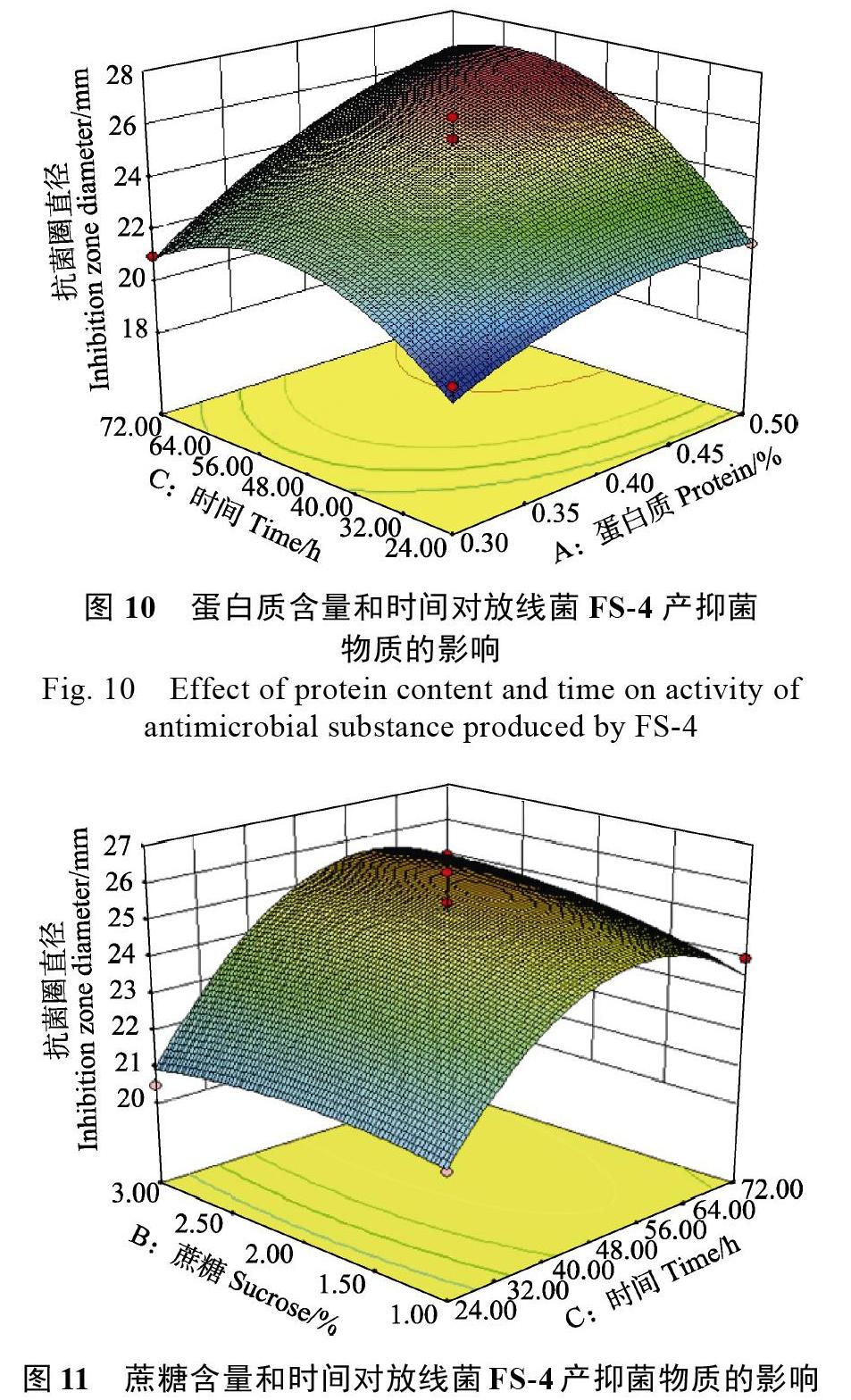
當蔗糖含量和時間一定時,抑菌圈的直徑與蛋白胨含量成正相關(guān),而蔗糖和蛋白胨含量一定時,抑菌圈的直徑隨著時間的延長先增大后減小,兩者交互作用明顯。時間在56~64 h內(nèi),蛋白胨含量在0.45%~0.50%范圍內(nèi),抑菌圈的直徑達到最大(圖10)。
當?shù)鞍纂撕亢蜁r間一定時,抑菌圈的直徑與蔗糖含量成正相關(guān),但增長趨勢較緩。當蔗糖和蛋白胨含量一定時,抑菌圈的直徑隨著時間的延長先增大后減小,說明超過一定發(fā)酵時間后,發(fā)酵液中抑菌物質(zhì)活性會降低,且蔗糖和蛋白胨交互作用不明顯。時間在56~64 h內(nèi),蛋白胨含量在2.50%~3.00%范圍內(nèi),抑菌圈的直徑達到最大(圖11)。
2.2.4? 放線菌FS-4發(fā)酵培養(yǎng)基及發(fā)酵條件的優(yōu)化和可靠性驗證? 通過Design-Expert V8.0.6軟件分析得到最佳條件為:蛋白胨含量0.5%,蔗糖2.37%,時間62.04 h。在此條件下,抑菌圈的理論直徑為27.46 mm。為簡化實驗操作,將條件修正為蛋白胨濃度0.5%,蔗糖濃度2.4%,時間62 h。實際得到抑菌圈直徑27.1 mm,與預(yù)測理論值相近。因此,得出的最佳條件具有較好的實用價值。
3? 討論
抗菌活性物質(zhì)通常作為拮抗放線菌發(fā)揮生物防治作用的物質(zhì)基礎(chǔ),其產(chǎn)量的高低影響著抑菌的實際效果[15, 19]。發(fā)酵是獲得大量微生物活性代謝產(chǎn)物的基礎(chǔ),微生物代謝產(chǎn)物的類型和產(chǎn)量與其培養(yǎng)條件,如培養(yǎng)基中的碳源、氮源、pH等密切相關(guān)[20-21],因此,探索出適宜的培養(yǎng)條件尤為關(guān)鍵。研究表明,不同培養(yǎng)基配方對菌株抑菌活性有較大影響[22-23]。程沁園等[24]研究的放線菌菌株WB-F以葡萄糖為碳源,黃豆粉為氮源時,單體積發(fā)酵液抑菌直徑提高了23.1%。朱宏建等[25]發(fā)現(xiàn)的放線菌菌株ND045在碳源為蔗糖、氮源為大豆粉時,菌株發(fā)酵濾液對辣椒尖孢炭疽病菌(Colletotrichum acutata)的抑菌率為35.2%。另外,發(fā)酵時間對放線菌FS-4產(chǎn)抑菌物質(zhì)也會產(chǎn)生影響。在本研究中,由圖8可知24 h的發(fā)酵液里已有抑菌物質(zhì),當發(fā)酵48 h后,抑菌圈直徑不再增加,說明放線菌FS-4基本停止產(chǎn)生抑菌物質(zhì)或者抑菌物質(zhì)的活性下降。
發(fā)酵工藝中的每一步、每個環(huán)節(jié)都至關(guān)重要。傳統(tǒng)的正交試驗設(shè)計、全因子試驗設(shè)計等手段優(yōu)化微生物發(fā)酵工藝,實驗工作量較大,結(jié)果也不全面。而響應(yīng)面法能很好地對影響發(fā)酵工藝過程中的培養(yǎng)基、培養(yǎng)條件等進行優(yōu)化和評價[26]。本研究采用響應(yīng)面實驗進行發(fā)酵條件的優(yōu)化,與優(yōu)化前相比,菌株FS-4抑菌直徑增加了26.1%。不同發(fā)酵條件對菌株發(fā)酵液抑菌活性有一定影響。本研究得到菌株FS-4最優(yōu)發(fā)酵條件為:蛋白胨0.5%,蔗糖2.4%,時間62 h,發(fā)酵溫度28?℃,發(fā)酵pH為7,磷酸氫二鉀、氯化鈉和硫酸鎂為0.05%。這與莫坤聯(lián)[27]從抗香蕉枯萎病菌放線菌BWL58及BWL15-4菌株的最優(yōu)發(fā)酵條件存在一定差異,其原因可能是不同菌株對于發(fā)酵過程中各理化因素需求不同的表現(xiàn),也可能是生理代謝途徑因菌種差異的體現(xiàn)。
微生物發(fā)酵是個動態(tài)的生物學(xué)過程,培養(yǎng)基中各養(yǎng)分含量、pH、容氧量和產(chǎn)物量一直處于不斷變化,不同因素的變化會對發(fā)酵產(chǎn)物的種類和產(chǎn)量均有較大的影響[27]。本研究僅考慮了發(fā)酵前的培養(yǎng)基狀態(tài)和培養(yǎng)條件,未對發(fā)酵過程各因素進行動態(tài)監(jiān)控,在后續(xù)的研究中,應(yīng)采用生物化學(xué)分子生物學(xué)等方法對目標菌株的代謝動態(tài)過程進行深入研究,探討培養(yǎng)基的各養(yǎng)分含量與目標活性物質(zhì)產(chǎn)量及培養(yǎng)條件之間的關(guān)系,進而提高目標活性物質(zhì)的產(chǎn)率。
參考文獻
Shen Z, Ruan Y, Chao X, et al. Rhizosphere microbial community manipulated by 2 years of consecutive biofertilizer application associated with banana Fusarium wilt disease suppression[J]. Biology and Fertility of Soils, 2015, 51(5): 553-562.
Guo L, Yang L, Liang C, et al. The G-protein subunits FGA2 and FGB1 play distinct roles in development and pathogenicity in the banana fungal pathogen Fusarium oxysporum f. sp cubense[J]. Physiological and Molecular Plant Pathology, 2016, 93: 29-38.
段雅婕, 陳晶晶, 周登博, 等. 豆粕有機質(zhì)發(fā)酵液中香蕉枯萎病拮抗菌的篩選與鑒定[J]. 江蘇農(nóng)業(yè)科學(xué), 2015, 43(12): 168-171.
柯春亮, 陳宇豐, 周登博, 等. 香蕉根際土壤解磷細菌的篩選、鑒定及解磷能力[J]. 微生物學(xué)通報, 2015, 42(6): 1032-1042.
袁輝林, 康麗華, 馬海濱. 響應(yīng)曲面法及其在微生物發(fā)酵工藝優(yōu)化中的應(yīng)用[J]. 安徽農(nóng)業(yè)科學(xué), 2011, 39(16): 9498-9500, 9502.
王小琴, 龔? 斌, 朱薇玲, 等. 放線菌327#的發(fā)酵培養(yǎng)基篩選及培養(yǎng)條件優(yōu)化[J]. 中國釀造, 2010(10): 47-50.
段雅婕, 龐振才, 陳晶晶, 等. 二氧化氯對土壤中香蕉枯萎病的防治效果初探[J].中國南方果樹, 2015, 44(6): 74-77, 81.
牛世全, 耿? 暉, 閻薇如, 等. 黃芪根腐病生防放線菌篩選鑒定及其優(yōu)化培養(yǎng)[J]. 植物保護學(xué)報, 2016, 43(6): 943-950.
田雪蓮, 尹顯慧, 龍友華, 等. 獼猴桃潰瘍病菌拮抗菌篩選、鑒定及發(fā)酵條件優(yōu)化[J]. 食品科學(xué), 2017, 38(16): 79-85.
馮沛仙, 張仁文, 夏占峰, 等. 響應(yīng)面法優(yōu)化易變鏈霉菌Streptomyces mutabilis TRM45540產(chǎn)放線菌素D的發(fā)酵條件[J]. 中國抗生素雜志, 2016, 41(6): 435-440.
梁金鐘, 王翼雪, 梅劍秋. 植物乳桿菌富硒培養(yǎng)條件的優(yōu)化[J]. 食品工業(yè)科技, 2017, 38(3): 137-142.
Shakeel Q, Lyu A, Zhang J, et al. Optimization of the cultural medium and conditions for production of antifungal substances by Streptomyces platensis 3-10 and evaluation of its efficacy in suppression of clubroot disease (Plasmodiophora brassicae) of oilseed rape[J]. Biological Control, 2016, 101: 59-68.
Zhao Z Y, Ma S S, Li A, et al. Effects of trophic modes, carbon sources, and salinity on the cell growth and lipid accumulation of tropic ocean oilgae strain Desmodesmus sp. WC08[J]. Applied Biochemistry and Biotechnology, 2016, 180(3): 452-463.
Bi F, Ment D. Luria N, et al. Mutation of AREA affects growth, sporulation, nitrogen regulation, and pathogenicity in Colletorichum gloeosporioides[J]. Fungal Genetics and Biology, 2017, 99: 29-39.
石懷興. 枯草芽孢桿菌G8發(fā)酵條件的優(yōu)化、抗菌物質(zhì)的部分特性分析及分離純化[D]. 濟南: 山東農(nóng)業(yè)大學(xué), 2009.
陳美花, 程雪冰, 黃? 海, 等. 乳清分離蛋白對鮮榨黃冠梨汁澄清效果的研究[J]. 食品工業(yè)科技, 2017, 38(3): 186-191.
馬新輝, 李镕廷, 趙曉涵, 等. 雙水相體系萃取藍莓多糖的分配平衡研究[J]. 食品工業(yè)科技, 2017, 38(3): 211-214, 220.
張莉力, 許云賀, 肖海蒂, 等. 地衣芽孢桿菌BL-5產(chǎn)孢發(fā)酵條件優(yōu)化[J]. 食品工業(yè)科技, 2017, 38(3): 150-155.
Shen Z, Ruan Y, Chao X, et al. Rhizosphere microbial community manipulated by 2 years of consecutive biofertilizer application associated with banana Fusarium wilt disease suppression[J]. Biology and Fertility of Soils, 2015, 51(5): 553-562.
Karangwa P, Blomme G, Beed F, et al. The distribution and incidence of banana Fusarium wilt in subsistence farming systems in east and central Africa[J]. Crop Protection, 2016, 84: 132-140.
Sharma P, Kalita M C, Thakur D. Broad spectrum antimicrobial activity of forest-derived soil Actinomycete, Nocardia sp PB-52[J]. Front Microbiology, 2016, 7: 347.
Gurovic MSV, Olivera NL. Antibacterial producing actinomycetes from Extra Andean Patagonia[J]. Journal of Arid Environments, 2017, 144: 216-219.
王? 彥, 牛世全, 鄭豆豆, 等.黃瓜枯萎病拮抗放線菌的篩選、鑒定及發(fā)酵條件優(yōu)化[J]. 微生物學(xué)通報, 2019, 46(5): 1062-1073.
程沁園, 葉? 亮, 邢瑩瑩, 等. 海洋放線菌WB-F5 發(fā)酵條件的優(yōu)化及抑菌活性產(chǎn)物性質(zhì)的初步研究[J]. 中國天然藥物, 2007, 5(2): 142-145.
朱宏建, 歐陽小燕, 周? 倩, 等. 一株辣椒尖孢炭疽病菌拮抗菌株的分離鑒定與發(fā)酵條件優(yōu)化[J]. 植物病理學(xué)報, 2012, 42(4): 418-424.
袁輝林, 康麗華, 馬海濱. 響應(yīng)曲面法及其在微生物發(fā)酵工藝優(yōu)化中的應(yīng)用[J]. 安徽農(nóng)業(yè)科學(xué), 2011, 39(16): 9498-9500, 9502.
莫坤聯(lián). 抗香蕉枯萎病菌鏈霉菌菌劑制備及其防效測定[D]. 海口: 海南大學(xué), 2012.

