帕瑞昔布鈉對神經病理性疼痛大鼠脊髓背角膠質纖維酸性蛋白及脊髓炎性反應的影響
劉少星,謝先豐,曹德鈞
(成都市第二人民醫院麻醉科,四川成都 610017)
神經病理性疼痛是以痛覺過敏、自發性疼痛為特征的疼痛類型,神經免疫系統紊亂、炎癥介質異常分泌所引起的外周敏化和中樞敏化是造成神經病理性疼痛的關鍵環節,該過程也被稱為“神經源性炎癥”[1]。脊髓背角星形膠質細胞在外周神經損傷過程中過度活化并釋放炎性細胞因子是病理性疼痛發生發展過程中重要的因素之一,而環氧合酶-2(COX-2)作為介導神經炎性反應的關鍵酶參與神經病理性疼痛的重要發生發展過程[2-3]。帕瑞昔布鈉是一種靜脈用高選擇性COX-2抑制劑,廣泛應用于手術患者的超前鎮痛和術后疼痛治療。本研究擬建立大鼠坐骨神經結扎的經典神經病理性疼痛模型(CCI),觀察帕瑞昔布鈉靜脈注射對大鼠熱痛閾、機械痛閾及脊髓背角膠質纖維酸性蛋白(glial fibrillary acid protein,GFAP)表達、脊髓中COX-2 及脊髓炎性細胞因子IL-1β 及TNF-α 含量的影響,探討帕瑞昔布鈉靜脈給藥對神經病理性疼痛大鼠的影響及機制,為帕瑞昔布鈉在神經病理性疼痛方面的臨床應用提供參考。
1 材料與方法
1.1 實驗動物選擇及分組
健康成年雄性SD 大鼠42 只,體重250~300 g,8~10 周齡,由四川大學華西醫學麻醉與危重病實驗中心提供,采用隨機數字表法分為3 組(n=14):假手術組(S 組)、神經病理性痛組(CCI 組)、帕瑞昔布鈉組(P 組)。
1.2 大鼠神經病理性疼痛模型制備
參照文獻[4],采用坐骨神經慢性結扎損傷法(CCI)制作大鼠神經病理性疼痛模型,腹腔注射10%水合氯醛300 mg/kg 麻醉,待翻正反射消失后,俯臥位固定,右后肢備皮消毒,于大腿中部外緣切開皮膚,鈍性分離肌肉,游離坐骨神經主干長約7 mm,用4-0 鉻制腸線于坐骨神經主干分別結扎4 道結扎環,環間間隔約1 mm,結扎強度以引起小腿肌肉輕度顛動為宜,絲線逐層縫合肌肉及皮膚;S 組僅游離出坐骨神經主干不結扎,P 組在皮膚縫合結束后即刻經鼠尾靜脈注射帕瑞昔布鈉10 mg/kg(批號85820004,Pfizer 公司,美國),連續3 d。術畢將大鼠放入鼠籠,于溫暖、安靜環境自由單籠喂養。S 組、CCI 組在相同時點經尾靜脈注射等容量的生理鹽水。模型制備由同一人完成,術中烤燈照射維持直腸溫度約37℃。
1.3 機械痛閾和熱痛閾的測定
分別于術前1 d、術后4 d、7 d、14 d 時測定機械痛閾和熱痛閾。機械痛閾測定:在安靜的環境中,將大鼠置于金屬網格籠子中,待大鼠安靜且足底伸展適中后,用Electronic von Frey 觸覺測痛儀(2392 型)垂直刺激大鼠右足底中部并記錄大鼠出現抬足、躲避、舔足等動作時的刺激力度;每只大鼠重復測量5 次,每次間隔大于10 s,取平均值作為機械痛閾。熱痛閾測定:在安靜的環境中,將大鼠放入厚度為6 mm 的透明有機玻璃箱內,待大鼠安靜且足底伸展適中后。用Series8 型熱測痛儀照射大鼠右后足底中部,待大鼠產生快速縮足、揚足或舔足后停止照射,記錄照射時間;每只大鼠重復測量5 次,每次測量間隔5 min。取平均值作為熱痛閾。
1.4 脊髓背角膠質纖維酸性蛋白(GFAP)表達的測定
于術后14 d 在測定機械痛閾和熱痛閾后1 h,各組隨機取7 只大鼠,腹腔注射10%水合氯醛300 mg/kg 麻醉,斷頭處死大鼠,于冰皿上分離取L4-6脊髓節段置于4%多聚甲醛溶液中固定24 h 后石蠟包埋、切片,組織切片脫蠟脫水,免疫組化SP 法檢測GFAP,DAB 顯色,免疫組化試劑盒及DAB顯色試劑盒均購于武漢博士德生物技術公司。由另一觀察者在不知分組情況下每只動物選取5 張切片在400 倍視野下隨機選取右側脊髓背角內不重疊的5 個視野,計數視野中GFAP 陽性細胞數,以平均值表示GFAP 表達值。
1.5 脊髓COX-2、IL-1β、TNF-α 含量的測定
各組中剩余7 只大鼠麻醉,腹腔注射10%水合氯醛300 mg/kg 麻醉,處死大鼠,于冰皿上分離取L4-6 脊髓節段,稱重后按1:9 比例加入冷PBS液,制成10%脊髓組織勻漿,4℃下3 000 r/min 離心20 min 收集上清液。采用ELISA 法測定COX-2、IL-1β 及TNF-α 含量,嚴格按照試劑盒(R&D 公司,美國)說明書要求進行操作。
1.6 統計學處理
采用SPSS 19.0 統計軟件進行統計分析,計量資料以均數±標準差()表示,組間比較采用單因素方差分析,組內比較采用重復測量方差分析,P<0.05 為差異有統計學意義。
2 結果
2.1 熱痛閾、機械痛閾的改變
術前1 d 時各組大鼠熱痛閾、機械痛閾無統計學差異(P >0.05);與S 組比較,CCI 組和P 組術后4 d、7 d、14 d 時熱痛閾、機械痛閾明顯降低(P<0.05),與CCI 組比較,P 組術后4 d、7 d、14 d 時熱痛閾、機械痛閾明顯升高(P<0.05)見表1。
2.2 脊髓背角GFAP 及脊髓中COX-2、IL-1β、TNF-α 的改變
S 組大鼠術后14d 時右側脊髓背角GFAP 陽性細胞表達數少,形態正常,分支少;與S 組比較,CCI 組大鼠術后14d 右側脊髓背角GFAP 陽性細胞表達數明顯增多(P<0.05),體積增大,分支增多,較多突起斷裂,脊髓中COX-2、IL-1β 及TNF-α 含量升高(P<0.05)。與CCI 組比較,P組大鼠術后14d 右側脊髓背角GFAP 陽性細胞表達數明顯減少(P<0.05),體積減小,突起及分支減少,脊髓中COX-2、IL-1β 及TNF-α 含量降低(P<0.05),見表2、圖1。
表1 4 組大鼠不同時點痛閾的比較[n=14,()]Tab.1 Comparison of pain threshold at different time points among the 3 groups [n=14,()]
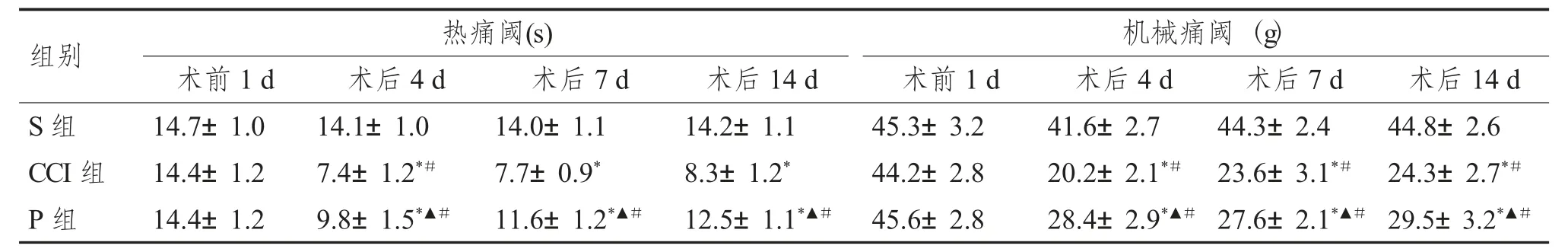
表1 4 組大鼠不同時點痛閾的比較[n=14,()]Tab.1 Comparison of pain threshold at different time points among the 3 groups [n=14,()]
與S 組比較,*P<0.05;與CCI 組比較,▲P<0.05;與術前1 d 比較,#P<0.05。
表2 術后14 d 各組大鼠脊髓GFAP、COX-2、IL-1β 及TNF-α 的比較[n=7,()]Tab.2 Comparison of GFAP,COX-2,IL-1β and TNF-α in the spinal cord of rats in each group at 14 days after operation [n=7,()]

表2 術后14 d 各組大鼠脊髓GFAP、COX-2、IL-1β 及TNF-α 的比較[n=7,()]Tab.2 Comparison of GFAP,COX-2,IL-1β and TNF-α in the spinal cord of rats in each group at 14 days after operation [n=7,()]
與S 組比較,*P<0.05;與CCI 組比較,▲P<0.05。
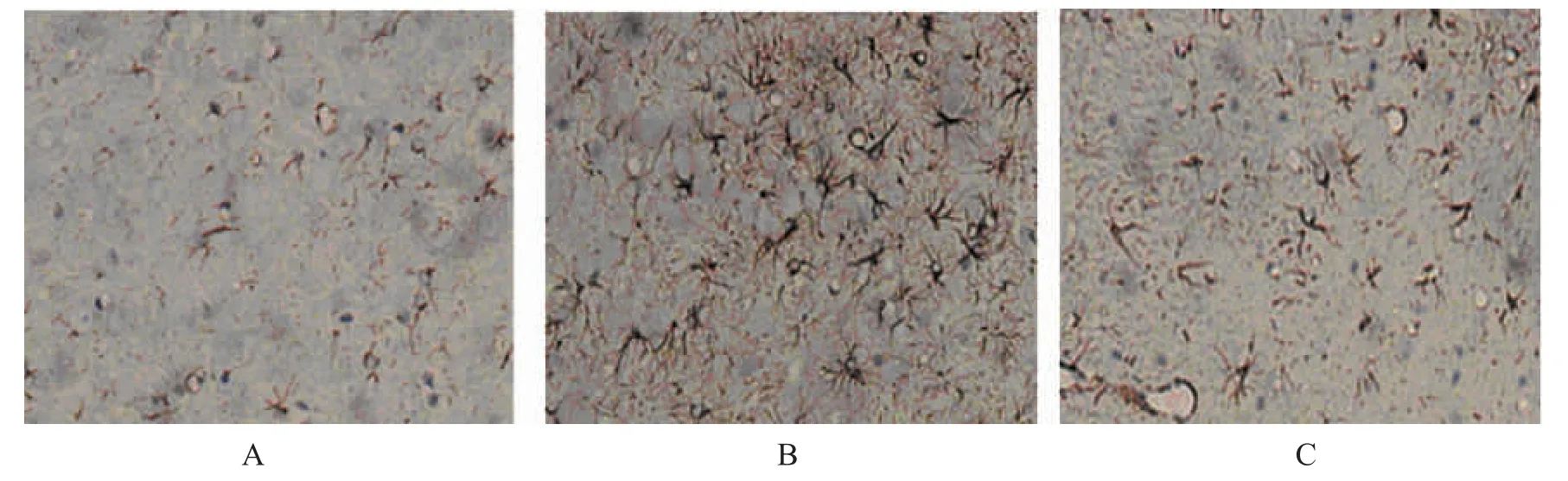
圖1 術后14 d 時各組大鼠脊髓背角GFAP 對比(×40)Fig.1 Comparison of GFAP in rats spinal dorsal horn in each group at 14 days after operation(×40)
3 討論
本研究參考文獻[4]采用結扎坐骨神經干的方法制備大鼠神經病理性疼痛模型。本研究結果表明,CCI 組和P 組大鼠在術后均出現右后爪內收畸形,后肢保護等表現;與S 組比較,CCI 組和P 組大鼠在術后各時術后4 d、7 d、14 d 均出現熱痛閾、機械痛閾明顯降低,提示模型制備成功。
本研究參照文獻[5]采用經鼠尾靜脈注射帕瑞昔布鈉劑量10 mg/kg,結合臨床使用帕瑞昔布鈉用于術后鎮痛用藥時間通常不超過3 d,選擇術后連續3 d,并于術后第4 天、7 天、14 天檢查各指標。本研究結果顯示,與CCI 組比較,P 組術后4 d、7 d、14 d 機械痛閾和熱痛閾升高,提示帕瑞昔布鈉10 mg/kg 靜脈注射可減輕大鼠神經病理性疼痛。
星形膠質細胞是中樞神經系統中數量最多的膠質細胞系成員,主要為神經細胞提供營養和支撐,并具有調節離子平衡和神經遞質、維持血腦屏障穩定等重要作用[6,7]。周圍神經及腰脊神經結扎、脊髓創傷等可引起星形膠質細胞激活而進入活化狀態,發生增生、肥大并進入增殖狀態,形成反應性星形膠質細胞增生;過度活化的星形膠質細胞可分泌活性氧、前列腺素、氧化亞氮、神經生長因子等神經活性物質及多種炎性因子,使神經細胞處于敏化狀態[8]。GFAP 是星形膠質細胞的特異性蛋白和骨架標記物,是星形膠質細胞成熟的標志[9]。Liu 等[10]研究發現神經病理性痛大鼠模型制備成功后24~48 h,外周神經結扎側脊髓背角星形膠質細胞開始被激活,GFAP 表達增加,第14 天時最明顯且其激活程度與觸誘發痛正相關,因此本研究在模型制備后14 d 檢測脊髓中GFAP、COX-2 和炎癥因子TNF-α、IL-1β 含量。在大鼠CCI 模型中,外周神經損傷后脊髓背角星形膠質細胞被激活后發生細胞形態、功能改變,星形膠質細胞突觸后的樹突中COX-2mRNA 與蛋白水平迅速升高,釋放神經毒性物質如IL-1β、TNF-α、IL-6、氧自由基、谷氨酸、P 物質等參與中樞敏化引發疼痛[11-13]。過度表達的炎癥因子TNF-α、IL-β 又可以促進星形膠質細胞活化[14-16]。抑制星形膠質細胞功能可以明顯減輕痛覺過敏現象[17-18]。COX-2 是花生四烯酸代謝途徑限速酶之一,有研究表明TNF-α、IL-β 可通過環氧合酶通路參與脊髓水平的傷害信息的傳遞和加工使脊髓中傷害感受過程易化,促進炎性反應,參與中樞敏化[19-20]。本研究結果表明,S 組術后14 d 時大鼠脊髓背角GFAP 陽性細胞表達數少,形態正常,分支少;與S 組比較,CCI 組術后14d 時GFAP 陽性細胞表達數明顯增多,體積增大,分支增多,可見較多突起斷裂,脊髓中COX-2、IL-1β 及TNF-α含量升高;與CCI 組比較:P 組術后14d 時GFAP陽性細胞表達數明顯減少,體積減小,突起及分支減少,脊髓中COX-2、IL-1β 及TNF-α 含量降低。提示帕瑞昔布鈉10mg/kg 靜脈注射減輕神經病理性疼痛的機制與抑制脊髓背角星形膠質細胞過度活化釋放COX-2,抑制炎癥細胞因子IL-1β、TNF-α 表達有關。
綜上所述,帕瑞昔布鈉靜脈注射可通過抑制脊髓背角星形膠質細胞過度活化,降低脊髓中COX-2、IL-1β 及TNF-α 含量,減輕脊髓炎性反應,減輕大鼠神經病理性疼痛。

