基于ELN的食品藥品檢驗體系數據完整性的研究
徐建昊 潘紅 胡文彥

【摘?要】隨著LIMS系統的建設與應用,實驗室積累了大量信息數據資源,利用該項資源提高檢驗數據完整性,進一步提升檢驗質量,是LIMS系統下一步發展的重點。本文利用ELN對檢驗數據完整性做了部分嘗試,有效提高了數據標準化和規范化。為解決數據完整性問題提供參考和借鑒。
【關鍵詞】食品藥品檢;LIMS;數據完整性
隨著實驗室信息化程度的提高,對電子檢驗記錄數據完整性的要求也越來越多的受到各個實驗室的重視。數據完整性要求是指,數據在完整周期內的都符合完全性、一致性和準確性的要求。數據完整性要求是為了杜絕檢驗過程中隨意編輯數據、不合理的丟棄數據甚至偽造數據。在全世界各國日益重視數據完整性的今天,幾乎所有國家的企業都被查出過數據完整性問題。以FDA的飛行檢查為例,2012年至2016年4年內,共發出910封警告信。其中印度、中國收到的警告信較多[1]。
南京食藥檢院做為政府法定實驗室,既承擔檢測結論復核的重任,也承擔著指導食藥企業提高檢驗質量的責任。為此,我院利用LIMS信息系統,配合網絡版儀器工作站,建立符合電子數據完整性的質量體系,為提高數據完整性做了有益的嘗試。
一、數據完整性的要求
數據完整性,核心要求為各種產生的數據在其生命周期內保持準確、完整和持續。即從原始數據的產生、記錄、轉移、分析、使用、保存、歸檔,直到銷毀都有跡可循[2]。
根據這個要求,各國對數據完整性做出了相適應的法律法規。1997年,FDA首次頒布了21 CFR 11,對電子實驗記錄和電子簽名的使用做出了規定。2015年,英國藥監部門MHRA頒布了GMP數據完整性行業指南。同年9月,WHO頒布了《數據與記錄管理規范指南》草案。我國在2016年由SFDA發布了《藥品數據管理規范》,系統規定了數據完整性的有關概念,并對數據的產生、轉移、使用、備份等各個環節提出了基本要求[3]。
二、數據完整性的原則
雖然各個國家都出臺了相關的法律法規,但對數據完整性的整體原則和監管要求試一致的。即數據需滿足ALCOA原則。該原則從5個維度對數據做出了詳細規定[4]。
三、應對方案
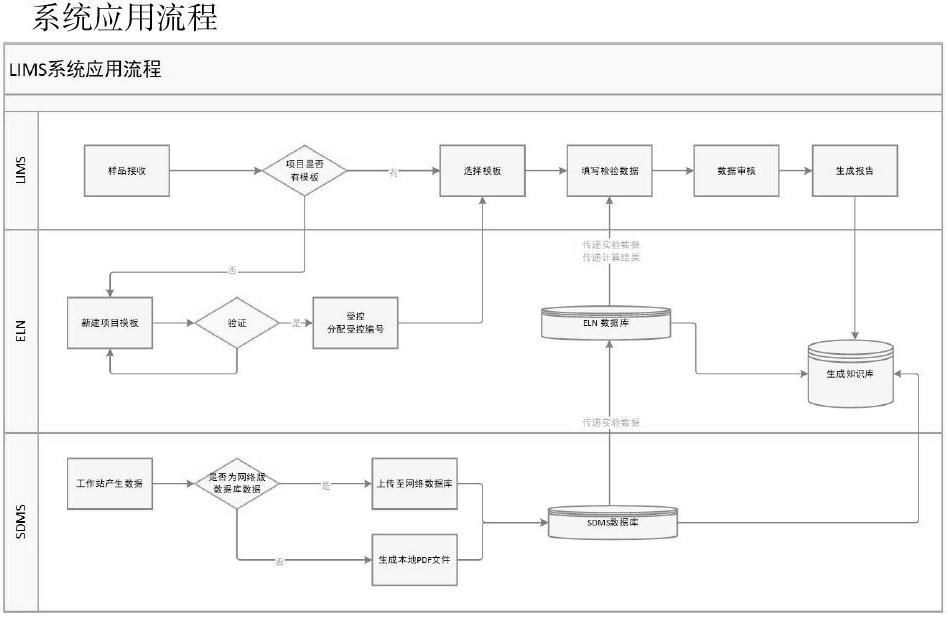
我院通過建立LIMS系統,利用ELN(電子實驗記錄本)模塊及SDMS(科學數據管理)模塊,可實現檢驗業務全周期管理。具體為實現業務流程標準化、檢驗試劑試藥管理精細化、實驗數據全局化等,幫助檢驗人員提高檢驗質量,滿足檢驗體系數據完整性要求。
四、應用效果
1、有效提高實驗記錄的標準化和規范化
我院一直采用的紙質實驗原始記錄具有保存難度大、丟失難發現、查詢不便捷、規范難統一、維護成本高等缺點。通過上線LIMS系統,利用ELN和SDMS模塊,已實現規范、標準的電子實驗原始記錄,電子記錄的特點是記錄詳細準確規范,數據結構清晰,保存查詢調用便捷,計算結論無需人工介入。
2、建立數據生命周期管理,提高數據的完整性
數據完整性是對數據整個生命周期的管理要求,要求對數據的產生、修改、轉移、使用、存儲都有完整的記錄。對于產生數據的儀器工作站進行網絡版升級,將實驗過程和實驗數據全部傳輸到服務器統一保存。不能升級到網絡版工作站的儀器安裝數據采集工具,將產生的圖譜自動轉移到服務器保存待用。ELN模塊開啟審計追蹤功能,對于數據的新增、刪除、修改都有完整記錄。模板中的計算公式通過多級審核,最終由質保存檔并下發受控編號。利用LIMS可以做到數據穿透,一個樣品的取樣記錄、天平使用記錄、儀器實驗記錄、標準物質記錄等可以完整的展現出來。隨著LIMS/ELN系統的的應用,各類型數據不再是孤立的點。之前由于缺少全流程管理的實驗記錄,對于數據的審核和管理缺少全面性。限制則可以快速識別實驗室系統可能存在的數據完整性風險并及時糾正。
3、實現符合規范的數據保存備份
通過對儀器數據、實驗數據、文檔數據、檢驗樣品數據的分析,將各種數據分類,制定差異化的備份策略。對檢驗過程數據采取每日全量備份方式,保障數據安全。對儀器產生的實驗數據,采取每周全量,每日增量的方式備份。對已完成的數據,采取異介質備份,即方便存檔,又節約了實時存儲空間。
五、結語
截至目前,我院LIMS系統已正式上線運行一年,系統的應用有效提高了我院檢驗工作效率和準確性,同時為管理層提供了決策支持。該系統不僅僅是檢驗工作的工具或平臺,更重要的是帶來了檢驗工作模式的改變,讓檢驗更符合數據完整性要求,為推動數字化檢驗改革邁出堅實的一步。
參考文獻:
[1]周清萍,周娜,梁毅. 關于數據管理和數據完整性的藥品cGMP警告信分析[J]. 化工與醫藥工程,2020,41(1):62-68.
[2]哈玲玲,張中湖,姜廣苓,等. 食品藥品檢驗檢測信息化建設發展現_省略__以山東省食品藥品檢驗研究院為例_哈玲玲[J]. 藥學研究,2019,38(2):120-124.
[3]張偉男. 原料藥生產企業的數據完整性管理探討_張偉男[J]. 化工與醫藥工程,2019,40(6):62-66.
[4]許赫雷,李紅,吳純啟,等. 藥物非臨床安全性評價數據完整性的管理現狀及探討_許赫雷[J]. 中國藥理學與毒理學雜志,2018,32(12):973-978.
(作者單位:南京市食品藥品監督檢驗院)

