TLR4和IL-5在兒童嗜酸性粒細胞性結腸炎的表達及作用機制研究 ???
謝靜 熊莉婭 耿嵐嵐 楊敏 陳佩瑜 王洪麗 龔四堂

【摘要】目的 檢測Toll樣受體4(TLR4)和IL-5在兒童嗜酸性粒細胞性結腸炎(EC)的表達水平及相關性,探討TLR4在兒童EC發病過程中的作用機制。方法 收集EC患兒的結腸黏膜標本,共28例,同期收集腸黏膜正常對照組25例。分析2組患兒的臨床資料,采用免疫組織化學法檢測其結腸黏膜中TLR4、IL-5表達情況并對結果進行分析。結果 EC組患兒主要表現為血便、腹瀉,大多患兒內鏡下見結腸黏膜充血、水腫、小結節增生、糜爛和阿弗它潰瘍,8例患兒內鏡下結腸黏膜正常;黏膜病理提示黏膜下有大量嗜酸性粒細胞浸潤,均≥20個/高倍鏡視野。對照組患兒主要表現為腹痛,內鏡下示全結腸黏膜正常,黏膜病理示未見明顯病理改變。與對照組比較,EC組結腸黏膜TLR4水平降低(Z = -4.448,P < 0.05),結腸黏膜IL-5表達水平增高(Z = -7.015,P < 0.05)。TLR4、IL-5表達水平呈負相關(r = -0.5325,P < 0.05)。結論 機體受到過敏原、毒素等刺激時,腸道TLR4不能反應性增高可能是EC發病機制之一。EC患兒腸組織TLR4表達明顯下降,而IL-5明顯升高,其機制可能是通過調節輔助性T淋巴細胞(Th)1/Th2平衡,使EC患兒傾向于Th2表型應答,釋放大量IL-5細胞因子,參與EC的發生。
【關鍵詞】嗜酸性粒細胞性結腸炎; Toll樣受體4; 白介素-5
【Abstract】Objective To measure the expression levels of Toll-like receptor 4 (TLR4) and interleukin 5(IL-5) in the colonic mucosa of children with eosinophilic colitis(EC) and analyze their correlation, aiming to explore the mechanism of TLR4 in the pathogenesis of pediatric EC. Methods The colonic mucosal specimens were collected from 28 children diagnosed with EC and 25 healthy controls. Clinical data of all children were retrospective analyzed. The expression levels of TLR4 and IL-5 in the colonic mucosa were detected by immunohistochemistry and the results were analyzed. Results Clinical manifestations of EC children mainly included bloody stools and diarrhea. Colonic mucosal congestion, edema, small nodular hyperplasia, patchy erosion and Aphtha ulcer were observed under endoscope in most EC children. Normal colonic mucosa was noted under endoscope in 8 EC cases. Mucosal biopsy of all cases in the EC group showed a large quantity of eosinophil infiltration (≥20/HPF). All cases in the control group had abdominal pain and the whole colon specimens were normal and no significant pathological changes were observed. Compared with the control group, the TLR4 level in the colonic mucosa was significantly down-regulated (Z = -4.448, P < 0.05), whereas the expression level of IL-5 was significantly up-regulated in the EC group (Z = -7.015, P < 0.05). The expression level of TLR4 was negatively correlated with that of IL-5 (r = -0.532, P < 0.05). Conclusions When the body is stimulated by allergens and toxins, etc., the inability of TLR4 to respond to gastrointestinal tract may be one of the pathogenesis of EC. The expression of TLR4 in the intestinal tissues of EC children is significantly down-regulated, whereas that of IL-5 is remarkably up-regulated, suggesting that the mechanism is probably that by regulating the Th1/Th2 balance, EC children tend to respond to Th2 phenotype, release a large quantity of IL-5 cytokines, and participate in the incidence of EC.
【Key words】Eosinophilic colitis;Toll-like receptor 4;Interleukin 5
嗜酸性胃腸道疾病(EGID)包括嗜酸性粒細胞性食管炎、胃腸炎、結腸炎,是胃腸道組織中嗜酸性粒細胞(EOS)異常浸潤導致的消化系統疾病,臨床表現多樣化,兒童少見。近年來隨著兒童胃腸鏡的廣泛開展,該病也引起了臨床醫師關注。目前EGID發病機制尚不明確,研究認為EGID是輔助性T淋巴細胞(Th)2介導的過敏反應,Th2的優勢應答導致IL-5、Eotaxin釋放增多,IL-5是EOS分化和增殖的關鍵細胞因子,Eotaxin促進成熟EOS向腸道聚集,這可能是EOS異常浸潤和炎癥發生的基礎[1]。而Toll樣受體4(TLR4)通過樹突細胞分泌IL-12、Ⅰ型干擾素,使Th0偏向Thl細胞分化以調節Th1/Th2的平衡[2]。因此,本文通過研究嗜酸性粒細胞性結腸炎(EC)患兒結腸黏膜中TLR4和IL-5的表達,來探討TRL4在EC發病中的作用機制。
對象與方法
一、研究對象
收集2011年2月至2013年4月在我院消化科確診為EC的患兒其結腸黏膜,共28例,診斷標準為Talley標準[3]。包括:①反復出現的腹痛、腹瀉、嘔吐等消化道癥狀;②病理證實結腸黏膜組織檢查有1個或1個以上部位EOS浸潤[≥20個/高倍鏡視野(HPF)];③無其它引起EOS增多的疾病,包括寄生蟲感染、炎癥性腸病、結締組織病、藥物過敏、高EOS綜合征、變異性哮喘及腫瘤等。同期收集結腸黏膜正常對照組25例,對照組患兒均按照羅馬Ⅲ診斷標準診斷為功能性腹痛,均經過腸鏡檢查,鏡下及活組織病理檢查未見異常[4]。受試者家屬均知情同意,并經醫院學術倫理委員會討論通過。
二、研究方法
1. 臨床資料分析
回顧性對所有患兒的臨床資料進行分析,包括年齡、性別、臨床表現、實驗室檢查、結腸鏡及黏膜病理檢查。
2.結腸黏膜標本的收集及處理
行纖維結腸鏡時用活檢鉗取出患兒結腸黏膜后迅速固定于10%甲醛溶液中,送我院病理科進行常規石蠟包塊,連續作厚5 μm的切片3張,60℃烤箱過夜,室溫下保存備用。
3.采用免疫組織化學(組化)法檢測患兒結腸黏膜中TLR4、IL-5表達
切片脫蠟至水,檸檬酸抗原修復,3%過氧化氫去離子水消化,滴加一抗(TLR4、IL-5,Bioworld, USA,工作濃度1∶00),4℃過夜,PBS浸洗后,滴加二抗,DAB顯色,經蘇木素復染,鹽酸酒精溶液分化,封片。用PBS代替一抗作陰性對照。
4.結果判讀
參照文獻[5],由2名病理醫生單獨判斷免疫組化結果。顯微鏡下觀察細胞質或細胞膜呈黃色、棕黃色或棕褐色為陽性。染色強度評分:按細胞顯示深淺記分,分為4級,0分為無色,1分為淡黃色,2分為棕黃色,3分為棕褐色。陽性細胞面積評分:按陽性細胞所占面積分為4級,0分為陰性,1分為陽性細胞≤1/3,2分為1/3 ~ 2/3,3分為 > 2/3。陽性表達水平采用染色強度評分×陽性細胞面積評分的積分表示,積分為0判斷為0分,積分為1 ~ 2判斷為1分,積分為3 ~ 4判斷為2分,積分為6 ~ 9判斷為3分。
三、統計學處理
采用SPSS 13.0進行分析,定性資料用例(%)表示,其中無序分類資料組間比較用Fisher確切概率法,等級資料組間比較用秩和檢驗。2個連續型變量相關性采用Pearson相關分析。P < 0.05表示差異有統計學意義。
結果
一、EC組和對照組的臨床表現比較
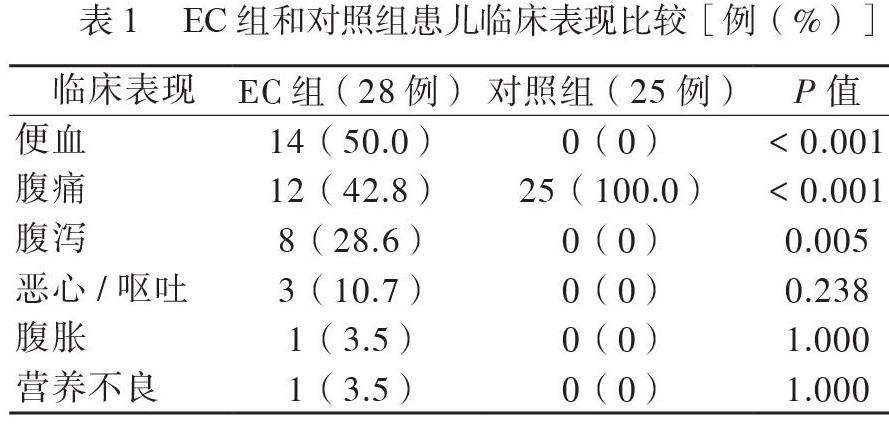
EC組28例,男20例、女8例,年齡(5.1±2.8)歲,便血14例(50%),主要為黏液血絲便,不同程度的腹痛12例(42.8%),腹瀉8例(28.6%),惡心、嘔吐3例(10.7%),腹脹1例(3.5%),營養不良1例(3.5%)。對照組25例,男18例、女7例,年齡(5.3±2.7)歲,均表現為腹痛,主要為臍周痛或中上腹痛。與對照組相比,EC組患兒便血、腹瀉的比例升高,差異有統計學意義(P均< 0.05),以腹痛為主要癥狀的EC患者比例較低,差異亦有統計學意義(P < 0.05),見表1。
二、EC組和對照組實驗室檢查結果比較
EC組EOS增高者5例,4例患兒血紅蛋白降低,8例患兒大便潛血試驗陽性,所有患兒大便寄生蟲檢測均陰性,1例患兒血白蛋白降低,7例血清總IgE增高,8例患兒食物過敏原 IgE 檢測陽性,提示主要對牛奶、雞蛋、 大豆、鱈魚、螃蟹過敏。對照組血常規、糞便常規、總IgE、食物過敏原IgE、肝腎功能均正常。與對照組相比,EC患兒血清總IgE增高、食物過敏源IgE檢測陽性、大便潛血試驗陽性比例均較高(P < 0.05),見表2。
三、EC組和對照組內鏡和病理檢查結果比較
對照組25例患兒內鏡下示全結腸黏膜光滑,黏膜下血管紋理清晰,未見糜爛、潰瘍及腫物等病變。黏膜病理示未見明顯病理改變,見圖1A。EC組患兒20例結腸黏膜充血、水腫,血管網紋理模糊,其中7例可見散在小結節樣增生;4例結腸黏膜有散在點片狀的糜爛和阿弗它樣潰瘍;3例可見散在小濾泡(見圖1B、C)。8例患兒結腸黏膜正常。EC組病理活檢提示黏膜下有大量EOS浸潤,均 ≥20個/HPF,見圖2。
四、EC組和對照組TLR4水平比較
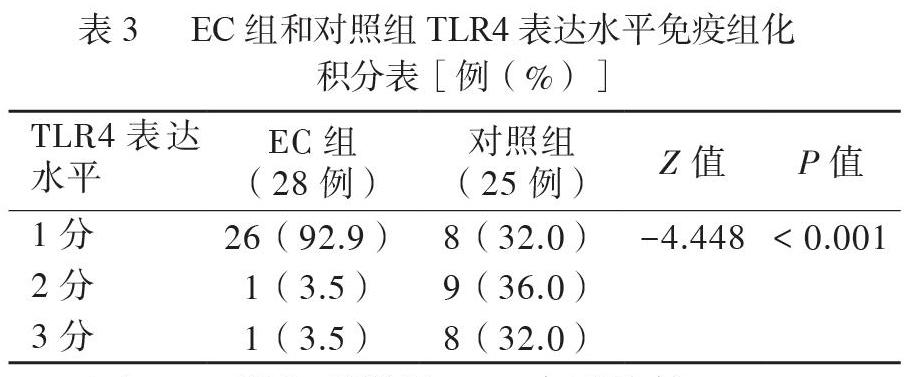
在EC組和對照組中,TLR4在結腸上皮細胞中均有表達,陽性胞膜呈黃色、棕黃色或棕褐色,見圖3。與對照組相比,EC組結腸黏膜TLR4水平降低,差異具有統計學意義(Z = -4.448,P < 0.05),見表3。
五、EC組和對照組IL-5水平比較
在EC組中,IL-5在結腸上皮細胞中均有表達,陽性胞膜呈黃色、棕黃色或棕褐色,而對照組呈陰性表達,見圖4。與對照組相比,EC組結腸黏膜IL-5表達水平明顯增高,差異有統計學意義(Z = -7.015,P < 0.05),見表4。
六、結腸黏膜TLR4、IL-5表達的相關性
所有患兒實驗結果顯示TLR4、IL-5表達水平呈負相關(r = -0.532,P < 0.05)。
討論
EGID是一種少見的可影響胃腸道從食道到直腸的任何節段或節段組合,從而產生各種臨床表現的慢性炎癥性腸病,最初由Kaijser于1937年描述,其特征是富含EOS的炎癥,沒有其它已知EOS增多的原因(即寄生蟲、感染、藥物反應或惡性腫瘤)。EC是一種罕見的原發性EGID,美國最近對一個基于人口的數據庫進行了調查,其中包括超過3500萬兒童和成人,報告的EC總體患病率為每10萬名受試者中有2.1人,每10萬名成人患病率為2.3,兒童每10萬人中有1.6人[6]。國內報道 EC 患兒發病率明顯高于國外,本組資料中我們共收集到 EC 確診患兒 28 例,年齡1 ~ 12 歲,男女比例約1.8∶1。
雖然在過去的10年中報道的EC病例有所增加,但其病因、發生機制尚不清楚,臨床可因病變累及的部位、病理、范圍和程度而有所差異,主要表現為腹痛、惡心、嘔吐、腹瀉、體質量減輕、胃腸道出血、腸道吸收不良或腹水[7]。本組資料中患兒的臨床癥狀主要為便血、腹瀉,大多數患兒內鏡檢查可見結腸黏膜充血、水腫、血管紋理欠清晰、小結節樣增生,嚴重者可見點片狀的糜爛、阿弗它樣潰瘍。有8例患兒內鏡下結腸黏膜正常。有研究表明,臨床癥狀和實驗室檢查結果通常是非特異性的,可能伴有也可能不伴有外周血嗜酸性粒細胞增多癥[8]。診斷需要根據胃腸道癥狀,通過活組織檢查證實腸道EOS增多,并排除其他已知的組織EOS增多的原因。本組資料顯示僅有18%的患者外周血EOS增高,推測可能是本組患兒大部分曾服用抗過敏藥物的原因,并且外周血EOS的數量會隨病情變化而出現波動,因此僅憑此項結果正常排除EC是不可靠的,提示外周EOS對確診EC不是關鍵,而內鏡下腸道組織活檢證實EOS浸潤> 20個/HPF是診斷EC的關鍵[9]。
EC的病因及發病機制尚不清楚,可能為環境、基因和免疫系統相互作用的結果,也可能與食物過敏,感染或炎癥性腸病共存,大量研究報道該病與過敏因素有關[10]。而在本組中 8例患兒食物變應原IgE檢查陽性,這提示過敏因素可能在發病機制中有一定的作用。通過動物實驗及臨床研究發現,過敏原或毒素等外源性或內源性抗原刺激EC患者產生特異性免疫球蛋白,激活T淋巴細胞,導致Th1/Th2 平衡失調,Th2 細胞分泌的細胞因子IL-5 是重要的炎癥介質,Th2 細胞的優勢應答導致IL-5、Eotaxin 等炎癥因子產生是消化道 EOS 異常浸潤和炎癥發生的基礎[2,8]。目前大多研究發現 IL-5 在EC的發病機制中起到非常關鍵的作用,它促進EOS產生、分化、活化及生存,并增強對趨化因子(如Eotaxin)的反應性,向消化道轉移。Prussin研究發現 IL-5+Th2 免疫反應與EGID發生相關,而Kinoshita等[11]研究中發現嗜酸性食管炎及胃腸炎患兒的細胞因子 IL-5 同樣升高。
IL-5是Th2衍生的一類細胞因子,是EOS活化的關鍵介質,也是EOS擴增及其從骨髓中釋放所必需的[12]。當激活時,胃腸組織浸潤的EOS可釋放嗜酸顆粒中的細胞毒性蛋白(包括EOS陽離子蛋白、EOS過氧化物酶、EOS來源的神經毒素和主要基質蛋白) ,還可合成血小板活化因子、白三烯C4等血管活性物質,進而造成器官損傷或功能障礙和更多EOS聚集,從而形成惡性循環。Straumann等(2001年)在特發性嗜酸性粒細胞性食管炎(EE)患者食管上皮活檢標本中觀察到IL-5和TNF-α的表達增加,因此認為特發性EE發病機制與Th2型過敏性炎癥反應有關。本研究顯示EC組結腸上皮組織IL-5呈陽性表達,而對照組結腸組織IL-5呈陰性,可能與上述發病機制有關。
T淋巴細胞在免疫系統中占有重要地位,實驗表明,炎癥性腸病患者中其腸道病變組織可見局部CD4+ T細胞浸潤并且功能異常[13]。CD4+ T細胞根據細胞因子的分泌分為Th1和Th2細胞.在正常情況下,體內的Th1和Th2處于動態平衡狀態并相互調節,從而維持體內環境的穩定性。如果Th1和Th2失去平衡,則在組織和器官中發生炎癥并引起疾病。Camoglio等(1998年)在潰瘍性結腸(UC)小鼠模型中發現CD4+ T細胞產生大量IL-4和IL-5,單個IFN-γ正常或減少,說明UC的發生和發展與Th1/Th2的失衡強烈相關。TLR4是固有免疫系統識別病原微生物的主要受體,可以識別入侵病原體的不同分子模式,是連接天然免疫和獲得性免疫的橋梁,在人體的免疫系統中起著重要的作用。同時它也在Th1/Th2的平衡中起著關鍵作用。近期研究發現 TLR4 的激活參與了某些過敏性炎癥疾病的發病過程。Eisenbarth等(2002年)在用卵清蛋白建立的哮喘小鼠模型研究中發現,小鼠吸入低濃度脂多糖(LPS)TLR4的激動劑的卵清蛋白,支氣管組織中 TLR4 低表達,從而產生抗原特異性 Th2 免疫應答而發生哮喘癥狀,而吸入較高濃度 LPS的卵清蛋白則誘導Th1免疫保護應答未出現哮喘癥狀。因此,TLR4介導的信號轉導通路在探索哮喘等Th2免疫應答為主的過敏性疾病免疫防治機制中具有重要的研究價值。目前國內外對TLR4與EC發病的關系的研究尚未見報道,因此本研究從TLR4與Th2免疫應答關系探討EC可能的發病機制。
本文探討了EC患兒腸上皮細胞TLR4的表達情況。免疫組化結果顯示,在EC組和對照組中,TLR4在結腸上皮細胞中均有表達,但與對照組相比,EC組結腸黏膜TLR4水平降低。本文也探討了TLR4、IL-5相關性,結果顯示它們呈負相關,即EC組患兒結腸組織中TLR4低水平表達,而IL-5呈高水平表達。對照組患兒結腸組織中TLR4高水平表達,而IL-5呈低水平表達。因此我們推測EC患兒腸組織TLR4表達明顯下降,可能一定程度上使IFN-γ等Th1細胞因子的產生減少,通過調節導致Th1/Th2 平衡失調,從而傾向于Th2表型應答,釋放大量IL-5細胞因子,參與EC的發生,該假設在我們前期構建的輪狀病毒腸炎乳鼠動物模型中得到驗證[14]。
綜上所述,我們推測機體受到過敏原、毒素等刺激時,腸道上皮細胞的TLR4不能反應性增高或表達被抑制,從而導致產生抗原特異性Th2免疫應答可能是EC發病機制之一,這也為EC的預防及治療提供新的思路。
參 考 文 獻
[1] Caldwell JM, Collins MH, Stucke EM, Putnam PE, Franciosi JP, Kushner JP, Abonia JP, Rothenberg ME. Histologic eosinophilic gastritis is a systemic disorder associated with blood and extragastric eosinophilia, TH2 immunity, and a unique gastric transcriptome. J Allergy Clin Immunol,2014,134(5):1114-1124.
[2] 張艷霞,王質剛.人類Toll樣受體信號轉導途徑及其介導的免疫作用.國際免疫學雜志,2010,33(2):121-123.
[3] Talley NJ, Shorter RG, Phillips SF, Zinsmeister AR. Eosin-ophilic gastroenteritis: a clinicopathological study of patients with disease of the mucosa, muscle layer, and subserosal tissues. Gut, 1990, 31(1):54-58.
[4] 潘彤彤,李云芳,盧華君.功能性腹痛兒童的血漿生長激素釋放肽及胃動素水平研究——附56例報告.新醫學,2009,40(12):791-792,816.
[5] 周輝. PDGF、α-SMA在嬰兒膽道梗阻肝內膽管上皮細胞的表達及意義.石家莊:河北醫科大學,2009.
[6] Mansoor E, Saleh MA, Cooper GS. Prevalence of eosinophilic gastroenteritis and colitis in a population-based study, from 2012 to 2017. Clin Gastroenterol Hepatol,2017,15(11):1733-1741.
[7] Tien FM, Wu JF, Jeng YM, Hsu HY, Ni YH, Chang MH, Lin DT, Chen HL. Clinical features and treatment responses of children with eosinophilic gastroenteritis. Pediatr Neonatol,2011,52(5):272-278.
[8] Uppal V, Kreiger P, Kutsch E. Eosinophilic gastroenteritis and colitis: a comprehensive review. Clin Rev Allergy Immunol,2016, 50(2):175-188.
[9] Reed C, Woosley JT, Dellon ES. Clinical characteristics, trea-tment outcomes, and resource utilization in children and adults with eosinophilic gastroenteritis. Dig Liver Dis,2015,47(3):197-201.
[10] Haas SL, Abbatista M, Brade J, Singer MV, B?cker U. Inte-rleukin-18 serum levels in inflammatory bowel diseases: corr-elation with disease activity and inflammatory markers. Swiss Med Wkly,2009,139(9-10):140-145.
[11] Kinoshita Y, Furuta K, Ishimura N, Ishihara S. Elevated plasma cytokines in Japanese patients with eosinophilic esophagitis and gastroenteritis. Digestion,2012,86(3):238-243.
[12] Conner JR, Kirsch R. The pathology and causes of tissue eosinophilia in the gastrointestinal tract. Histopathology,2017,71(2):177-199.
[13] Globig AM, Hennecke N, Martin B, Seidl M, Ruf G, Hasselblatt P, Thimme R, Bengsch B. Comprehensive intestinal T helper cell profiling reveals specific accumulation of IFN-γ+IL-17+coproducing CD4+ T cells in active inflammatory bowel disease. Inflamm Bowel Dis,2014,20(12):2321-2319.
[14] 熊莉婭,耿嵐嵐,楊敏,陳佩瑜,龔四堂.Toll受體在急性輪狀病毒腸炎乳鼠動物模型中的表達.廣東醫學,2013,34(15):2308-2310.
(收稿日期:2019-11-18)
(本文編輯:楊江瑜)

