白藜蘆醇對1型糖尿病小鼠骨組織代謝的影響
劉方超 陳穎 董冰子 付正菊 王顏剛 胡建霞
青島大學附屬醫院內分泌科,山東 青島 266000
1型糖尿病(type 1 diabetes mellitus,T1DM)由于胰島素絕對不足,引起蛋白質合成代謝障礙,高血糖引起多尿造成的鈣、磷、鎂從尿中大量丟失,致使患者骨量減少甚至骨質疏松,骨折風險較一般人群顯著增加。隨著醫療技術水平的提升,T1DM患者生存期明顯延長,其骨骼損害被日益關注。T1DM多為青少年或兒童起病,針對該人群骨質疏松癥的治療經驗較為有限,現有手段主要為控制血糖及鈣劑、維生素D補充治療。然而上述藥物的具體使用劑量尚未統一,治療效果尚不完全明確。白藜蘆醇是一種中藥單體,研究發現其具有優良的抗氧化和抗炎作用,能夠促進骨髓間充質干細胞的成骨分化。因此,本研究旨在通過構建T1DM骨質疏松動物模型,研究白藜蘆醇對T1DM鼠并發骨破壞的治療作用,為臨床治療青少年T1DM合并的骨損害提供新思路。
1 材料和方法
1.1 實驗動物
SPF級雌性NOD小鼠,體質量20~24 g,6~8周齡,購自南方模式動物有限公司。相對濕度40%~50%,室溫22℃~25℃,自由進食及飲水。12 h日光交替照射。經檢測NOD小鼠按隨機表方法分為:(1)糖尿病組(DM組,n=6):糖尿病發病后用0.9%氯化鈉溶液灌胃;(2)胰島素組(INS組,n=6):發病后每日予甘精胰島素皮下注射治療,劑量為0.2~0.4 U/kg,根據當日血糖進行調整;(3)白藜蘆醇組(RESV組,n=6):于發病后第3天予RESV 200 mg/(kg·d)灌胃;(4)飼養8周后,未發病的NOD小鼠作為正常對照組(N組,n=6)。
1.2 Micro-CT檢測
治療8周后脫頸處死小鼠,右側股骨70%乙醇固定,進行Micro-CT掃描(eXplore Locus User Guide,GE),對骨組織各項參數進行分析。
1.3 股骨切片堿性磷酸酶染色(偶氮偶聯法)
左側股骨10%乙二胺四乙酸(EDTA)脫鈣液脫鈣21 d后,石蠟包埋、切片行堿性磷酸酶(alkaline phosphatase,ALP)染色(堿性磷酸酶染色液,Solarbio)。低倍鏡(×100倍)下觀察骨小梁形態,高倍鏡(×400倍)計數骨股頭骨小梁內成骨細胞數目。
1.4 骨組織內相關基因表達:OCN、Runx2、PPARr、TRAP mRNA表達
實時定量熒光定量 PCR(RT-PCR)檢測 OCN、Runx2、PPARr、TRAP mRNA的表達。將小鼠股骨組織沖洗干凈骨髓腔,稱取質量后,加入適量TRIzol,按試劑盒說明書提取總RNA。取2 μL總RNA,加入5*PrimeScript Buffer(for real time)2 μL;PrimeScript RT Enzyme MixI 0.5 μL;Oligo dT Primer 0.5 μL;Random 6 mers 0.5 μL;RNase Free dH2O 4.5 μL。反應液震蕩離心10 s,使其聚集于EP管底部。在PCR儀上按下列條件進行逆轉錄反應:37 ℃ 15 min,85 ℃ 5 s,4 ℃逆轉錄為cDNA。
RT-PCR反應條件為95 ℃ 30 s(升溫速率為4.4 ℃/s)1循環;95 ℃ 5 s(升溫速率4.4 ℃/s)、60 ℃ 30 s(升溫速率2.2 ℃/s) 40循環;95 ℃ 5 s(升溫速率4.4 ℃/s)、60 ℃ 1 s(升溫速率2.2 ℃/s) 95 ℃ 5 s(升溫速率 0.11 ℃/s)。反應結束后記錄各樣本CT值。PCR結果定量用ΔΔCT法,CT=目的基因CT-內參基因CT,以正常組作為對照樣本,ΔΔCT=觀察樣本ΔCT-對照樣本ΔCT。樣本的相對表達量=2-ΔΔCT。檢測骨組織相關基因引物序列見表1。

表1 檢測骨組織表達基因引物序列Table 1 Primer sequences of expressed genes in bone tissues
注:以上引物均委托深圳華大基因科技有限公司合成。
血清酸性磷酸酶(acid phosphatase,ACP)檢測(ELISA法)小鼠內眥取血室溫靜置30 min,2 000 r/min離心15 min,取上層血清。ELISA法檢測血清酸性磷酸酶量。
1.5 統計學分析
運用SPSS 13.0軟件分析,數據用均值±標準差表示,兩組間差異用t檢驗,多組間比較用單因素方差分析,α=0.05。
2 結果
2.1 骨組織Micro CT結果
2.1.1Micro CT參數:骨組織3D參數分析(圖1)顯示,與正常組相比,糖尿病組骨密度(bone mineral density,BMD)降低(P=0.015),骨體積百分比(BV/TV)降低(P=0.049);與糖尿病組相比,白藜蘆醇治療組BMD升高(P=0.008),BV/TV升高(P=0.014)、骨表面密度(BS/TV)增加(P=0.016),結構模型指數(structural model index,SMI)升高(P=0.029);與胰島素治療組相比,白藜蘆醇治療組骨小梁數目(Tb.N.)明顯增加(P=0.018)。
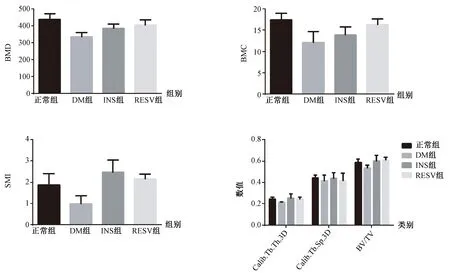
圖1 各組間骨組織Micro-CT參數Fig.1 Micro-CT parameters of the bone tissue in each group注:BMD:骨密度;BMC:骨礦物質含量;SMI:股骨結構模型指數;Calib.Tb.Th.3D:三維校準骨小梁厚度;Calib.Tb.Sp.3D:三維校準骨小梁分離度;BV/TV:骨體積分數;Tb.N:骨小梁數目。
2.1.2骨組織Micro-CT平片:從骨組織2D平片縱切面上觀察(圖2),與正常組相比,DM組皮質骨變薄,骨髓腔相對擴大。與DM組相比,RESV組、INS組皮質骨致密。由圖2C可見,與正常組相比,DM組骨股頭骨小梁數量明顯減少。與DM組相比,RESV組、INS組骨小梁增多。
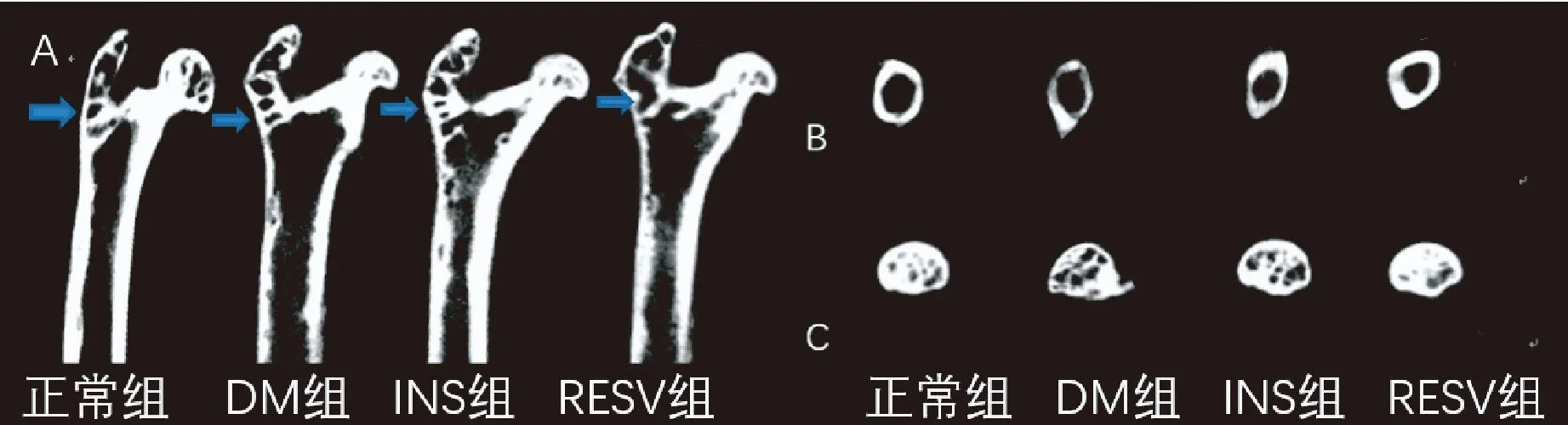
圖2 骨組織Micro-CT平片圖像 A:股骨縱切面,觀察皮質骨及骨小梁差別;B:取股骨中段切面觀察皮質骨厚度;C:股骨頭正中切面觀察骨小梁差別。Fig.2 Micro-CT plain film image of the bone tissue. A: The difference of cortical bone and trabecula was observed in longitudinal section of the femur; B: The thickness of cortical bone was observed in midsection of the femur; C: The difference of trabecula was observed in median section of the femoral head.
2.1.3股骨頭骨小梁重建:骨組織Micro-CT應用Image J軟件對股骨頭部分進行重建(圖3A)。DM組骨小梁形態模糊,數量減少、變細、中斷,殘端游離,小梁間距增寬。INS組及RESV組骨小梁相互連接成立體網狀,小梁表面光滑,小梁間距小。各組間骨小梁數目經Micro-CT掃描結果見圖3B,結果表明,DM組骨小梁數量明顯減少(P=0.018),INS組、RESV組與正常組之間比較差異無統計學意義。
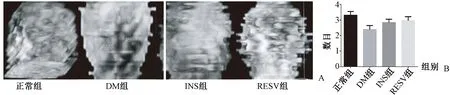
圖3 股骨頭骨小梁重建及參數比較 A:股骨頭骨小梁重建;B:各組骨小梁數目統計。Fig.3 Trabecular reconstruction of the femoral head and comparison of the parameters. A: Trabecular reconstruction of the femoral head; B: Statistics of trabecular number in each group.
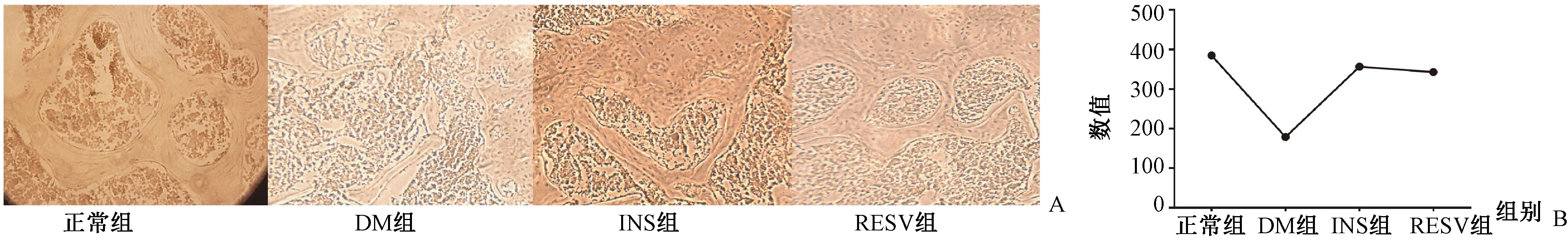
圖4 骨組織切片ALP染色比較成骨細胞 A:ALP染色,成骨細胞;B:各組間成骨細胞數量比較。Fig.4 The osteoblasts were compared using ALP staining in bone tissue sections. A: ALP staining, osteoblasts; B: Comparison of the number of osteoblasts among groups.
2.2 骨組織切片并ALP染色
骨組織切片ALP染色可見,糖尿病組骨小梁結構雜亂、變細,胰島素治療及白藜蘆醇治療組骨小梁結構完整連續。各組分別取連續3張切片,應用Image J統計切片中股骨頭處的成骨細胞,計算其平均值進行比較,結果(圖4)顯示,糖尿病組成骨細胞明顯減少,胰島素治療組成骨細胞數目略多于白藜蘆醇治療組。
2.3 骨重建相關基因mRNA RT-PCR檢測
各組骨組織相關基因mRNA RT-PCR相對表達量結果(圖5)可見:DM組TRAP、PPAR-G相對表達量增加(P=0.032、0.013);與DM組相比,INS組TRAP、PPAR-G相對表達量降低(P=0.025、0.017),Runx2相對表達量增加(P=0.030);RESV組TRAP、PPAR-G表達量降低(P=0.013、0.028),Runx2表達量增加(P=0.034)。
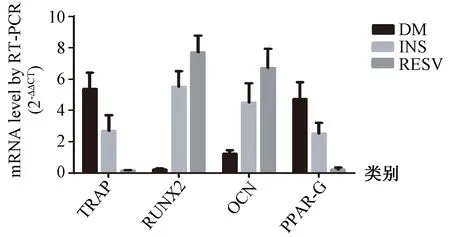
圖5 各組間骨重建相關基因mRNA RT-PCR相對表達量比較Fig.5 Comparison of RT-PCR results of relative expression of bone remodeling-related genes among different groups
2.4 血清TRACP檢測比較
正常組、DM組、INS組、RESV組小鼠血清TRACP檢測結果分別為(15.24±0.85) μg/mL、(18.38±0.76) μg/mL、(13.84±1.02) μg/mL、(13.08±0.93) μg/mL。與正常組相比,DM組血清TRACP水平明顯升高(P=0.026);與DM組相比,INS組TRACP水平明顯降低(P=0.019);與DM組相比,RESV組TRACP水平明顯降低(P=0.009)。
3 討論
T1DM降低骨密度并增加脆性骨折風險的主要原因是骨形成減少,然而1型糖尿病對骨吸收的影響存在爭議。Tsentidis等[1]通過對T1DM兒童和青少年骨代謝研究發現,成骨細胞相關信號減低,而s-RANKL等破骨細胞信號傳導增加。Peng等[2]研究發現,T1DM小鼠表現出成骨細胞數量/骨表面積、礦物結合率減低,NF-κB配體受體表達下降,這些因素共同作用引起骨吸收受損。近年來研究表明,PPAR-G基因缺失可通過增加骨形態發生蛋白家族成員的產生和分泌來促進骨形成并減少骨吸收,從而增加小鼠骨密度[3]。與之相反,PPAR-G激活劑(如噻唑烷二酮類)通過增加骨硬化蛋白的表達抑制骨形成[4]。本研究結果顯示T1DM小鼠骨組織骨小梁變細、數量減少,成骨細胞數量減少結合OCN、Runx2基因下調,符合骨形成減少,PPAR-G、TRAP基因表達增加,表明骨吸收增加。本研究表明,T1DM骨破壞是骨形成減少、骨吸收增加二者共同作用的結果。然而,T1DM引起的成骨減少、破骨增加,二者孰輕孰重、發生的時間前后關系以及補充VitD和鈣劑是否能延緩甚至避免這些事件的發生,這些問題尚需要進一步研究。
T1DM繼發的骨損害是通過多種機制實現的,血管生成損傷[5],糖尿病微血管病變[6-7],慢性血糖控制不佳[8]等。近年來研究發現,C肽替代治療可以改善糖尿病相關并發癥[9]。Russo等[10]研究發現C肽可激活人類成骨細胞樣細胞(Saos-2)中的ERK1/2途徑,增加I型膠原,參與骨重建過程。因此,T1DM患者繼發的骨損害是無法完全通過胰島素替代治療來改善的。本研究發現,胰島素治療后的T1DM小鼠骨組織中,雖然OCN、Runx2基因上調明顯,仍存在骨小梁變細、數量減少以及成骨細胞減少,表明胰島素在改善糖尿病骨損害上仍有局限性。
研究表明,常規補充鈣劑及VitD對治療T1DM骨損害作用有限。阿侖膦酸短期治療可抑制成骨細胞凋亡來預防T1DM鼠骨損害,長期治療可以增加骨密度但是以抑制骨形成為代價的[11]。同時,美國食品藥品監督管理局未批準阿侖膦酸用于兒童。因此,用于治療T1DM青少年骨損害的方法非常少。
近年來,研究者逐步探求新的骨損害治療方法。Zhang等[12]發現益生菌治療T1DM鼠骨損害的新途徑。Zhang等[13]研究發現枸杞子乙醇提取物通過對十二指腸鈣轉運蛋白和腎臟CaSR的調節作用從而減輕T1DM小鼠高鈣尿并防止骨小梁退化,同時發現石榴籽提取物具有減輕糖皮質激素誘導的小鼠骨丟失和高鈣尿[14]。Pino等[15]研究發現,白藜蘆醇在治療T1DM鼠合并骨外傷時,具有獨立于胰島素治療以外的促成骨作用。本研究更進一步表明,白藜蘆醇在治療繼發于T1DM的骨損害具有積極作用,其作用可能是從多方面實現的,除外已被證實的降糖、抗氧化作用外,本研究發現其上調Runx2、OCN基因,促進成骨細胞增殖,防止繼發于糖尿病的成骨細胞凋亡;PPAR-G基因下調同時表明白藜蘆醇有抑制骨髓干細胞向脂肪細胞分化的作用。白藜蘆醇促進成骨的分子機制尚需進一步明確。
總之,T1DM引起的成骨細胞數量減少,成骨活性減弱,破骨活性增強,骨髓干細胞脂肪化是繼發骨損害的主要原因。目前,治療青少年骨損害方法有限,白藜蘆醇可以從多角度增加成骨細胞數量、增加成骨細胞活性、減少骨吸收,或將成為臨床治療繼發于糖尿病的骨損害的有效方法。

