維生素D與強直性脊柱炎患者甲襞微循環形態的相關性研究
張磊 高照猛 于春艷 鄧堯 姜璐
勝利油田中心醫院風濕免疫科,山東 東營 257034
強直性脊柱炎(ankylosing spondylitis,AS)是一種慢性炎性、全身性的疾病,不僅可以累及骨關節系統,造成骨關節的強直,在疾病早期就可以出現骨量減低或者骨質疏松[1]。同時,AS還可以累及血管系統,參與動脈粥樣硬化的發生,并促進高血壓等疾病的致病作用。研究發現[2],AS患者冠心病的發病率較普通人群增加30%~50%。AS異常骨代謝與血管并發癥間的聯系尚不明確,這其中維生素D可能發揮了重要作用。維生素D除了鈣調節作用外,還能調節免疫細胞,抑制樹突狀細胞和T淋巴細胞的生長、分化,抑制白細胞介素1(IL-1)、白細胞介素6(IL-6)、腫瘤壞死因子(tumor necrosis factor,TNF)等參與AS的發病[3],并通過多種途徑參與了心血管疾病的發生[4]。在AS慢性炎癥狀態下,多種炎癥因子損傷血管內皮,不僅使冠狀動脈微血管損傷,也可致全身微循環功能障礙[5],并可通過皮膚微循環狀態反映出來[6]。目前國內外尚無關于AS維生素D水平與微循環狀態的研究,所以筆者開展了相關臨床研究工作,旨在探討維生素D對微循環的影響。
1 資料與方法
1.1 研究對象
選取2016年5月至2018年10月在勝利油田中心醫院(以下簡稱“我院”)風濕免疫科就診的AS患者121例,均符合1984年修訂的紐約AS分類標準[7],其中男性113例,女性8例,年齡18~59歲,平均(38±10)歲。所有患者均接受一種非甾體抗炎藥及柳氮磺吡啶、甲氨蝶呤或來氟米特治療。所有患者詳細記錄HLA-B27、CRP、ESR等實驗室項目。排除標準:合并發熱性疾病;高血壓;糖尿病;嚴重肝腎、心臟等功能不全;其他慢性或急性炎癥性疾病;腫瘤性疾病;3個月內接受過維生素D制劑治療;12個月內接受過抗TNF-α生物制劑治療。對照組80名均來自我院健康查體中心,無關節炎病史,且年齡、性別匹配。本研究經我院倫理委員會審查通過,所有受試者均簽署書面知情同意書。
1.2 方法
1.2.1病情活動度計算:依據相關研究[8],通過下述公式計算患者病情活動度評分:Q1~Q6分別代表巴氏強直性脊柱炎活動指數 (bath ankylosing spondylitis disease activity index,BASDAI)中第1~6題的視覺模擬評分(visual analogue scale,VAS;0~10 cm)。ASDAS-CRP=0.12×Q2+0.06×Q6+0.11×患者對病情評價(VAS)+0.07×Q3+0.58×In(CRP+1)。依據冀肖健等[9]研究,若檢查CRP小于3.5 mg/L時取1.5 mg/L計算ASDAS-CRP。
1.2.2甲襞微循環檢測方法:運用江蘇同人醫療電子科技有限公司TR8000D型微循環檢測儀(編號TR1580D10001,微循環檢測鏡為SONY公司TR15SXJG001),檢查取患者左手環指,并放置于心臟水平位置,滴松節油0.2 mL到待檢指甲襞處,需要時用玻璃棒涂抹均勻。用可視甲襞微循環檢測鏡直接觀察甲襞微循環,避免按壓甲床,由1名經驗豐富的檢測員截取圖像并測量有關數據,最后由計算機內置程序計算加權積分并出具報告。所有受檢患者于檢查6 h前禁止服用含咖啡因飲料及吸煙,檢查前于室溫20 ℃~25 ℃檢查室內休息15~20 min。
1.2.3甲襞微循環有關參數定義:毛細血管密度定義為測量指末梢端1 mm范圍內的毛細血管數量。毛細血管長度定義為毛細血管袢彎曲頂端到基底區間的距離,動靜脈支最寬處的距離分別定義為動脈支寬度和靜脈支寬度。毛細血管袢直徑或袢頂徑定義為毛細血管袢頂端最寬距離。測量方法可參考圖1。
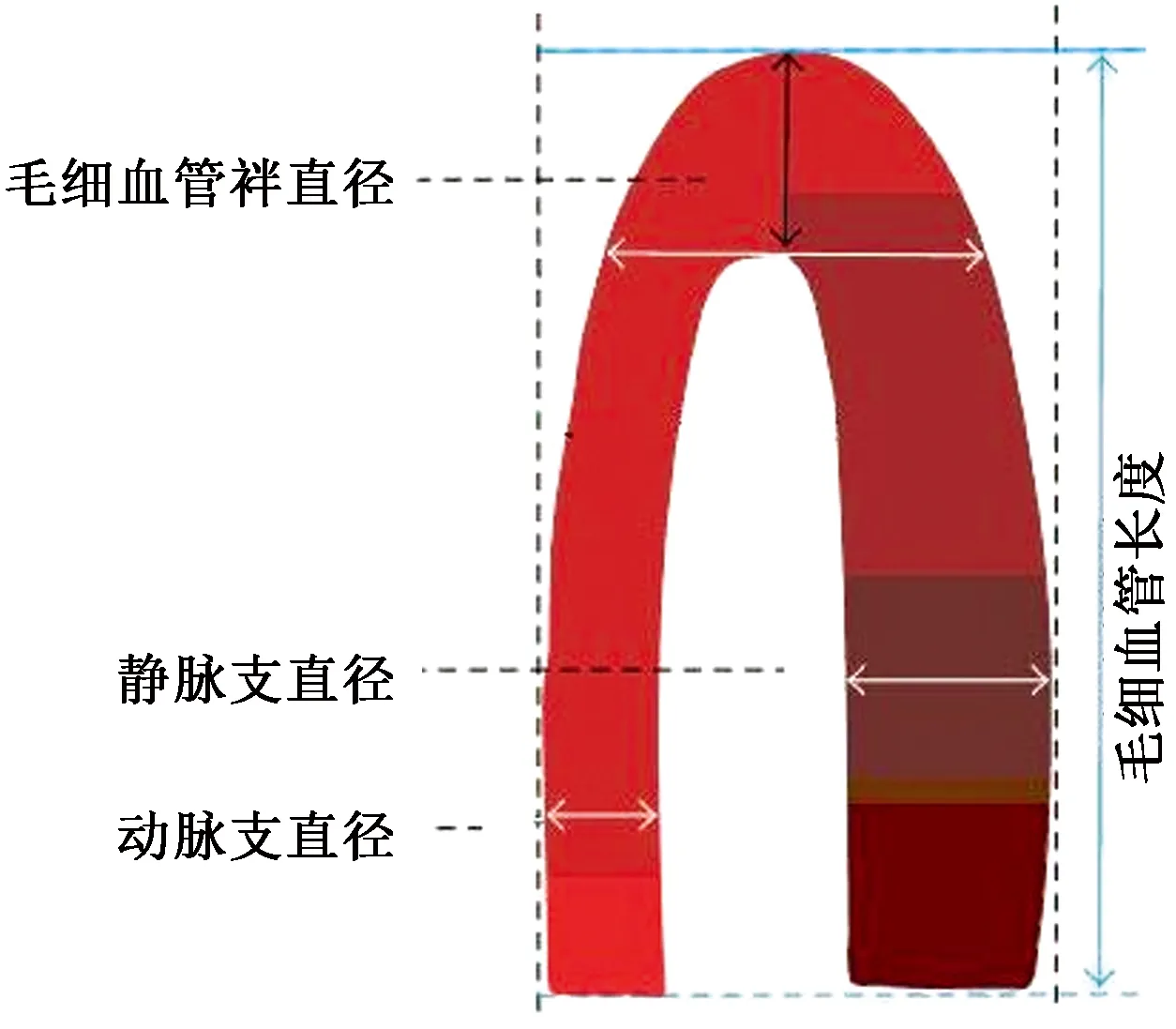
圖1 正常毛細血管相關參數測量Fig.1 Measurement of normal capillary parameters
1.2.4相關實驗室檢查方法:抽取受試者空腹靜脈血3 mL左右,留取血清并于-80 ℃凍存。魏氏法檢測 ESR,免疫散射速率比濁法檢測 CRP(參考范圍:0~6 mg/L)。血清25(OH)D3采用羅氏診斷公司光化學免疫分析法試劑盒檢測。按照25(OH)D3水平分組[10]:25(OH)D3<10 ng/mL為嚴重缺乏組;10 ng/mL≤25(OH)D3<20 ng/mL為缺乏組;20 ng/mL≤25(OH)D3<30 ng/mL為不足組;30 ng/mL≤25(OH)D3<50 ng/mL為充足組。
1.3 統計學分析
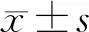
2 結果
2.1 AS患者與健康人群指標的比較
本研究中無VitD充足者,AS患者血清25(OH)D3水平[(18.73±5.99) ng/mL]低于健康對照人群[(22.53±5.56) ng/mL],差異具有統計學意義(t=-3.883,P<0.01)。AS患者甲襞微循環積分(5.49±2.29)顯著高于對照組(1.34±0.57),差異具有統計學意義(t=13.616,P<0.01)。見表1。

表1 AS組和健康對照組人群一般情況Tabel 1 Characteristics of the patients with AS and healthy control subjects
2.2 AS患者不同血清25(OH)D3水平組間的一般情況比較
AS患者依據血清25(OH)D3水平分為VitD不足亞組[(24.32±3.03) ng/mL]和VitD缺乏亞組[(14.23±3.49) ng/mL]。兩亞組間比較,年齡、性別、病程、HLA-B27等無顯著差異,VitD不足亞組的血沉、CRP、ASDAS-CRP積分低于VitD缺乏亞組,差異具有統計學意義(r=-2.064、-2.163、-5.441;P=0.024、0.035、0.000)。VitD不足亞組的甲襞微循環積分(3.82±1.44)低于VitD缺乏亞組(6.68±2.03),差異具有統計學意義(r=-6.393,P=0.000),見表2。
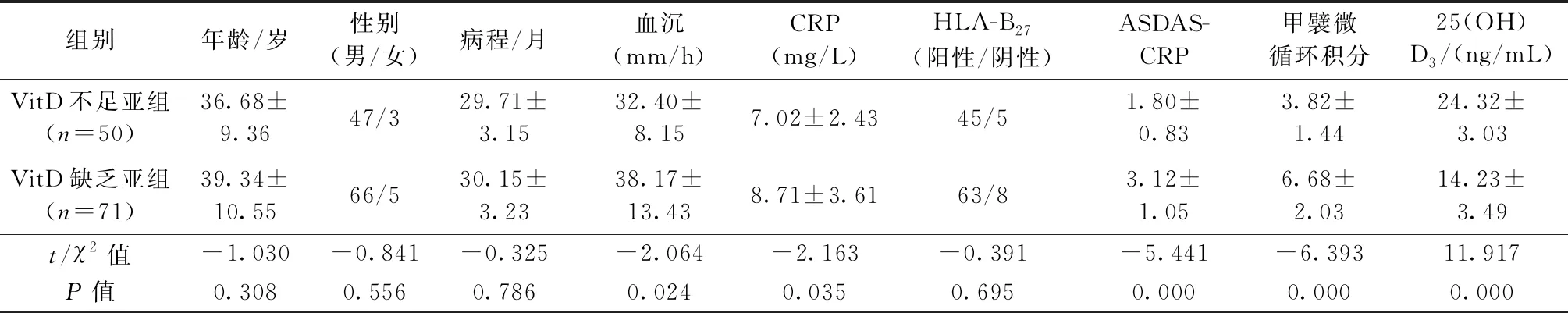
表2 AS患者按25(OH)D3水平分組后的臨床資料比較Table 2 Comparison of clinical data among AS subgroups based on 25(OH)D3
2.3 AS患者不同25(OH)D3水平組間甲襞微循環形態學比較
VitD缺乏組的毛細血管密度、動靜脈支管徑分別小于VitD不足組和對照組(P均<0.01),管袢直徑分別大于VitD不足組和對照組(P均<0.01);VitD不足組的毛細血管密度、動靜脈支直徑均小于對照組(P均<0.01),管袢直徑大于對照組(P=0.001),毛細血管長度與對照組相比無顯著差異(P=0.832),詳見表3。
2.4 25(OH)D3水平與甲襞微循環積分的相關性分析
Pearson相關分析顯示,25(OH)D3水平與甲襞微循環積分呈負相關(r=-0.637,P<0.01),控制年齡、病程、血沉、CRP、ASDAS-CRP等變量后,調整后的相關系數為r=-0.357,P<0.01,見圖2。進一步多元線性回歸分析提示25(OH)D3水平下降是甲襞微循環積分增高的風險因素(β=-0.099,P=0.001),見表4。
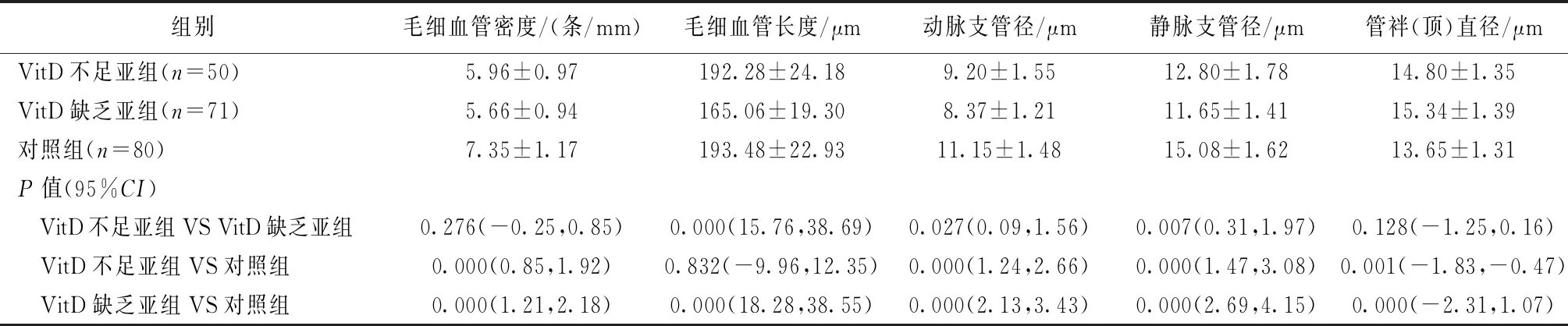
表3 各亞組間甲襞微循環血管形態分析Table 3 Comparison of nailfold capillaroscopic morphology of AS subgroups
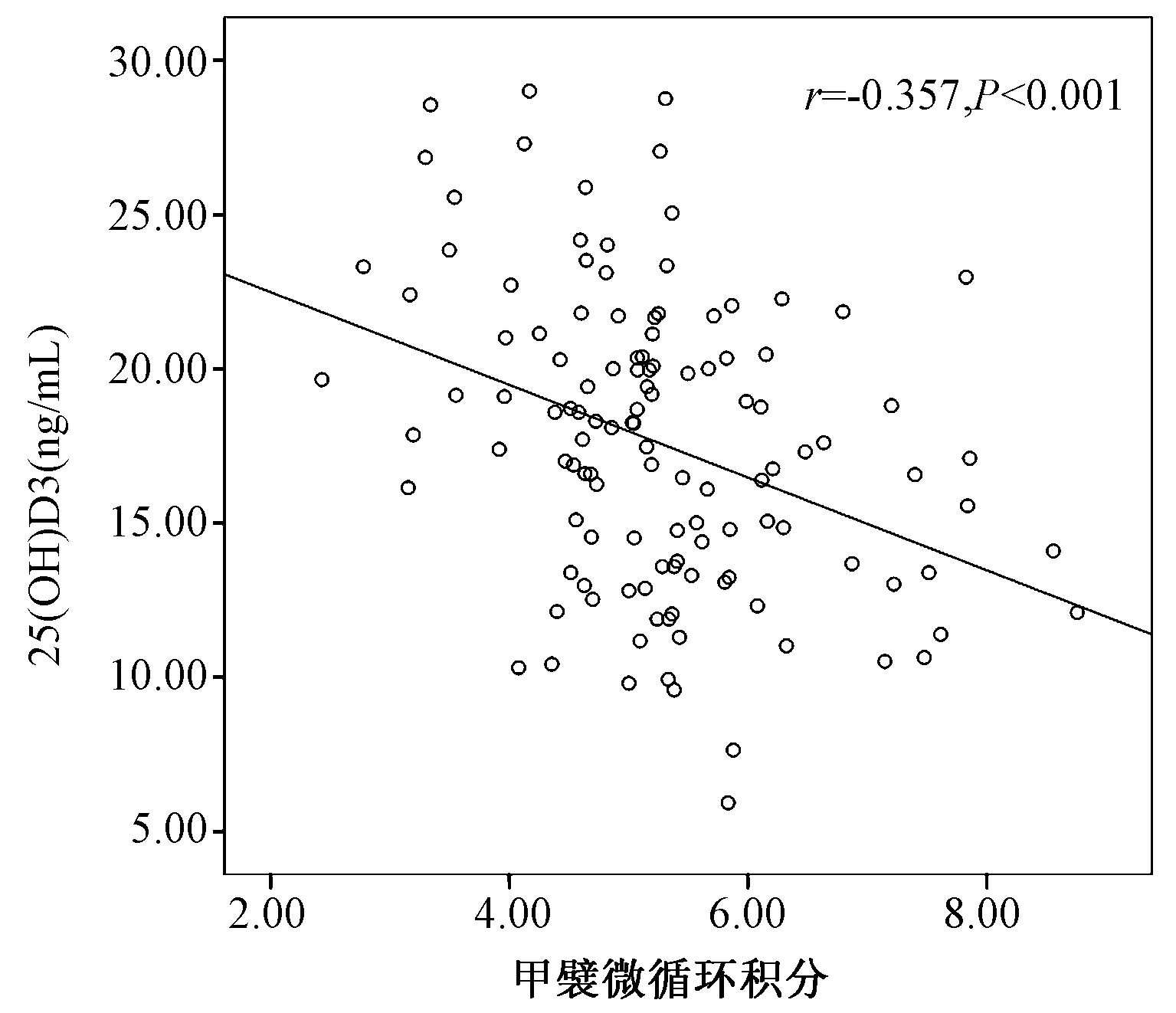
圖2 血清25(OH)D3與甲襞微循環積分的相關分析Fig.2 Regression analysis between 25(OH)D3 and nailfold capillary scores
表4AS患者甲襞微循環積分相關因素的多元線性回歸
Table4Multiple linear regression analysis of the associated factors of nailfold capillary scores in patients with AS

變量β95%CISEt值P值25(OH)D3-0.099-0.157,-0.040-0.259-3.3890.001CRP0.0290.002,0.0570.1502.1340.002ASDAS-CRP1.1250.729,1.5200.5685.6990.000
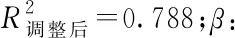
3 討論
AS是一種慢性全身性的炎性疾病,與HLA-B27密切相關,主要累及骶髂關節等中軸關節。研究發現[1],在疾病的早期階段,AS患者就可以出現骨量減少或骨質疏松,這一比例甚至高達62%,但是詳細機制尚未被完全闡明,這其中維生素D發揮了重要作用。研究發現[11],活性維生素D與靶器官組織細胞核上的維生素D受體結合后發揮作用,除調節鈣代謝外,還可以抑制IL-6、TNF-a等炎癥因子,下調破骨細胞的活性,參與AS的發病機制和骨代謝。維生素D在血液中主要以25(OH)D3的形式運輸,其半衰期為14 d左右,故檢測血清25(OH)D3的濃度是評價體內維生素D的重要方法。此次研究發現AS患者25(OH)D3水平為(18.73±5.99)ng/mL,顯著低于健康人群,與國內外研究結果一致[12-13]。本研究同時發現VitD不足組患者的血沉、CRP、ASDAS-CRP積分均低于VitD缺乏亞組(r=-2.064、-2.163、-5.441;P=0.024、0.035、0.000),提示25(OH)D3水平越低,疾病活動度越高,與Cai等[14]的薈萃分析結果一致。
維生素D通過抑制前列腺素和環氧合酶途徑、細胞因子誘導的粘附分子表達減少、基質金屬蛋白酶(matrix metallo proteinase,MMP)9的減少等[15]抑制炎癥反應。在AS慢性炎癥狀態下,低水平的25(OH)D3進一步加劇炎癥進展,促使血管內皮細胞損傷,促進動脈粥樣硬化的發生、發展。Han等[16]所做的對照研究顯示AS患者發生動脈粥樣硬化的概率是正常人對照組的1.5倍,周圍血管疾病發生率為1.6倍,腦血管疾病為1.7倍,高血壓為1.3倍,AS已被認為是獨立的心血管風險因素[17]。然而目前的研究[18]主要針對中大血管的并發癥,較少關注AS的微循環狀態。此次研究中,選取健康人群作為對照,校正了高血壓、糖尿病等傳統風險因素后發現,AS患者甲襞微循環積分(5.49±2.29)顯著高于對照組(1.34±0.57),t=13.616,P<0.01,提示AS患者存在微循環障礙,同時線性回歸分析證實AS病情活動與甲襞微循環異常密切相關(β=1.125,P<0.01)。
研究[19]證實低水平的25(OH)D3加重了血管內皮細胞的炎癥負擔,加劇了AS患者動脈粥樣硬化的發生,是否也會造成AS微循環障礙的發生也是本研究關注的重點。在校正ASDAS-CRP等因素后,本研究發現低水平的25(OH)D3是甲襞微循環積分增高的風險因素,與AS患者甲襞微循環積分呈顯著負相關(r=-0.357,P<0.01)。依據既往的研究[20-21],維生素D缺乏會導致一氧化氮對血管內皮的保護作用減弱,導致細胞質內游離鈣降低,減少平滑肌細胞產生前列腺素,促進血管內皮細胞收縮,進而影響循環狀態。同時,維生素D還可通調節IL-17等細胞因子影響血管功能。IL-17是一種急性炎癥因子,由活化后的Th7細胞分泌,促進成纖維細胞、內皮細胞和上皮細胞中的MMP產生MMP-1、MMP-3、MMP-9和MMP-13,加重動脈內膜炎癥反應,促進動脈粥樣硬化和循環障礙的發生[22]。IL-17還可通過誘導血小板聚集和內皮細胞遷移、增殖而促進血栓形成[23]。Shen等[24]研究發現,AS和RA患者外周血單核細胞中IL-17陽性CD4+T細胞數量高于健康對照人群,而AS患者血清IL-17聚集程度比RA更為明顯,提示IL-17介導了AS更為嚴重的炎癥反應。此次研究限于目前研究條件未能開展維生素D、甲襞微循環與IL-17等炎癥因子的相關性研究,但為將來的基礎研究提供了思路。
AS等炎癥性疾病被證實皮膚血管功能受損[25]。皮膚中大部分地區的毛細血管袢中垂直于皮膚表面,而在甲襞區域則平行于皮膚表面,這允許通過甲襞微循環鏡可以檢測到其整個毛細血管長度等形態學特征。甲襞微循環鏡是一種高度敏感的且安全、無創性影像學技術,用于檢測甲襞區域微循環狀態,并已被證明在某些風濕性疾病的鑒別診斷中有幫助[26]。Batko等[27]研究發現20.4%的AS有甲襞微循環形態異常,表現為管袢增粗、毛細血管卷曲、分支增多、毛細血管周圍水腫等,并且經過抗TNF-a制劑治療后可改善毛細血管周圍水腫,但對其他形態學變化無影響。本研究在排除了接受TNF-a抑制劑治療的患者后發現,AS同樣存在著顯著的甲襞微循環形態異常,表現為毛細血管密度下降、毛細血管動靜脈支變細、管袢增粗等,VitD缺乏組的毛細血管密度、動靜脈支管徑分別小于VitD不足組和對照組(P均<0.01),管袢直徑分別大于VitD不足組和對照組(P均<0.01),提示25(OH)D3水平越低,形態學異常越顯著,但是這些形態學變化對早期診斷、病情預后是否具有特異性,仍需未來嚴格設計的前瞻性研究證實。
本研究同樣存在一定局限性,如檢查者的經驗、方法等差異會對微循環的量化產生影響;受試者的緊張情緒以及隨著患者年齡的增長、器官組織的老化、毛細血管前因素如動脈硬化等及血流的管內因素如血液黏度、血脂、血管周圍結締組織的變化等也會對微循環產生影響。另外,如果研究未對微循環血流等動態變化及功能做出評估,甲襞微循環鏡檢查只能看到毛細血管,部分能看到毛細血管叢,不能觀察到細動脈、細靜脈,對局部整體循環判斷有局限性;非甾體抗炎藥[28]及甲氨蝶呤等[29]慢性抗風濕藥物也可能會減少血管內皮細胞增殖或抑制血管形成,影響微循環功能。
總之,AS患者存在不同程度的維生素D缺乏,血清25(OH)D3水平下降與甲襞微循環積分升高顯著相關,是AS患者發生微循環障礙的危險因素,詳細機制仍需進一步研究。

