光催化甲烷轉化研究進展
許振民,卞振鋒
上海師范大學,資源化學教育部重點實驗室,上海 200234
1 引言
甲烷是天然氣的主要成分,在地球上儲存量巨大1,2。它具有熱值高、成本低、安全無毒等特點。相比于煤炭、石油等化石燃料,甲烷更容易燃燒完全,且無煙無塵,燃燒產物僅為水和二氧化碳。因此,甲烷作為清潔能源得到了廣泛的利用。從微觀結構上看,CH4的碳原子中心與四個氫原子形成正四面體對稱結構,C―H鍵的平均解離能為ΔHC―H=440 kJ·mol-13-8,其化學性質相對穩定,因此,C―H鍵發生均裂與異裂均存在一定困難,在用作起始原料發生進一步轉化時受到嚴重的限制。盡管如此,人們仍舊希望可以開展有效的方法對CH4進行活化。這一過程不僅可以提供甲醇、甲醛及乙烯等極具工業利用價值的原料,另一方面,將這種可燃氣體轉化為相應的液態化石燃料雖經歷二次化學轉化,但可以極大地降低運輸成本,從經濟角度來看仍舊可以帶來可觀的收益。使用非均相或均相的金屬催化劑實現CH4的活化是目前為止最為行之有效的途徑,CH4的C―H鍵可以通過與催化劑表面的金屬中心相互作用降低其活化能,從而發生進一步氧化,但該方法一般需要苛刻的反應條件9-12。因此尋找其它高效的甲烷活化方法成為當前研究熱點。近幾年來,利用光能替代傳統的熱能來驅動甲烷催化轉化反應已被證明是非常有前景的新策略13,14。光催化反應由光能激發產生光生電子和空穴,參與到甲烷C―H鍵活化和自由基形成,打破了傳統熱力學平衡的束縛,使得甲烷轉化反應可以在較溫和條件下進行(室溫,常壓),避免了高溫、高壓情況下催化劑的失活、積碳等缺陷,因此,光催化越來越多地被用于甲烷轉化。本文總結了近年來所開發的一系列室溫光催化甲烷直接轉化體系,主要包括甲烷的氧化和偶聯過程,并對催化過程中催化劑的組成與結構、氧化劑、電子的轉移等因素對甲烷C―H鍵活化的影響等相關進展進行簡要評述。
2 光催化甲烷直接氧化制甲醇
甲烷直接氧化制甲醇被視為一個“Dream Reaction”,這是因為甲醇不僅可以直接作為工業原料,而且可以進一步轉變成烯烴、芳烴等重要的化工原料以及燃料15-19。由于C―H鍵的平均解離能較高,該反應要克服較大的反應勢壘,傳統的催化研究基本上是在高溫高壓下進行20-23。較少有催化劑體系能夠在常溫常壓下高選擇性活化甲烷生成甲醇24-26。光催化反應產生的光生電子和空穴,能夠參與到甲烷C―H鍵活化和自由基形成,這為低溫甲烷轉化提供新的途徑。本節通過對近年來催化甲烷直接氧化制甲醇光相關進展的總結,對不同氧化劑對甲烷轉化率及選擇性的影響進行了評述。
2.1 O2
在甲烷氧化制甲醇體系中,O2由于具有穩定性好、氧化性強、綠色環保等優點,是應用較為廣泛的一種氧化劑。Kaliaguine等27以V6+/SiO2及TiO2為催化劑,在氧氣氛圍下,通過紫外照射產生的氧負離子(O-)首次實現了甲烷常溫條件下的轉化。雖然甲烷的轉化率較低,且只有痕量的甲醇生成(主要產物是CO2),但是為甲烷的低溫氧化提供了一種新的策略。隨后,Heactor等28通過浸漬法制備了VOx/SBA-15材料,在紫外燈照射下(220 °C),將甲烷成功的轉化為甲醛和甲醇。當V的負載量為2.65%時,甲烷的轉化率高達93.8%,甲醛的生成速率為525 μmol·h-1·g-1。光化學有助于在溫和條件下對甲烷進行活化,但氧氣具有較高的氧化性,使用分子氧作為氧化劑時,甲烷易被過度氧化,因此調控氧化程度尤為重要。Hu等29以V-MCM-41為材料,在紫外光催化甲烷氧化的過程中發現,向反應體系中適量的引入NO,可以顯著提高甲醇的選擇性。如圖1所示,當反應在氧氣氛圍下進行時,氧化的產物只有CO2和H2O,當向反應體系中通入NO時,則可以有效的抑制甲醇的進一步氧化,顯著提高了甲醇的選擇性(88%)。
2.2 H2O
與氧氣相比,使用溫和的水作為氧化劑則有利于甲醇選擇性的提高。Richard等人30用La摻雜的WO3材料,在紫外光輻射條件下(343 K),雖然甲烷的轉化率僅為4%,但主要的氧化產物為甲醇和氫氣。研究發現,WO3在光照條件下產生光生電子和空穴(h+),h+與水表面的羥基(HO-)發生反應產生羥基自由基(HO·),隨后活化的甲烷被HO·氧化生成甲基自由基(CH3·),后者進一步氧化生成甲醇,而電子則還原質子生成氫氣。另外,Villa等31通過反向復制法制備了La修飾的介孔WO3材料,在55 °C紫外光照射下,甲醇的生成速率約為30 μmol·h-1,總醇的選擇性為47%。與介孔WO3材料相比,摻雜La可以有效的增加WO3材料表面的羥基自由基的濃度,因而大幅提升甲烷的轉化率。
在光催化甲烷的氧化過程中,提高催化劑對光的吸收率以及電子傳輸能力對甲烷的轉化率有重要的影響。通過貴金屬修飾,可以改善催化劑對光的吸收以及電荷的轉移32-38,對甲烷的轉化一定的促進作用。Hameed等39采用等體積浸漬法制備了Ag修飾的WO3材料并用于甲烷光催化制甲醇。研究表明,Ag可以增強其對光子的吸收能力并延長激發態壽命。加快了Ag/WO3表面羥基自由基的生成速率,在一定的時間內,甲醇的生成速率有了明顯的提高。
異質結的構筑也是提高光催化效率的有效手段40-43。Andreu等44通過浸漬法制備具有異質結構的V-HBEA和Bi-V-HBEA催化劑,并用于甲烷光催化制甲醇反應。實驗結果表明(圖2),與商業的V2O5相比,Bi-V2O5更有利光生電子在V2O5和BiVO4之間傳輸,提高了催化劑的對光的吸收能力和電子傳輸能力。因此甲醇產率有所提升。而HBEA載體具有更大的比表面積,更有利于V分散,增強了材料的吸光能力,且其獨特的孔道結構(孔道尺寸為55 nm)有利于與甲烷(動力學直徑為3.8 nm)接觸,故表現出較好的甲醇生成速率。而Bi的引入,降低了催化劑V-HBEA的布朗斯特酸位點濃度,從而表現出更高的甲醇選擇性。
為了促進光催化體系中光生電子與空穴分離,向體系中加入電子犧牲劑也是一種有效的方法。Villa等45以多孔硅KIT-6為模板,通過反向復制法制備出多孔WO3半導體光催化材料,研究發現,體系中存在Fe3+、Cu2+等電子犧牲劑,能夠有效捕獲光生電子,促進體系光生電子與空穴的分離,更有利羥基自由基的生成。與無電子犧牲劑時相比,甲醇的產生速率分別提高了2.5和1.7倍。當向體系中加入Ag+,后者被電子還原成Ag單質,并覆蓋在WO3的表面,影響了材料的催化性能,抑制了甲醇的生成(圖3)。此外,H2O2與電子反應可以生成更多的羥基自由基,增加WO3表面羥基自由基的形成速率。因此H2O2和Fe3+的引入也有利于乙烷的生成。
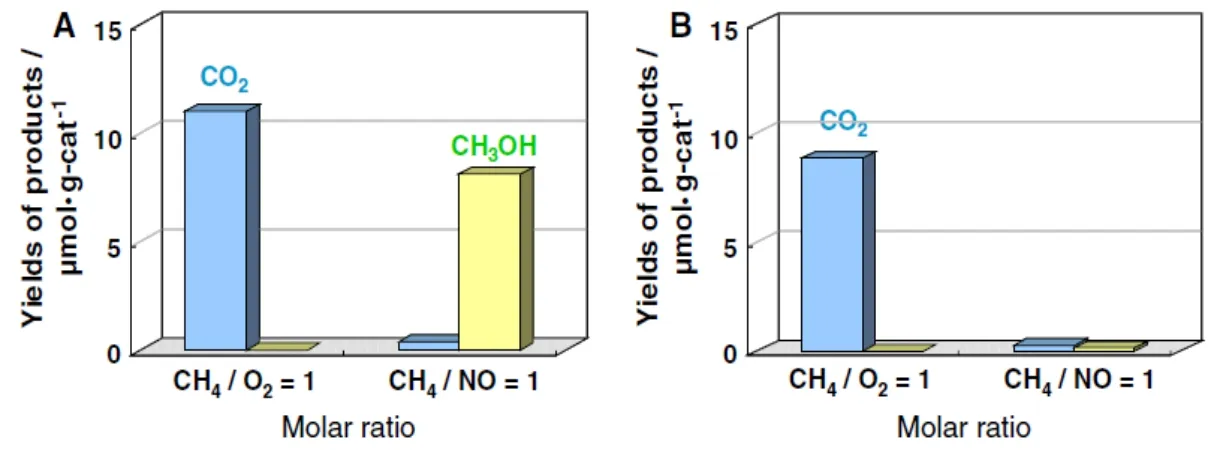
圖1 (A) V-MCM-41 (acid)與(B) V-MCM-41 (base)在NO 或O2 氛圍下光催化甲烷生成CO2 及CH3OH 的活性圖29Fig. 1 Yields of methanol and CO2 in the photocatalytic oxidation of CH4 with NO or O2 on: (A) V-MCM-41 (acid); and (B) V-MCM-41 (base) 29.
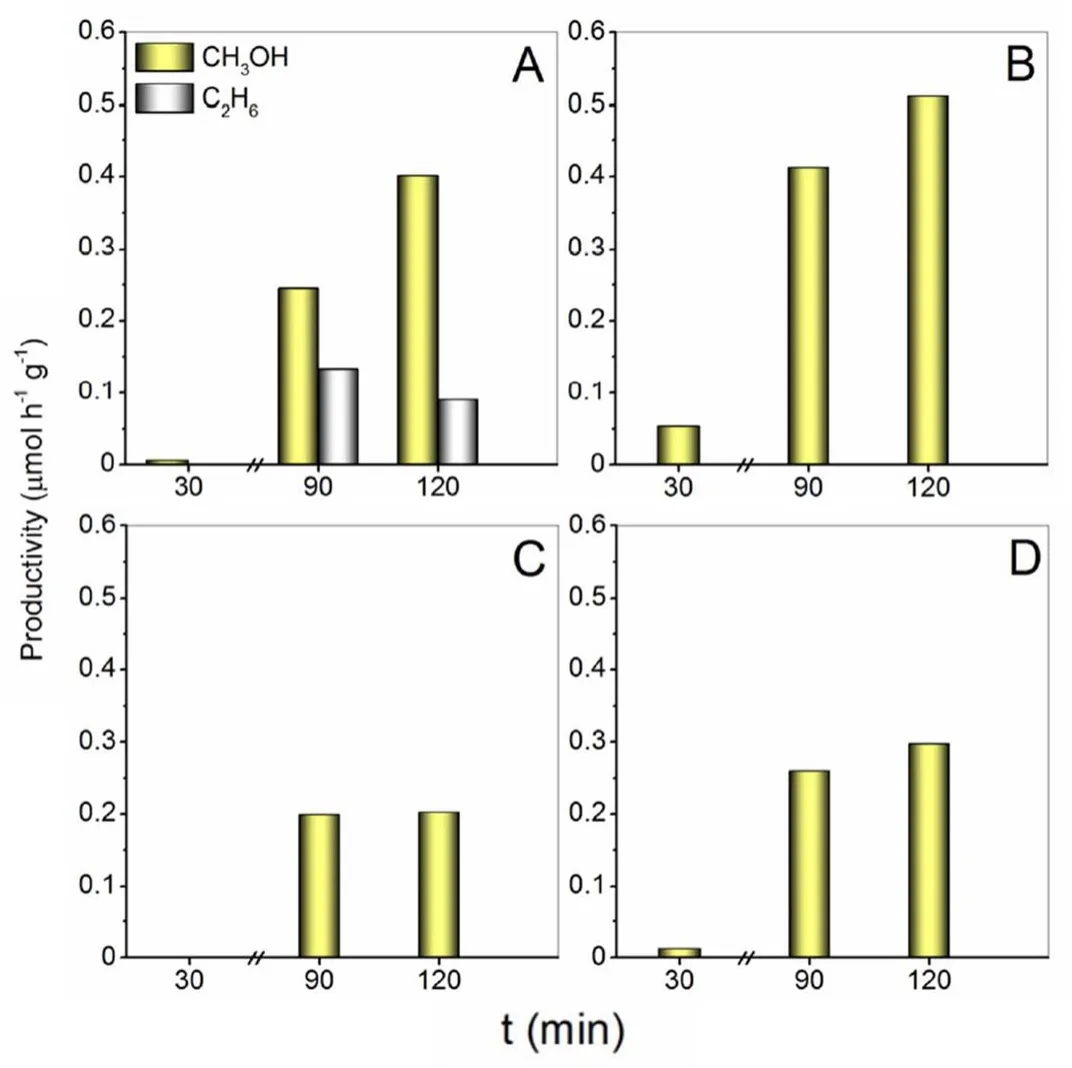
圖2 (A) V-HBEA、(B) Bi-V-HBEA、(C)商業V2O5及(D) Bi-V2O5催化甲烷生成甲醇及乙烷的活性圖44Fig. 2 CH3OH and C2H6 productivity obtained with V-HBEA (A),Bi-V-HBEA (B), commercial V2O5 (C) and Bi-V2O5 (D) 44.
2.3 H2O2
近年來,Fenton反應不僅在處理環境問題中占有重要地位46-53,而且在選擇性氧化領域也有著優異的表現54,55。有鑒于此,Tang14在模擬太陽光輔助下,以常規浸漬法獲得的二氧化鈦負載鐵為催化劑、過氧化氫為氧化劑,在常溫常壓下實現了甲烷高選擇性制甲醇。球差校正電鏡和吸收譜學研究表明,該催化劑的活性中心為高度分散的三價鐵物種。反應過程中,雙氧水的存在非常關鍵,沒有雙氧水時,甲烷則不轉化。通過對比不同助催化劑,發現Fe作為助催化劑時,甲烷轉化的活性最高,其甲醇收率是純TiO2的4倍。3 h內,甲烷的轉化率可達15%,總醇選擇性可達97%,其中甲醇的選擇性高達90% (圖4)。對比FeOx/TiO2和純TiO2的光致發光譜以及光電流譜可知,FeOx的存在加速了空穴-電子對的分離,抑制空穴電子對的復合,促進羥基自由基的生成,從而提高了甲烷的轉化率。
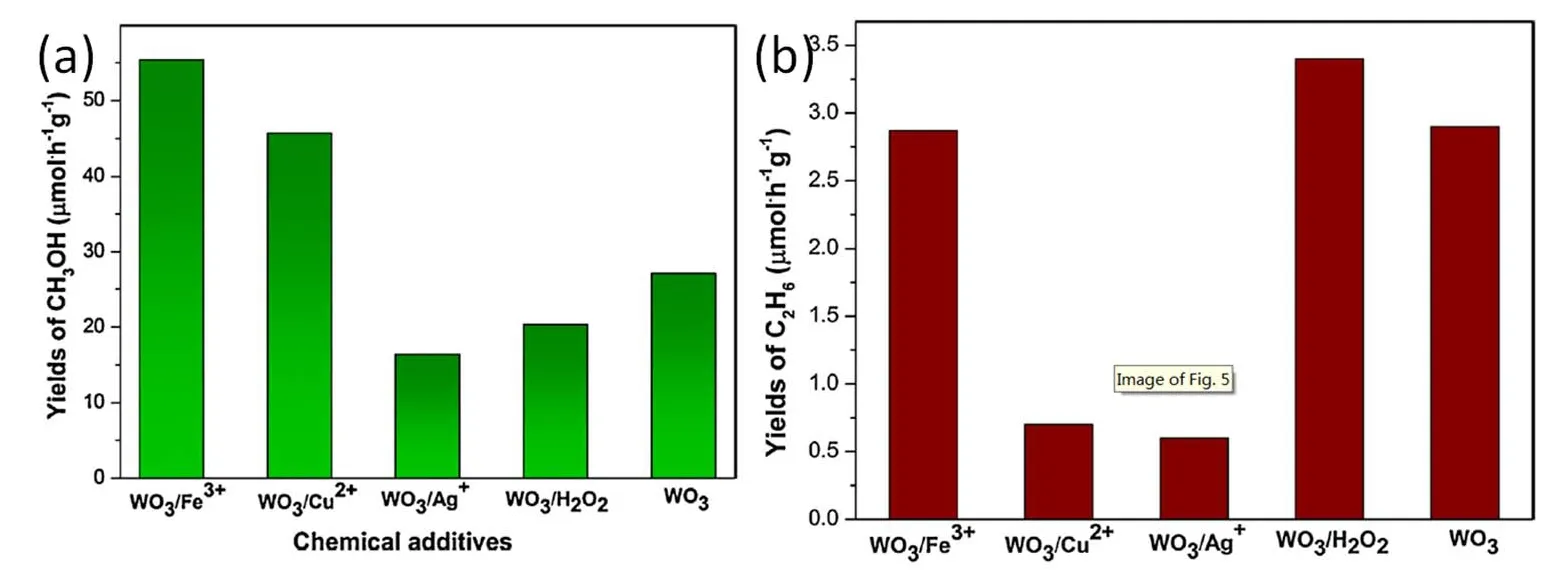
圖3 不同反應體系光催化CH4生成CH3OH(a)和C2H6(b)活性圖45Fig. 3 Yields of CH3OH (a) and C2H6 (b) in the photocatalytic oxidation of CH4 in different systems 45.
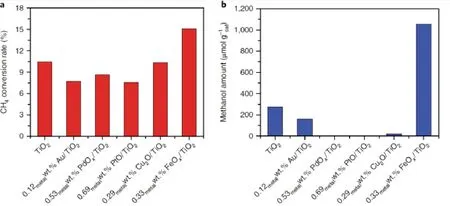
圖4 不同金屬修飾TiO2光催化(a)CH4轉化速率和(b)甲醇生成速率14Fig. 4 Methane conversion rates (a) and methanol yields (b) for a series of metal modified TiO2 samples 14.
光催化雖然能夠在較溫和的條件下實現甲烷到甲醇的轉化。但迄今為止,甲烷的部分氧化反應還很難同時兼得高的選擇性和高的轉化率。使用氧氣作為氧化劑時,甲烷易過度氧化轉變為CO2。相比于活潑的氧氣分子,水作為一種弱的氧化劑氧化甲烷是一個更好的選擇,但仍存在甲烷轉化率較低的問題。而光芬頓法則構建了一種新的甲烷高效制甲醇的體系,為溫和條件下實現甲烷的高效活化提供了新思路。此外通過調控催化劑的酸堿性質,對光催化劑進行修飾,以及構建異質結(界面)都可以提高電子的利用率,增加催化劑表面氧化物種的含量,從而提高甲醇的生成速率。
3 光催化甲烷的偶聯
甲烷的偶聯(OCM)是一種直接有效制乙烯、乙烷等低碳化合物的方法56,57。對于經典的熱催化甲烷無氧脫氫反應,其反應過程受熱力學平衡限制,往往需要高溫、高壓的條件才能實現較高的轉化率,這樣苛刻的反應條件不但對催化劑的熱穩定性要求很高,而且給反應器的研究與設計帶來大量問題58,59;對于氧化偶聯過程,產物在反應過程中則易發生深度轉化或過度氧化生成CO或CO2。由此可見,開展低溫甲烷偶聯的研究具有重要的理論價值和實際意義。
3.1 甲烷的無氧偶聯
1998年Yoshida等60在紫外光輔助下,首次實現了在室溫條件下甲烷的無氧偶聯反應,其中,甲烷的轉化率為5.9%,且主要的產物為乙烷(選擇性約為60%),并且得到的乙烷的產量較熱力學平衡計算的產量高了很多,因此可以證實利用光催化替代熱催化是甲烷催化轉化的一種行之有效的策略。
隨后,Yoshida61研究發現,將硅材料在高溫條件下進行預處理。可以使催化劑表面的羥基脫落并產生光吸收中心,該吸收中心能夠被258 nm的紫外光激發,從而有助于光催化反應的進行。接著,Yoshida教授62發現,三元氧化物SiO2-Al2O3-TiO2在光誘導甲烷室溫下偶聯體系中表現出更高的光催化活性。樣品的近邊吸收譜圖(XANES)表明,Al和Ti在活性三元樣品中具有四面體局域結構,能夠形成具有協同效應的雙活性位點。當體系中Si : Al : Ti (原子比) = 89.5 : 10 : 0.5時,與具有單活性位點的光催化材料(SiO2-Al2O3)相比,其對甲烷的光催化活性提高了近20倍(圖5)。
分子篩具有可調控的孔道結構、大的比表面積和孔容,對甲烷有很好的吸附性能63。Chen等64利用金屬鋅蒸汽制備出骨架含有離域電子的新型金屬鋅-分子篩復合材料。在常溫、常壓和紫外光輻照條件下,該材料能夠高效的催化甲烷無氧脫氫偶聯生成等物質的量的乙烷和氫氣。其中甲烷轉化速率為9.8 μmol·h-1·g-1,且乙烷的選擇性接近100% (圖6a)。機理研究表明,光催化甲烷轉化過程經歷兩步電子轉移:首先,在紫外光(波長小于390 nm)照射下,分子篩骨架中的電子被激發到鋅離子4s軌道并形成的Zn+,隨后,在可見光(波長小于700 nm)輻照下,Zn+與甲烷分子相互作用,位于Zn+的4s軌道的電子繼續躍遷進入甲烷的C―H鍵的反鍵軌道,抵消其成鍵效應,活化了甲烷的C―H鍵。光激發電子兩步轉移過程,使得活化甲烷C―H鍵的能量從原來的4.6 eV大幅降到了3.2 eV,成功的實現了利用天然太陽光驅動的甲烷轉化。
最近,Zhang課題組13通過原位修飾的方法制備了Ga/Pt共摻雜的有序多級孔鈦硅分子篩材料,在常溫下,Pt/HGTS (2%)對甲烷的轉化速率可達3.48 μmol·h-1·g-1,對乙烷的選擇性達到90.1%。相比單一介孔結構的樣品,多級孔結構有利于提升材料的催化活性(圖7a,b)。深入研究表明:負載鉑后,材料的光電荷分離效率得到了顯著提高,同時載流子濃度也明顯增加,鎵的摻雜,有利于正價鉑的形成。鉑陽離子與金屬態的鉑形成雙活性位點,更有利于甲烷C―H的斷裂,而過多的鎵摻雜會導致電荷分離效率下降、電荷分離效率降低,同時導致更多的長碳鏈產物的形成。基于實驗結果作者提出了甲烷光催化轉化的分子機理:如圖7c所示,首先甲烷分子被富電子的金屬態鉑活化,在光照下C―H斷裂,甲基和氫物種分別吸附Pt1和Pt2上;接著,另一個甲烷分子按照第一個甲烷的過程繼續活化;形成的甲基中間體與氫中間體相互結合形成一個乙烷及氫分子;最后,產物脫附。該工作首次基于半導體光催化劑的表面原子重排及電子特性改性,為合理設計與開發高效甲烷轉化光催化劑提供了新的研究思路。
3.2 甲烷的氧化偶聯
Chen65利用簡單的離子交換法,將多種金屬陽離子修飾到鈦硅分子篩(ETS-10)中。其中,ETS-10骨架光致電荷分離過程產生的羥基自由基和Ga3+均與甲烷分子發生相互作用,因此,Ga-ETS-10材料表現出優異的活化甲烷C―H鍵的能力(圖6b)。在高壓汞燈照射下,甲烷5 h內的轉化率接近100%,乙烷的選擇性則高達70%。作者利用多種原位檢測手段,研究光驅動甲烷C―H鍵在材料表面的斷裂過程,并對反應機理進行了假設:半導體受光激發,產生光生電子-空穴,其中光生電子擴散到催化劑表面被Ti4+捕獲形成Ti3+,而空穴將表面羥基氧化為羥基自由基。高活性的羥基自由基能夠與甲烷分子發生反應,生成甲基自由基和水,產生的甲基自由基隨后發生偶聯反應形成乙烷。
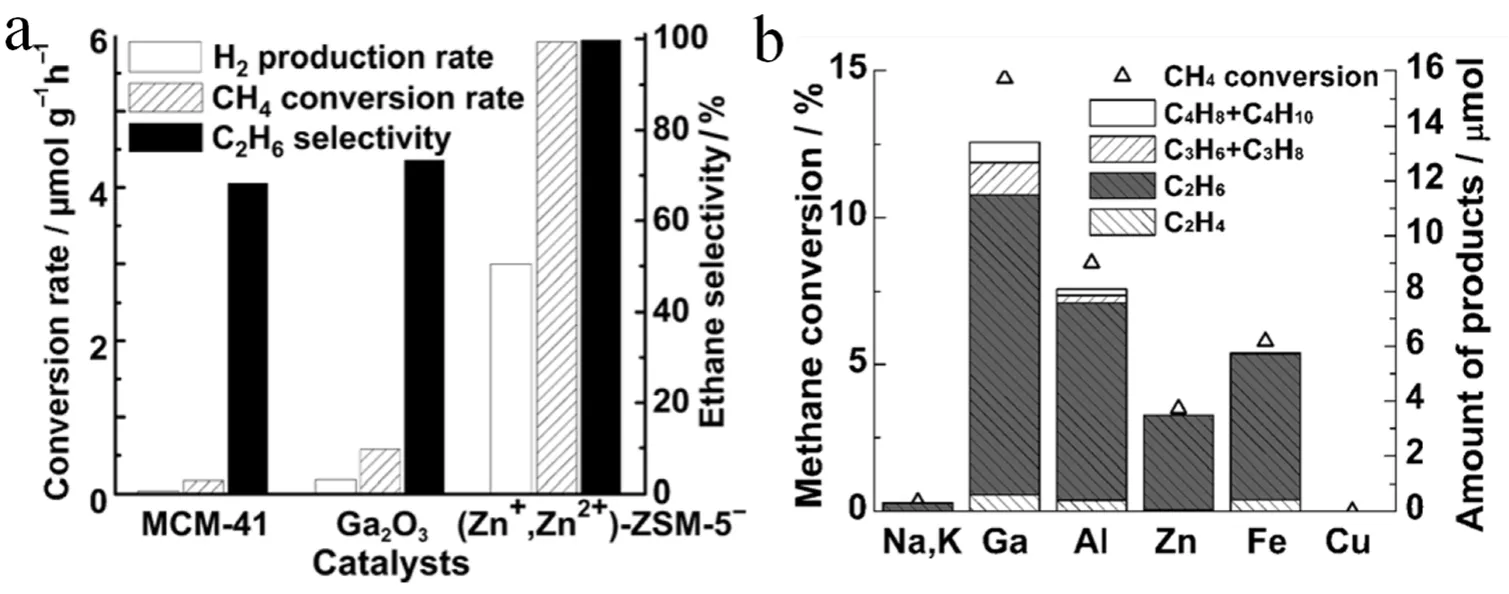
圖6 (a)不同催化劑光催化甲烷轉化、乙烷以及氫氣的生成速率圖64;(b)不同催化劑光催化甲烷轉化以及不同產物分布活性圖65Fig. 6 (a) Methane conversion rate, hydrogen production rate and ethane selectivity obtained for the NOCM reaction catalyzed by different photocatalysts 64; (b) methane conversion and product distribution obtained in the NOCM reaction catalyzed by different photocatalysts 65.
GaN半導體具有離子鍵的強度高、化學穩定性好、禁帶寬度易于調節等優點,是一種具有廣闊應用前景的半導體材料66,67。Li團隊68制備了m晶面暴露的GaN納米棒,該材料在室溫紫外光作用下,可以高效的催化甲烷轉化生成苯和氫氣(催化速率約為700 μmol·h-1·g-1,選擇性 > 95%)。通過不同結構材料的活性對比發現,GaN納米棒由于具有更高的比表面積,以及高的m晶面暴露率,對甲烷有更高的催化活性(圖8)。機理研究表明,m晶面表面可以形成強的局部極化靜電場,能夠有效地極化甲烷C―H鍵,在紫外光作用下,C―H鍵更容易異裂產生甲基負離子和質子氫,而甲基負離子被光生空穴氧化為甲基自由基(·CH3),后者進一步偶聯形成乙烷。產生的乙烷分子進一步發生脫氫及偶聯反應最終形成穩定的苯分子。
此外,Yu等69制備了Pt修飾的TiO2半導體材料,紫外吸收光譜表明,Pt的修飾可以明顯的拓展TiO2材料在可見光的吸收。作者通過捕獲實驗,對反應過程中的活性物種進行了研究。結果表明,加入空穴捕獲劑后,甲烷的轉化受到明顯的抑制。電子捕獲劑的引入則顯著的提高了甲烷的轉化。進一步研究發現,少量Pt (0.1%)的引入可以活化CH4的C―H,形成更多的·CH3,隨后·CH3自身偶聯生成C2H6。而過多的Pt修飾則減少·OH的生成,同時·CH3的生成也減少。XPS分析表明,Pt可以與TiO2的表面羥基結合,當Pt的負載量增加時,TiO2表面游離的羥基減少,導致反應體系中羥基自由基的濃度減少。因此,適當的Pt負載可以使CH4的活化與CH4的脫氫反應有效的匹配,從而提高C2H6的得率。
ZnO晶面由于具有較高極性(0.047 C·m-2)70,能夠誘導其表層[ZnO]形成內電場71,可以提高甲烷的C―H的活化。Long等72制備了Au修飾的暴露晶面的ZnO納米片并用于甲烷的偶聯反應。實驗結果表明,單獨Au納米粒子和ZnO納米片幾乎無反應活性,但是將Au負載于ZnO納米片上后,反應活性顯著提高,全光譜輻照(320-800 nm)條件下甲烷的轉化速率相比于單獨使用紫外光波段(320-400 nm)、可見光波段(400-800 nm)時提升了5倍。深入研究發現,甲烷的偶聯發生在m-ZnO的表面,材料表面吸附的甲烷分子與Zn2+原子之間的相互作用導致Hd+-CH3d-極化。在光照射下,極化甲烷被分裂并氧化成·CH3自由基和H+。而H2的生成是甲烷偶聯的決速步驟,當反應體系中引入氧氣,H+可以被O2消耗,導致H2的產率減小,乙烷的產率則顯著地提高。
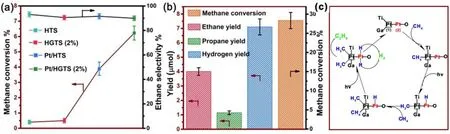
圖7 (a)不同催化劑光催化甲烷轉化以及乙烷的選擇性的活性圖;(b)Pt/HGTS (2%)光催化甲烷轉化以及生成乙烷、丙烷、氫氣的活性圖;(c)光催化甲烷無氧偶聯的機理圖13Fig. 7 (a) Methane conversion and the corresponding selectivity towards ethane obtained in the photodriven NOCM reaction over various samples and (b) the ethane, propane, and hydrogen yields and the corresponding methane conversion from the photodriven NOCM reaction over Pt/HGTS (2%); (c) the proposed molecular mechanism of the photocatalytic NOCM reaction 13.

圖8 不同結構GaN催化甲烷的轉化(a)及乙烷的生成(b)活性圖68Fig. 8 Amount of converted (a) methane and (b) ethylene over various GaN catalysts in different forms 68.
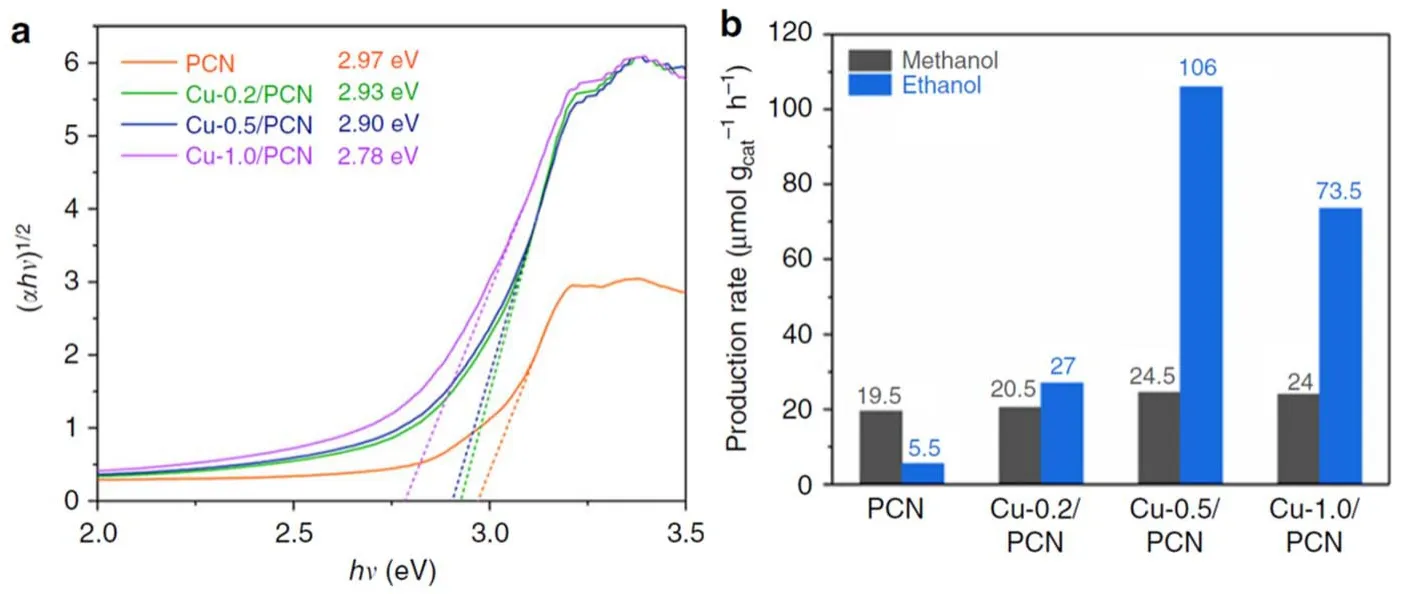
圖9 (a)不同催化劑轉換的Kubelka-Munk函數與光子能量圖;(b)不同催化劑催化甲烷轉化活性圖70Fig. 9 (a) Plots of transformed Kubelka-Munk function versus photonenergy for different samples;(b) products of methane conversion over different samples 70.
近日,硅酸鹽研究所Wang等73通過在氮化碳材料(PCN)的有序空腔中進行銅修飾,首次實現甲烷向乙醇的光催化直接轉化。通過對材料的光學性質的表征,可以發現,當銅的負載量為0.5%,可以顯著減小PCN的禁帶寬度,促進光生載流子的分離(圖9)并且在甲烷的偶聯反應中表現出最好的催化活性。在甲烷的氧化過程中,銅修飾的PCN不僅可以原位產生并分解H2O2,同時,Cu物種也是甲烷的吸附與活化中心,避免了過量的羥基自由基對甲烷的過度氧化。

圖10 材料Cu-0.5/PCN光催化甲烷轉化的機理圖70Fig. 10 The hypothetic mechanism for photocatalytic anaerobic methane conversion over Cu-0.5/PCN 70.
通過機理研究發現(圖10),該材料中的銅物種與鄰近碳原子存在協同效應,不僅實現了羥基自由基的原位生成,還促進了材料對甲烷C―H鍵的活化以及對高活性中間物種的穩定。使得甲烷的轉化過程沿著甲烷-甲醇-乙醇的路徑進行。在傳統的光催化過程中,O2的引入可以促進了H2O2的生成,從而提高甲烷的轉化率,但值得注意的是,將O2引入系統后,乙醇的生成受到了明顯的抑制。這是由于,O2的存在延遲了銅的光催化循環,也促進甲基自由基進一步氧化成HCHO和CO2,致使乙醇產率受到了明顯的抑制。該工作提出了溫和條件下甲烷向液體燃料直接轉化的新策略,有助于加深對多碳產物的形成機制的認識。
與傳統的催化甲烷偶聯反應策略,在光催化反應體系中,甲烷分子可以處在能量更高的激發態,更容易發生化學鍵的斷裂和重組,此外,通過光催化位點的設計、局部微環境的構筑(載體孔道的篩選)以及晶面的可控設計等可以避免傳統高溫熱催化過程中生成產物C―C骨架的斷裂和重排問題,實現甲烷的高轉化率和高選擇性。
4 總結與展望
甲烷既是燃料又是重要的化工原料,從甲烷出發,不僅可以直接氧化成甲醇,還可以選擇性的得到含有多個碳的化學物(乙烯、苯等)。然而甲烷的親和力差、與催化劑相互作用弱、C―H鍵能高等特點使得其難以活化,因此甲烷直接轉化一直是多相催化研究中極富挑戰性的課題。與傳統熱催化甲烷活化相比,光催化反應能夠提高甲烷的極化和解離能力,更容易發生化學鍵的斷裂和重組,且光化學反應可以突破傳統的熱力學平衡對轉化率的限制,使體系朝自由能增加的方向移動,使甲烷的轉化可以在較溫和的條件下進行。同時光催化較傳統的熱催化,還具有可操作性強、能耗低、反應副產物少特點,因此光催化越來越多地被用于甲烷的轉化。然而當前的光驅動技術主要聚焦于新型光/光熱催化劑的探索,與傳統的熱催化相比,仍有許多問題需要解決。
(1)目前光催化甲烷的轉化效率還比較低,反應機制的研究還不深入,反應中所涉及的瞬態物種難以檢測,并且現在對于反應中間體的性質缺乏了解,催化劑的光活化中心與甲烷分子間的作用還需要進一步得到闡明,發展相應的原位檢測方法,有助于深入研究并揭示其機理。
(2)實驗室使用的光源通常是Xe燈光源,強度是太陽能的10-50倍,并且多數光電材料在300-500 nm附近有較強光吸收,對波長大于600 nm的可見光吸收較弱,直接使用太陽光仍具有很大的挑戰。
(3) C―H鍵斷裂為CH4氧化的決速步驟,氧化過程難以控制,從而發生復雜的競爭反應,如何控制CH4的選擇性催化轉化是較為嚴峻的問題。
總之,光驅動C―H的活化為未來甲烷的轉化提供了一條新的可持續的途徑,有望在充分發展后而實現溫和條件的甲烷的高效轉化。同時,光/光電/與熱催化的結合有望推動光催化在能源和環境領域中做出重要貢獻。
- 物理化學學報的其它文章
- 魅力光催化劑
- Rod-Shaped Metal Organic Framework Structured PCN-222(Cu)/TiO2 Composites for Efficient Photocatalytic CO2 Reduction
- Cu2+ Modified g-C3N4 Photocatalysts for Visible Light Photocatalytic Properties
- Controlling Self-Assembly of 3D In2O3 Nanostructures for Boosting Photocatalytic Hydrogen Production
- 硫化鎘反蛋白石光子晶體制備及光解水制氫
- Fabrication of Z-Scheme Heterojunction of SiC/Pt/Cds Nanorod for Efficient Photocatalytic H2 Evolution

