基于梯度稀釋法分析細菌多樣性對土壤碳代謝的影響
張秀娟,安麗蕓,劉 勇,劉 菊,李君劍,*
1 山西大學黃土高原研究所, 太原 030006 2 山西省林業科學院, 太原 030012
微生物對于許多生態系統而言是必不可少的一部分,作為土壤的重要組成部分,土壤微生物在土壤的元素循環中發揮著重要作用[1]。雖然生物多樣性目前已被確定為推動生態系統循環過程的一個重要驅動力,但土壤微生物群落豐富的多樣性使我們對其物種多樣性功能的了解甚少,并且有學者提出,不同土壤微生物間存在著功能冗余[2]。功能冗余觀點認為,在生態系統中,微生物多樣性的減少幾乎不會對生態系統造成影響,其他微生物可以承擔喪失物種的功能,一個物種的喪失可以由另一物種來替代。但Pierre等[3]通過研究,發現微生物群落組成的變化改變了群落在不同時空尺度上的整體功能屬性,從而提出了不同觀點。
土壤的碳循環是生態系統碳循環的重要組成部分,該過程中有極其豐富的微生物參與,但目前國內外學者對影響土壤碳代謝過程因素的研究多集中于土壤的水溫,土地利用方式和土壤碳氮含量等方面[4- 8],而關于土壤微生物多樣性在土壤碳循環過程中是否存在功能冗余尚未存在明確的結論。因此開展土壤微生物多樣性對土壤碳代謝影響的研究對我們了解土壤固碳微生物的功能及土壤的碳循環過程具有重要意義。本研究采集山西省龐泉溝自然保護區闊葉混交林0—10 cm 處表層土壤為土壤樣品,通過濃度梯度稀釋法改變土壤中原始細菌群落的多樣性,該方法與傳統的人工配置方法相比,可更加真實反映自然土壤生態系統中微生物多樣性減少對土壤碳代謝的影響。經過6周預培養后測定不同稀釋處理下土壤樣本中細菌的豐度及基因多樣性指數(ACE、Chao1、Shannon)。于各土壤樣品中加入等量葡萄糖(0.5 g/100 g干土)繼續培養,期間采用堿式滴定法測定土壤碳礦化速率,利用Biolog Eco板實驗分析不同稀釋處理下土壤樣本中細菌的功能多樣性指數(Shannon指數(H)、Simpson 指數(D)、McIntosh指數(U))及碳源利用模式,通過以上指數綜合分析土壤微生物多樣性對土壤碳代謝過程的影響。
1 材料與方法
1.1 樣品采集及稀釋處理
于山西省龐泉溝自然保護區闊葉混交林(111°22′—111°33′E、37°45′—37°55′N),清除表面覆蓋物,采集0—10 cm 處表層土壤。該樣品土壤類型為褐土,土壤有機碳含量為(26.27 ± 1.87) g/kg,全氮含量為(1.79 ± 0.09) g/kg,pH 為7.26 ± 0.04。將所得的土壤樣品分為兩份放入袋中,一份于4 ℃冰箱保存,一份風干后過 2 mm 孔徑土壤篩。
取已過2 mm 土壤篩的風干土樣進行高壓蒸汽鍋滅菌處理。同時配置不同稀釋梯度的土壤懸濁液:將100 g 新鮮土樣加入盛有300 mL 無菌蒸餾水的三角瓶中,放于恒溫床震蕩搖勻20 min,使土樣與水充分混合,分散菌體,得到100 mL土壤懸浮液,通過梯度稀釋將土壤懸浮液稀釋為10-1、10-3和10-5倍數的土壤懸浮液(D1、D3和D5處理)。將3種稀釋處理的土壤懸濁液接種于滅菌的土壤樣品中,共3個稀釋梯度,每個梯度3個重復,20℃條件下預培養6周,為細菌群落定殖提供時間。
1.2 DNA提取、定量PCR及高通量測序
預培養6周結束后,測定3種處理下土壤樣品中細菌群落的豐度及其基因多樣性。使用Ultra-clean TM土壤DNA分離試劑盒(MoBio Laboratory,USA)從0.25 g土壤中提取各稀釋條件下土壤DNA。通過定量PCR測定土壤細菌豐度,定量PCR的引物、反應體系和條件如下:引物為338F(5′-ACTCCTACGAGGAGCA- 3′)和534R(5′-TTACCGCGGCTGCTGGCAC- 3′),反應體系為20 μL:7.6 μL ddH2O,10.0 μL SYBR?Premix Ex TaqTMⅡ,2.0 μL樣本DNA,PCR條件為:95℃變性10 min;95℃變性30 s,53℃退火45 s,72℃延伸90 s,35個循環。
利用引物341F (5′-CAGACAT (barcode)ACTCCTACGGGAGGCAGCA- 3′)和806R(5′-GGACTACHVGGG TWTCTAAT- 3′)對16S rRNA的V3—V4區進行PCR擴增,并使用Illumina MiSeq平臺對細菌16S rDNA進行雙端測序,隨后在Greengenes數據庫(Release 13.8, http://greengenes.secondgenome.com/)進行基因比對,獲得各稀釋樣品中細菌群落的基因多樣性指數(ACE、Chao1、Shannon)。此處的多樣性指數是指基于分類學的多樣性指標(taxonomic diversity),這些指標在一定程度上反映了群落或生態系統的某些特性,其中,Chao1和ACE指數反應細菌群落的豐富度,指數越大,群落的豐富度越高;Shannon指數綜合反應細菌群落的豐富度和均勻度,Shannon指數越大,群落的多樣性越高[9]。
1.3 碳礦化速率及土壤微生物功能多樣性的測定
由于預培養期間各土壤樣品碳源大量消耗,為進一步探究各細菌多樣性梯度下土壤樣品的碳代謝情況,預培養結束后,于不同稀釋梯度的土壤樣本中加入等量碳源(本實驗選用葡萄糖為碳源),葡萄糖加入量為每100 g干土0.5 g。20 ℃下繼續培養。期間采用堿式滴定法測定3種處理下土壤樣品的碳礦化速率(每隔2 d 測定一次),直到培養期第30 d為止。
Biolog 是一種通過測定微生物對不同碳源利用程度的差異來反映微生物群落的總體活性和代謝功能的方法,該方法在研究空間及時間尺度上微生物群落變化有較好的應用[10-11],故本研究利用該方法進一步研究不同稀釋處理下土壤樣品的碳的代謝強度和代謝活性。將接種好培養期第14天時D1、D3、D5稀釋處理下土壤樣品溶液的測試板加蓋,并于25℃下恒溫培養7 d,每隔24 h在590 nm 下讀取各孔的吸光度值,并根據吸光度數值分析計算3種不同多樣性梯度的土壤細菌群落的孔平均顏色變化率(AWCD)及功能多樣性指數(Shannon指數(H)、Simpson 指數(D)、McIntosh指數(U))以研究土壤微生物多樣性對土壤碳代謝的影響,具體實驗步驟和指數計算公式詳見文獻[11-12]。與上文提到的基因多樣性指數不同,此處的多樣性指數是通過Biolog ECO平板技術測定的孔平均顏色變化率(AWCD)經過計算所得,Biolog ECO平板技術的是利用不同種類的微生物或不同微生物類群對碳源的利用能力不同而產生的不同碳源利用模式來表征微生物群落差異,故用以上3種指數表征細菌群落的功能多樣性。
Biolog ECO平板技術測定的群落功能多樣性指數是利用不同種類的微生物或不同微生物類群對碳源的利用能力不同而產生的不同碳源利用模式來表征微生物群落差異[11]。其中,Shannon 指數(H)可反映土壤微生物群落的種類和均勻度;Simpson 指數(D)可以反應群落中的優勢物種,評估土壤中微生物群落優勢度;McIntosh 指數(U)可用來區分不同的碳源利用程度[13]。
1.4 數據處理
采用Excel 2010 軟件對數據進行初步統計分析;用SPSS 23.0軟件對3種處理下土壤樣品的細菌拷貝數、基因多樣性指數、累積碳礦化量、孔平均顏色變化率(AWCD)、功能多樣性指數進行單因素方差分析(One-way ANOVA)分析,并采用最小顯著差數(Least significant difference,LSD)進行差異顯著性檢驗;用Canoco 4.5 軟件對土壤生物群落31種碳源的AWCD值進行主成分分析(Principal component analysis, PCA),并作圖;用Origin9.0軟件制作文中所有統計圖表。
2 結果
2.1 稀釋處理對土壤細菌群落的影響
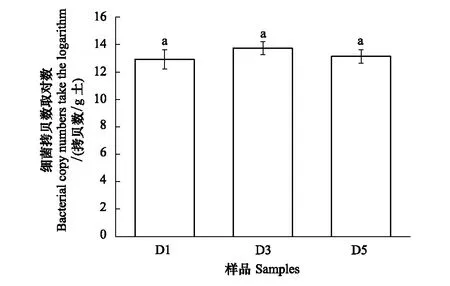
圖1 不同處理下土壤細菌豐度Fig.1 The bacterial abundance in different treatment 相同字母表示無顯著差異(P<0.05); D1:稀釋倍數為 10-1的土壤懸浮液 Dilution1; D3: 稀釋倍數為10-3的土壤懸浮液 Dilution3; D5: 稀釋倍數為10-5的土壤懸浮液 Dilution5
本研究為探明預培養實驗對3種稀釋處理下土壤細菌群落的影響,在預培養6周后,采用定量PCR來定量不同稀釋梯度樣本土壤中細菌群落的DNA拷貝數,用其表征3種處理下土壤樣品中的細菌豐度。結果如圖1所示,預培養結束后,不同土壤樣本中細菌的DNA拷貝數相似,且沒有顯著性差異(P<0.05),這表明經預培養6周后,梯度稀釋處理對微生物豐度的影響基本消除。
通過高通量測序分析不同稀釋濃度下土壤細菌群落的基因多樣性,以探究梯度稀釋處理和預培養實驗對土壤樣品中細菌群落多樣性的影響。采用多種多樣性指數表示不同稀釋處理中土壤細菌物種的豐富度和多樣性的變化,結果如表1所示:除ACE指數外,D1樣本中微生物群落Chao1指數與Shannon指數均高于D3和D5處理,且D1處理顯著高于D5處理(P<0.05)。3種處理下的ACE多樣性指數之間雖無顯著差異(P<0.05),但稀釋倍數最大的D5處理土壤樣品中微生物群落ACE指數最低。由此可以斷定,不同稀釋處理下土壤樣品中微生物多樣性不同,稀釋處理改變細菌群落的多樣性,且預培養實驗并未消除稀釋處理對各樣本土壤中細菌群落多樣性的影響。由此,得到含有有顯著基因多樣性差異但無明顯豐度差異細菌群落的3種土壤樣品(P<0.05),為后期研究提供實驗基礎。

表1 不同土壤樣本基因多樣性指數
不同字母表示有顯著差異(P<0.05);D1:稀釋倍數為 10-1的土壤懸浮液 Dilution1; D3: 稀釋倍數為10-3的土壤懸浮液 Dilution3; D5: 稀釋倍數為10-5的土壤懸浮液 Dilution5
2.2 微生物群落多樣性對土壤碳礦化速率及碳礦化量的影響
為探究3種細菌多樣性條件下土壤碳代謝情況,本研究在預培養實驗結束后,于3種土壤樣品加入等量葡萄糖繼續培養,期間測定并計算培養期0—30 d各土壤樣品的碳礦化速率(圖2)。由圖2可知,整個測量期間,3種稀釋處理下土壤樣品的碳礦化速率總體大小排序為:D1 > D3 > D5,且各處理下每個測量時間點的土壤的碳礦化速率均不同,由此可見各土壤樣品中細菌群落的多樣性持續影響土壤的碳礦化速率。3種稀釋處理下土壤樣品的碳礦化速率變化存在階段性特征,即,D1、D3、D5處理下土壤樣品的碳礦化速率在培養期第2 —4天急劇增長,且出現第一個峰值(約0.4 g mg-1d-1),之后平穩增長;培養期第8 —10天,除D5處理,D1、D3處理下土壤樣品的碳礦化速率開始急劇增長,并出現第二個峰值(約0.8 g mg-1d-1)之后趨于平穩,直到培養期第26 d,D1、D3、D5處理下土壤的碳礦化速率開始下降。
測量結束后,對D1、D3 和D5處理下土壤樣本中30 d的累積碳礦化量做單因素方差分析并做差異性檢驗,結果如圖2。D3、D5處理下土壤樣品累積碳礦化量較D1處理分別降低了3.43 mg/g(17.77%)和1.94 mg/g(10.04%),且D1 處理累積碳礦化量顯著高于D3 和D5 處理(P<0.05);D5處理較D3處理累積碳礦化量降低了1.49 mg/g(8.59%),且D3處理累積碳礦化量顯著高于D5處理(P<0.05)。綜上,土壤微生物多樣性的減少會降低土壤的碳礦化速率及其累積碳礦化量。
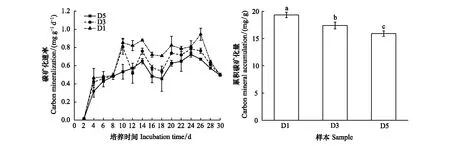
圖2 培養期間土壤碳礦化速率分析 Fig.2 Analysis of Cumulative amount of soil carbon mineralization rate during cultivation不同字母表示有顯著差異(P<0.05)
2.3 土壤微生物利用31種碳源特征分析
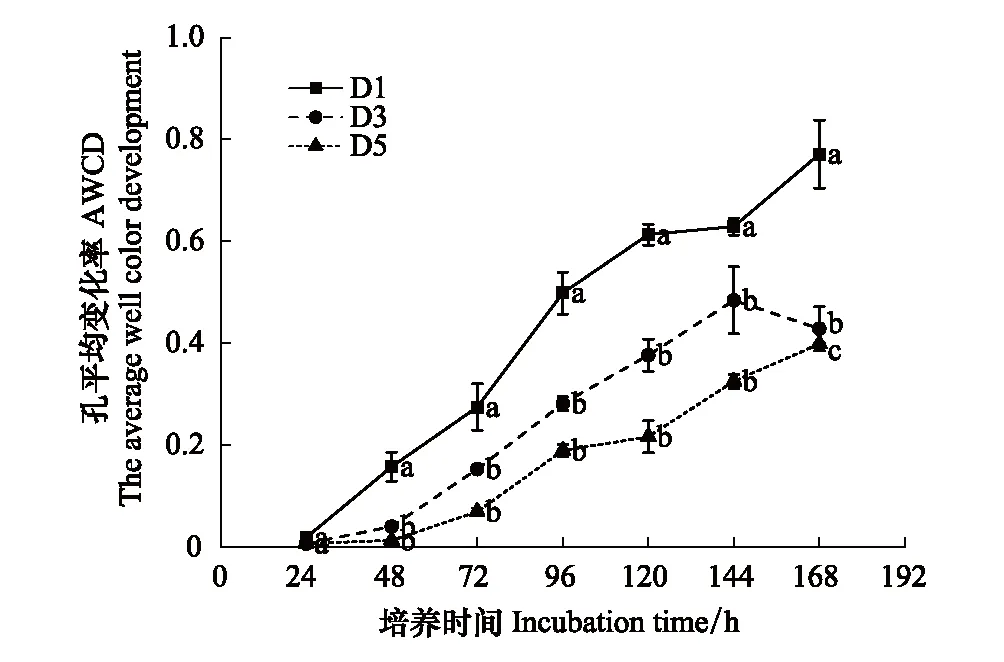
圖3 各稀釋處理下土壤微生物培養過程中平均顏色變化率(AWCD)Fig3 AWCD changes of soil microbial communities in three tested soils不同字母表示有顯著差異(P<0.05)
平均顏色變化率(AWCD) 是表征土壤微生物活性的重要指標,其值的變化可以反映土壤微生物對某一碳源的利用能力,AWCD 值越大,表明土壤中微生物活性越高,對碳源的利用能力越強[14]。對培養期第14天整個測量時間段每隔24 h測定計算的AWCD進行分析,結果如圖3。每一個微板在接種培養期第14天的土壤細菌懸濁液后,隨著時間的延長,其平均吸光值(AWCD)逐漸增加,說明隨著培養時間的延長3種處理下土壤細菌對碳源的利用強度逐漸增強。且D1處理的AWCD值顯著高于D3、D5處理(P<0.05),說明D1處理下的土壤中細菌群落的微生物活性最大,碳源利用效率最高。第14天測量時間段內3種稀釋處理下的AWCD值在24—96 h的斜率最大,表明在該時間段,樣品中微生物生長最為迅速,碳源代謝強度迅速增強;之后各處理的AWCD 增長速率均有所降低且趨于穩定,可見在第14天時采用96 h的吸光值分析更能真實地反映實際情況。
群落功能多樣性指數可以反映土壤微生物群落對不同類型碳源的利用差異,各稀釋條件下培養期第14天時土壤樣品中細菌群落功能多樣性指數如表2所示。與AWCD 相似,D1處理的Shannon指數、McIntosh 指數均最大,且與D3、D5處理均有顯著差異(P<0.05),表明稀釋10-1處理下土壤樣品中細菌群落的物種多樣性、分布的均勻程度及其對源利用強度較10-3、10-5處理高。D3處理的McIntosh 指數和Shannon指數均顯著高于D5處理(P<0.05),但D1、D3、D5處理下的土壤微生物Simpson 指數無顯著性差異(P<0.05),說明10-1、10-3、10-5稀釋處理對土壤樣品細菌群落中的優勢種影響不大。

表2 土壤微生物功能多樣性指數和AWCD
不同字母表示有顯著差異(P<0.05)
2.4 土壤微生物生理碳代謝指紋圖譜分析
研究微生物對微平板上不同碳源利用能力的圖被定義為Biolog 代謝指紋圖譜,其有助于較為全面地了解微生物群落代謝功能特征[12]。測定培養第14天,96 h 3種稀釋處理下土壤微生物對31 種單一碳源的代謝能力(AWCDi值),得到土壤微生物生理碳代謝指紋圖譜(圖4)。由圖4可知,D1處理下的土壤樣品中土壤微生物對31種碳源的利用能力高于D3、D5處理,且3種稀釋處理下的土壤微生物對酯類、碳水化合物類、氨基酸類和胺類碳源的利用能力較強。培養期第14天,土壤代謝指紋圖譜中D1處理下AWCDi≥ 0.8的碳源有8種(酯類3種,醇類1種,酸類1種,氨基酸類2種,胺類1種),占總碳源的64.41%;D3處理下AWCDi≥ 0.8的碳源有1種(酯類1種),占總碳源的9.61%;D5處理下AWCDi≥ 0.8的碳源有1種(氨基酸類1種),占總碳源的11.54%。此外,除碳水化合物類碳源,D1處理下的土壤微生物對其他五類碳源的利用強度遠高于D3、D5處理。D3處理下土壤微生物碳源利用代謝功能與D1相比差異顯著的碳源分別有13種(P<0.05);D5處理下土壤微生物碳源利用代謝功能與D1相比差異顯著的碳源分別有14種(P<0.05);D3與D5處理下土壤微生物對31種碳源的利用代謝功能差異不十分顯著(P<0.05),碳源利用代謝功能有顯著性差異的碳源僅有1種(P<0.05)。說明10-1稀釋處理使土壤微生物對單一碳源的利用能力發生改變,而10-3、10-5濃度的稀釋處理對土壤微生物對單一碳源的利用能力影響較10-1稀釋處理小。
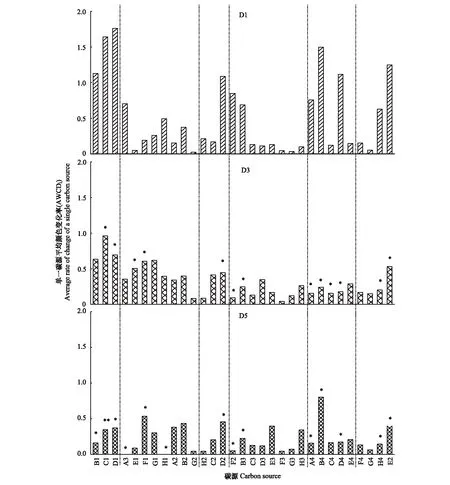
圖4 土壤微生物生理碳代謝指紋圖譜Fig.4 Metabolic fingerprint of carbon level physiological profiles of microbial community B1—A3:酯類;E1—G2:碳水化合物類;H2—D2:醇類;F2—H3:酸類;A4—F4:氨基酸類;G4—E2:胺類;AWCDi值為Biolog板上3次重復的平均值;*標注顯著差異性,P<0.05,“*”代表與D1處理顯著性差異,“**”代表與D1、D3處理均有顯著性差異
2.5 土壤微生物對碳源利用多樣性的主成分分析
采用第14天,96 h的吸光值對土壤微生物群落碳源利用情況進行主成分分析,分析不同稀釋處理下土壤微生物群落功能的綜合差異和相似狀況,結果見表3。從31個因子中共提取了6個主成分因子,累積方差貢獻率達到了95.79%,從中選取累積方差貢獻率達到72.71% 的前兩個主成分PC1 和PC2(特征根分別為15.87和6.67) 來分析微生物群落功能多樣性。
從圖5可以看出,不同稀釋處理在PC 軸出現了明顯的分異,整體可分為3大類,D1處理,D3處理,D5處理各為一類,D1處理分布于Ⅲ區,D3處理分布于Ⅰ區,D5處理分分布于Ⅱ區。可見PC1 和PC2 能區分不同稀釋處理土壤微生物的群落特征。
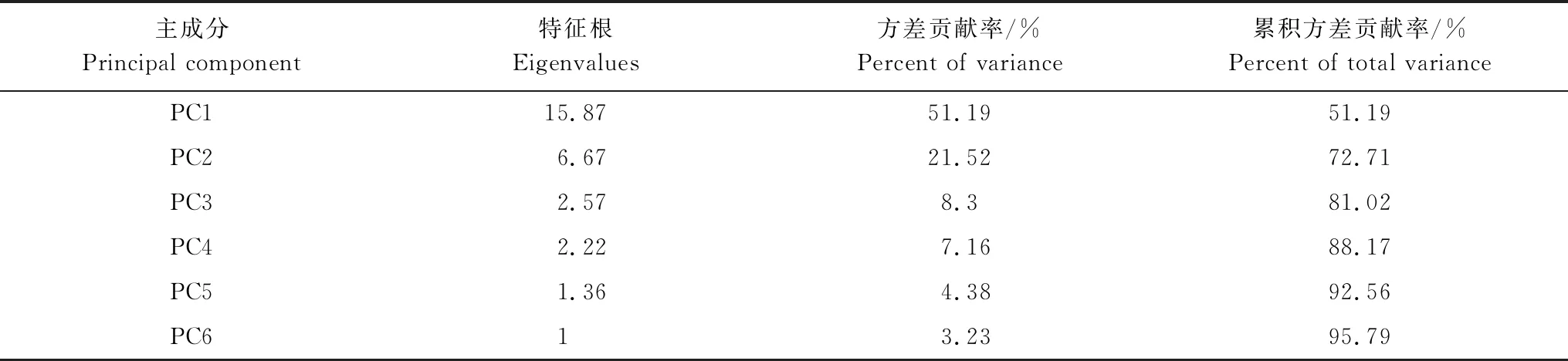
表3 主成分特征根
考慮到各個主成分反應的變異問題,本研究進一步計算了PC1與PC2的綜合得分,結果見表4。不同處理在PC1 和PC2 上得分系數出現顯著差異(P<0.05)。在PC1軸上,D1處理、D3、D5處理均有顯著性差異(P<0.05);在PC2軸上,D1與D5處理無顯著性差異,D3處理與D1、D5處理均有顯著差異(P<0.05);從第一主成分第二主成分的綜合得分來看,D1、D3、D5處理均有顯著性差異(P<0.05)。說明這3種稀釋處理下的土壤樣品中土壤細菌群落具有不同的碳源利用模式,土壤細菌群落代謝功能不同。
考察PCA 的相關性矩陣可知,對前3個主成分貢獻的特征向量系數大于0.60的碳源類型進行分析,結果見表4。培養時間為第14天時,對PC1貢獻大的碳源有19種,其中,碳水化合物類,酯類和酸類均占21.10%,氨基酸類占15.79%。可見影響PC1的主要為碳水化合物,酯類和酸類,其次是氨基酸類;對PC2貢獻最大的碳源為碳水化合物類,占37.50%;其次是氨基酸類,占25%。
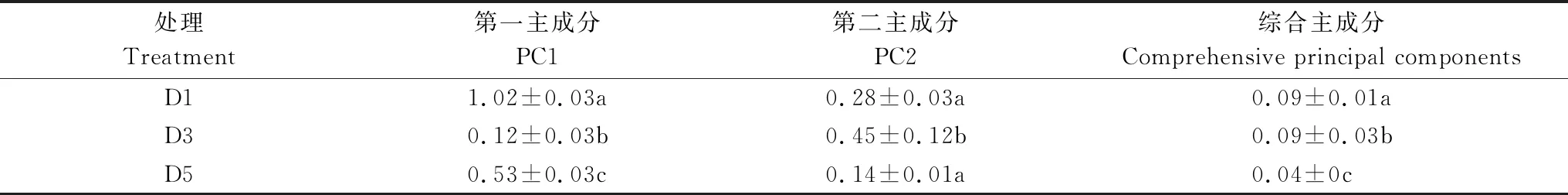
表4 各時間不同處理下主成分得分
不同字母表示有顯著差異(P<0.05)
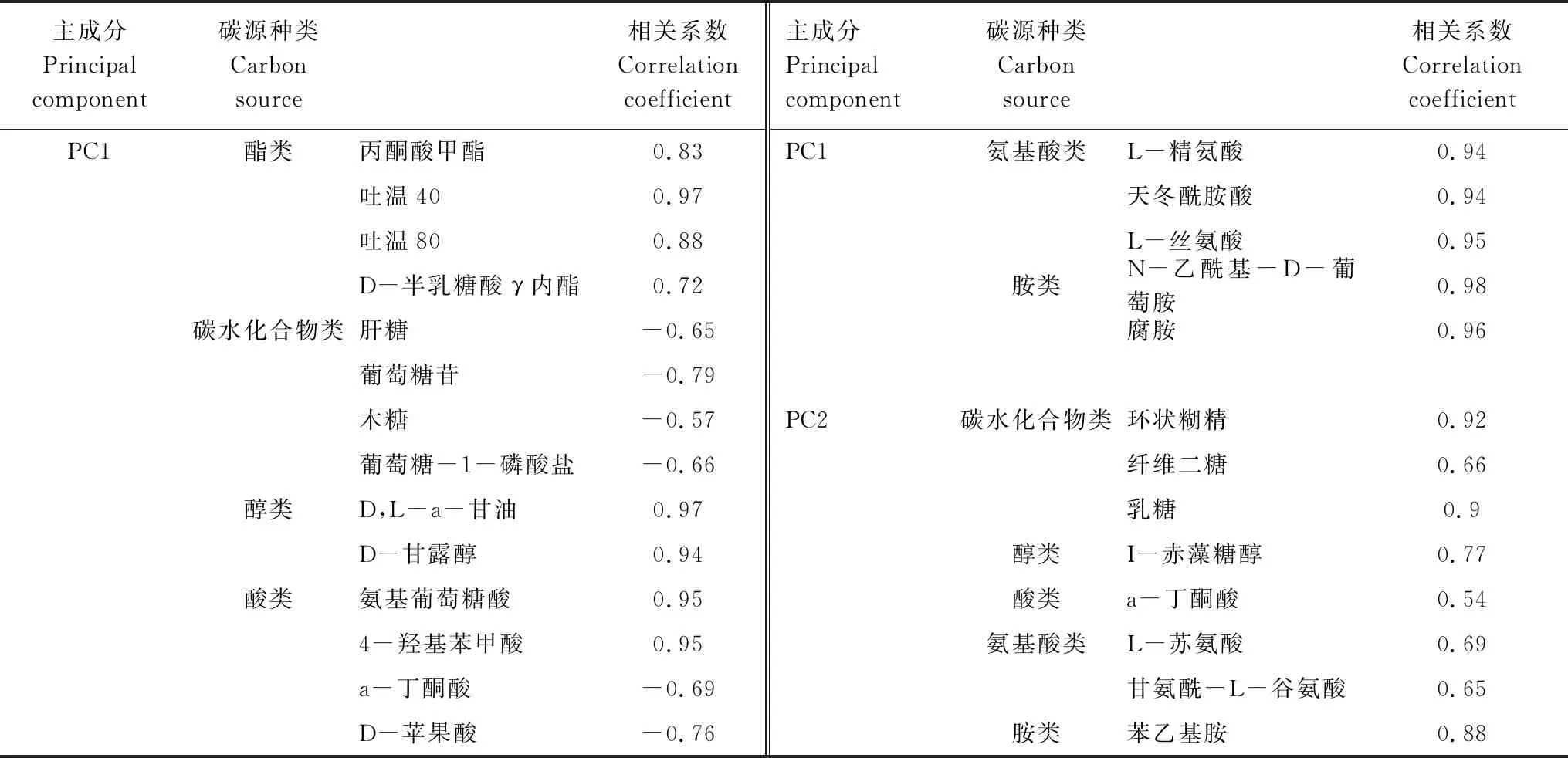
表5 主成分貢獻的特征向量≥0.60 的碳源數目
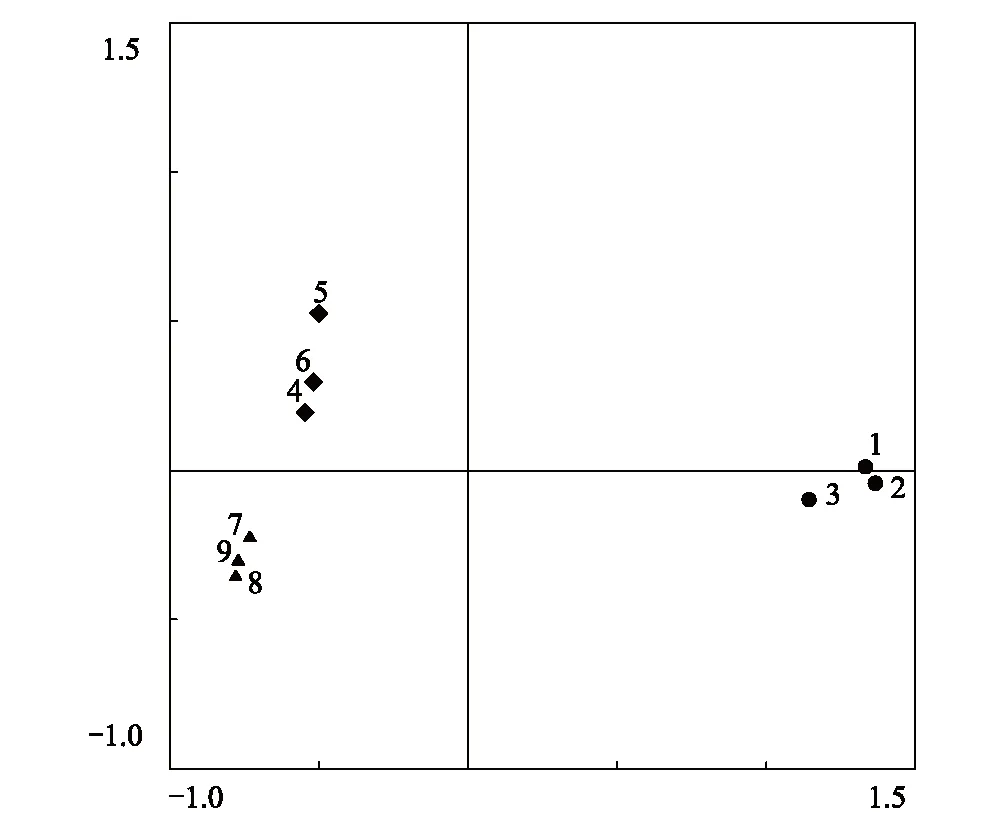
圖5 土壤微生物碳源利用特性的主成分分析(PCA) Fig.5 Principal component analysis (PCA) of carbon utilization of microbial communityD1:1—3,D3:4—5,D5:7—9
3 討論
3.1 微生物群落多樣性對土壤有機碳礦化速率的影響
梯度稀釋的方法經常被用來做微生物分離計數和改變微生物多樣性,該方法理論上可以通過稀釋來減少微生物的豐度和多樣性,移除稀有的微生物類群[15]。Davis等[16]通過梯度稀釋法獲得不同濃度接種物,并且從土壤中分離了許多新微生物種類,由此證實了梯度稀釋法的作用。本研究為了消除因梯度稀釋法接種微生物而造成的微生物豐度差異對后來實驗中土壤碳礦化進程的影響,進行了為期6周的預培養實驗,結果如圖1,培養結束后D1、D3、D5處理下的土壤樣品中細菌豐度無顯著性差異(P<0.05),此結果與Philippot等[17]的實驗結果一致,由此推斷,預培養實驗基本消除了梯度稀釋處理造成的細菌豐度差異。為了評估預培養實驗對D1、D3、D5處理下土壤樣品中細菌多樣性的影響,對預培養結束后3種稀釋處理下土壤樣品中的PCR擴增片段進行高通量測序,結果正如預期的一樣,稀釋處理導致土壤樣品中微生物多樣性整體下降。因此,我們基本可以確定之后實驗中使土壤碳礦化速率變化的原因是由于由梯度稀釋處理造成的土壤微生物多樣性改變而非豐度差異。
土壤微生物作為參與土壤碳循環過程中的至關重要的一部分,其多樣性對土壤碳代謝過程的影響是一個重要課題。為了探究該影響,本研究以土壤碳礦化速率為指標,對土壤微生物多樣性對土壤碳礦化過程的影響進行說明。實驗結果發現,加入碳源以后,3種處理下土壤樣品碳礦化速率大小排序為:D1 > D3 > D5。且3種處理下土壤樣品的碳礦化速率均有其特有變化趨勢,培養前期D1、D3、D5處理下的土壤碳礦化速率均會出現一個峰值,當穩定增長一段時間之后D1、D3處理再次出現礦化速率峰值,D5處理繼續穩定增長,之后時間段3種處理的土壤礦化速率變化基本穩定,直至培養后期開始降低。培養期前的峰值可能是由于,前期碳源的加入產生了激發效應,使易降解可利用的碳迅速釋放,促進了微生物的活性,從而使土壤中的礦化作用顯著增強;培養中期出現的又一峰值可能是因為:在培養中期,土壤中的有機碳得到活化且微生物對較難分解的有機碳及代謝產物利用能力增強,因此出現另一個呼吸小高峰[17- 20]。培養后期可能是由于加入的碳源中,易分解和較難分解的有機碳已被微生物利用,開始轉向難分解部分,微生物對碳源的利用率降低,從而導致土壤的碳礦化速率開始下降。綜上可得,土壤微生物群落多樣性的減少會對土壤的碳礦化速率降低造成影響。另外,在測量結束后,對30 d D1、D3、D5處理下土壤樣品中的累積碳礦化量做差異性分析,結果發現D1 處理顯著高于D3、D5處理,D3處理顯著高于D5處理(P<0.05)。因此,土壤微生物多樣性的減少會降低土壤的碳礦化強度,減少土壤的累積碳礦化量,對土壤的碳礦化作用造成不利影響。
3.2 微生物多樣性對碳源利用特征的影響
AWCD值用以衡量微生物利用不同碳源的整體能力,表征的是樣品中微生物整體碳源代謝利用強度,其值越大表明樣品具有較高的碳源利用能力, 往往也具有較高的微生物豐度[21]。在整個Biolog實驗測量過程中,D1處理下土壤樣品中的AWCD值與D3、D5處理存在顯著性差異,而D3、D5處理之間并無顯著差異(P<0.05)。造成該結果的原因可能是在一定限度內,微生物多樣性的大小會對土壤碳礦化作用產生影響,而當多樣性低于某一程度時,其多樣性的大小對土壤的碳礦化強度影響較為微弱。3種稀釋處理下土壤樣品AWCD值的大小排序為:D1 > D3 > D5,可見與微生物多樣性較低的土壤樣品相比,微生物多樣性較大的土壤樣品碳代謝強度更大。造成該結果的原因可能是因為在許多不同物種的存在下,土壤微生物豐富的多樣性增強了生態位互補效應并促進了微生物之間的相互作用,促使微生物對碳源的利用能力提高,最終使土壤的碳代謝強度增強[22]。由此可見,微生物多樣性減少會降低土壤中微生物對碳源的利用能力,進而減弱土壤的碳代謝強度,影響土壤的碳代謝過程。
功能多樣性指數是綜合反映群落功能的指標,不同的功能多樣性指數可以反映土壤微生物群落組成的不同方面,故將所有的指數結合起來可以綜合全面的分析土壤微生物群落的功能多樣性。從結果看(表2),梯度稀釋處理改變了土壤樣品中微生物群落的McIntash 指數(U)和Shannon指數(H),D1顯著大于D3、D5處理,D3處理顯著大于D5處理(P<0.05),由此可得D1土壤中的微生物群落功能多樣性優于D3、D5處理,D3處理優于D5處理。但對于土壤樣品中微生物的Simpson 指數(D),3種處理之間并無顯著性差異(P<0.05),且3種處理的Simpson 指數(D)大小排序為:D5 > D3 > D1。產生該結果的原因可能是因為多樣性的減少不僅不會影響土壤微生物群落當中的優勢種,反而會降低種間競爭,使優勢種因更加有競爭力而迅速增長,同時優勢物種的定殖會加劇種群中其他微生物物種的生境位置喪失,導致次要物種種群流失,這對微生物群落的物種多樣性減少也有一定的影響,且該影響產生的結果與本實驗結果一致[23]。
主成分分析的結果表明,不同梯度稀釋處理下土壤樣品中的微生物群落功能多樣性差異顯著(P<0.05),PC1 和PC2 可以把D1、D3、D5處理很好地區分開來,其中與PC1 顯著相關的碳源有19種,主要為酯類,碳水化合物類和酸類;與PC2 顯著相關的碳源有6種,主要為氨基酸類和碳水化合物類。從碳代謝指紋圖譜也可發現,D1處理下土壤樣品中的土壤微生物對31 種碳源的利用能力幾乎均大于D3、D5處理,其中D1處理下土壤微生物對酯類(吐溫40、吐溫80)、醇類(D-甘露醇)、酸類(氨基葡萄糖酸、半乳糖醛酸)、氨基酸類(L-精氨酸、天冬酰胺酸、L-絲氨酸)和胺類(腐胺、N-乙酰基-D-葡萄胺)的代謝利用能力顯著高于D3、D5處理,而對碳水化合物類(環狀糊精、肝糖)的代謝利用能力顯著低于D3、D5處理(P<0.05)。造成該結果的原因可能是:稀釋處理過后,D3、D5處理土壤樣品當中利用碳水化合物類碳源的優勢種群迅速定殖,使該土壤樣品中微生物群落對碳水化合物類碳源的利用強度大大增強。由此D3、D5處理下土壤樣品中的細菌群落對碳水化合物類碳源利用強度顯著高于D1處理(P<0.05)。總體說來,D1處理下的土壤微生物群落對31種碳源的總體代謝功能大于D3、D5處理下土壤微生物群落,土壤微生物群落的多樣性減少會對土壤中微生物對碳源的利用強度造成影響。
綜上所述,土壤微生物多樣性的減少會減弱土壤碳礦化過程,降低土壤對碳源的利用強度,進而減弱土壤的碳代謝強度,土壤的微生物多樣性對土壤碳代謝過程有十分重要的影響。
4 結論
(1)梯度稀釋處理可以改變土壤微生物群落的多樣性,并且預培養時間可以基本消除梯度稀釋處理造成的樣本間生物量的差異而不影響其多樣性。
(2)土壤微生物多樣性的降低會使土壤的碳礦化速率減弱,碳源利用強度降低,進而影響土壤的碳代謝過程。

