脫落酸代謝與信號傳遞及其調控種子休眠與萌發的分子機制
宋松泉,劉軍,徐恒恒,劉旭,黃薈
(1中國科學院植物研究所,北京100093;2廣東省農業科學院農業生物基因研究中心,廣州 510640;3中國農業科學院作物科學研究所,北京100081;4懷化學院民族藥用植物資源研究與利用湖南省重點實驗室/生物與食品工程學院,湖南懷化418008)
植物通過長期不斷地進化來調控種子的休眠與萌發,以確保其在不同的自然環境條件下萌發和形成幼苗。休眠(dormancy)是指在合適的條件下種子暫時不能完成萌發[1]。在許多植物中,特別是一年生的種子植物,種子休眠對植物的生存與傳播起關鍵作用,因為它只能使種子在環境條件合適時萌發[2-4]。深休眠阻止種子迅速整齊地萌發,給引種馴化帶來困難,嚴重影響植物的生長發育與產量;相反,在許多禾谷類作物中,例如水稻(Oryza sativa)、小麥(Triticum aestivum)和玉米(Zea mays),由于長期的育種選擇,種子的休眠特性被選擇性地喪失,從而導致收獲前成熟種子在適溫和潮濕的條件下在母體植株上迅速發芽,造成農業生產中產量和質量的巨大損失[5-6]。GUBLER等[6]提出,目前,種子收獲前發芽(pre-harvest sprouting)是禾谷類作物種子和糧食生產中的最大危害之一。
NONOGAKI[7]提出,種子休眠與萌發的激素調控可能是種子植物中的一種高度保守的機制。在許多物種中,脫落酸(abscisic acid,ABA)是種子休眠誘導和維持的正調控因子,種子萌發的負調控因子;赤霉素(gibberellin,GA)和乙烯具有促進種子萌發和拮抗ABA的作用[3,8-9]。高水平的ABA和低水平的GA引起種子深休眠和出苗率降低,而低水平的ABA和高水平的GA則誘導種子提早萌發,也稱為胎萌(vivipary)[4,10-11];然而,這些激素在種子休眠與萌發中的拮抗作用機制仍不夠清楚。
ABA是調控植物許多發育過程包括種子休眠、萌發和幼苗生長,以及控制許多非生物脅迫反應的關鍵因子[12-14]。研究結果證明,ABA在許多物種的種子休眠中起重要作用:外源ABA可以延遲或抑制種子和胚的萌發;在未成熟種子中,內源ABA維持種胚處于發育而不是萌芽過程;收獲前的萌發也與種子中ABA含量較低有關;由ABA生物合成突變、轉基因修飾或者化學抑制所引起的ABA缺乏的種子是非休眠的;ABA生物合成的化學抑制也引起一些休眠種子的萌發;ABA生物合成基因的過表達也會抑制和延遲種子萌發;在吸脹的最初幾個小時,非休眠種子中的ABA含量比休眠種子下降更多[15-17]。ABA在種子休眠與萌發中的作用主要受ABA代謝(包括生物合成和分解代謝)和信號傳遞途徑的調控[12-13,17-19],環境因子對種子休眠和萌發的影響也是通過ABA和GA起作用[20]。然而,許多證據表明GA主要是在種子休眠被解除后起促進萌發的作用,而不是參與解除種子休眠[17,20-21]。本文主要綜述ABA代謝與信號傳遞的研究進展,ABA在種子發育、休眠與萌發中的作用,以及種子休眠基因DOG1(DELAY OF GERMINATION1)和ABA信號組分的關系;此外,我們提出了該領域需要進一步研究的問題,試圖為深入研究ABA調控種子休眠與萌發的分子機理提供新的參考。
1 ABA代謝與信號傳遞
1.1 ABA生物合成和分解代謝
1.1.1 ABA生物合成 ABA的生物合成和分解代謝決定細胞中的ABA水平,從而決定ABA信號的強度[18,22]。在陸生植物中,C40環氧類胡蘿卜素(epoxycarotenoid)是ABA生物合成的前體,是由質體中甲基赤蘚糖醇磷酸(methylerythritol phosphate,MEP)途徑合成的異戊烯二磷酸(isopentenyl diphosphate,IPP)產生的(圖1)。β-類胡蘿卜素生物合成基因的突變體由于缺乏葉綠素表現為多效性的ABA缺乏表型,包括幼苗致死和光漂白(photobleaching)。玉米黃質環氧化酶(zeaxanthin epoxidase,ZEP)催化全反式玉米黃質(all-trans-zeaxanthin)環氧化成為全反式紫黃質(alltrans-violaxanthin)[22]。全反式紫黃質被轉化為9-順式紫黃質(9-cis-violaxanthin),或者被轉化為全反式新黃質(all-trans- neoxanthin)。擬南芥(Arabidopsis thaliana)ABA4催化全反式紫黃質轉化成為全反式新黃質[23]。然而,轉化全反式環氧類胡蘿卜素(all-transepoxycarotenoid)、紫黃質和新黃質形成其相應的9-順式異構體的異構酶仍然不清楚[13]。盡管環氧類胡蘿卜素和紫黃質的9-順式異構體可能是9-順式-環氧類胡蘿卜素二加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)的底物,但9'-順式-新黃質(9'-cis-neoxanthin)被認為是NCED的主要底物[23]。
NCED將9-順式-環氧類胡蘿卜素氧化裂解為黃氧素(xanthoxin)是ABA生物合成的關鍵調控步驟[22]。因此,內源ABA水平的變化與NCED的表達密切相關。在陸生植物中,NCED酶由多基因家族編碼,不同的家族成員在植物發育過程和脅迫反應中起獨特的作用[24]。AtABA2編碼一個短鏈脫氫酶/還原酶,該酶催化黃氧素轉化為脫落醛(abscisic aldehyde)(圖1)[25-26],脫落醛經脫落醛氧化酶(abscisic aldehyde oxidase)轉化為ABA[22]。醛氧化酶的活性需要一個鉬輔因子(molybdenum cofactor,Moco)。因此,Moco生物合成缺陷的突變體也表現出ABA缺乏的表型[27]。
1.1.2 ABA合成代謝抑制劑 ABA是由類胡蘿卜素合成的,類胡蘿卜素生物合成抑制劑能夠降低內源ABA水平。氟啶酮(fluridone)和氟草敏(norflurazon)是八氫番茄紅素去飽和酶(phytoene desaturase)的抑制劑,用這些化合物處理也能降低內源ABA水平;同時由于葉綠素的光氧化引起植物發生漂白(圖1)[28]。去甲二氫愈創木酸(nordihydroguaiaretic acid,NDGA)是一種脂氧合酶的抑制劑,脂氧合酶催化多聚不飽和脂肪酸的脫氧作用(deoxygenation),在受到滲透脅迫的大豆(Glycine max)懸浮細胞中抑制ABA的積累[29]。研究證明,NDGA抑制脂肪的合成和植物生長[30],因此,需要研發更專一的NCED抑制劑。Abamine及其類似物abamineSG是NCED的專一性抑制劑,在擬南芥滲透脅迫處理過程中可抑制ABA的積累和ABA誘導基因的表達,但這些化合物對植物生長沒有負面影響[31-32]。類倍半萜類胡蘿卜素裂解雙加氧酶(sesquiterpene-like carotenoid cleavage dioxygenase,SLCCD)抑制劑13(SLCCD13)阻止擬南芥中由滲透脅迫誘導的ABA積累和抑制ABA反應基因(圖1)[33]。
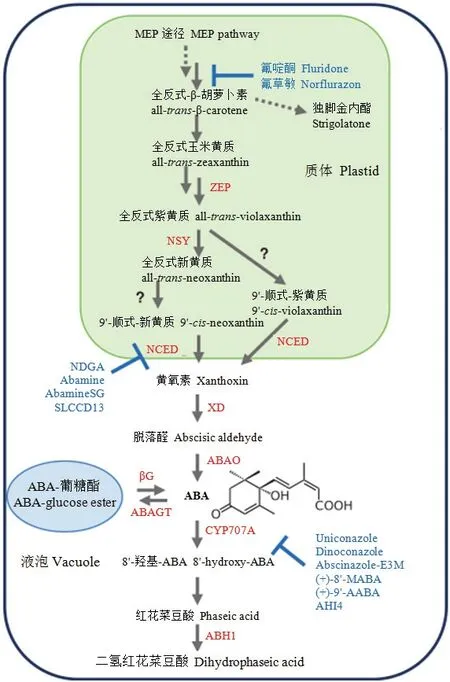
圖1 ABA生物合成和分解代謝途徑(根據DEJONGHE等[13]修改)Fig.1 ABA biosynthetic and catabolic pathways (Modified from DEJONGHE et al.[13])
1.1.3 ABA分解代謝 ABA的分解代謝包括羥基化作用和與葡萄糖結合(圖1),其中,8'-羥基化作用是ABA分解途徑中的關鍵步驟。ABA C-8'位置上的羥基化被CYP707A家族催化,產物8'-羥基-ABA是不穩定的,能自發地異構化成為紅花菜豆酸(phaseic acid,PA)[34-35]。CYP707A家族屬于Cyt P450單加氧酶(monooxygenase),在高等植物中被多基因家族編碼[36],家族中的每一個成員在不同的生理或者發育過程中起作用[37-38]。PA是一種弱的ABA作用類似物[39-40],被PA還原酶轉化成為生物學活性喪失的二氫紅花菜豆酸(dihydrophaseic acid,DPA)。
ABA的羧基(C-1)和羥基及其氧化分解產物是與葡萄糖結合的潛在靶點[18]。ABA葡糖酯(ABA glucosyl ester,ABA-GE)是一種最常見的結合物,被認為是ABA的一種儲存或者遠距離運輸形式[18,22]。葡糖基轉移酶(glucosyltransferase)催化ABA羧基的葡糖基化。ABA-GE被β-葡糖苷酶水解后釋放ABA,從而調節細胞內局部的ABA濃度[22]。
1.1.4 ABA分解代謝抑制劑 影響ABA分解代謝的化合物包括唑類抑制劑(azole-type inhibitor)和ABA類似物(ABA analog),它們作用于Cyt P450單加氧酶CYP707A(圖1)。唑類抑制劑烯效唑(uniconazole)和烯效醇(diniconazole)抑制CYP707A的活性,增加內源ABA水平[41-42]。烯效唑和烯效醇不但抑制CYP707A,而且抑制其他的Cyt P450單加氧酶,對植物的生長發育有負面影響[43]。Abscinazole-E3M選擇性地抑制CYP707A,從而增加內源ABA水平,提高水分脅迫耐性,但對植物的生長影響較小(圖1)[44]。與唑類抑制劑相反,ABA類似物能夠作為專一的ABA分解代謝抑制劑起作用。ABA分解代謝的第一步是CYP707A酶對環上8'和9'甲基的羥基化[18]。ABA類似物(+)-8'-次甲基-ABA ((+)-8'-methylidyne-ABA)和(+)-9'-乙炔-ABA((+)-9'-acetylene-ABA)不可逆地抑制CYP707A活性(圖1),但這些化合物保留了ABA類似物的活性[45]。ABA 8'-羥化酶抑制劑4(ABA 8'-hydroxylase inhibitor 4,AHI4)不表現出ABA活性(例如停滯生長和抑制種子萌發),但強烈地抑制CYP707A活性[46]。
1.2 ABA信號傳遞
核心ABA信號傳遞組分主要由PYR/PYL/RCAR(pyrabactin resistance 1/pyrabactin resistance 1-like/regulatory components of ABA receptor)蛋白、A組2C類蛋白磷酸酶(group A type 2C protein phosphatase,PP2C)、亞類Ⅲ蔗糖非發酵-1-相關蛋白激酶2(subclassⅢ sucrose nonfermenting-1-related protein kinase2,SnRK2)和ABF(ABA-responsive element (ABRE)-binding factor)/AREB(ABRE-binding protein)轉錄因子組成(圖2和圖3)[12-13,19,47-49]。ABA通過與PYR/PYL/ RCAR蛋白中高度保守的氨基酸進行直接的和水介導的接觸,被結合進疏水的配體結合的ABA受體(結合)口袋中。結合口袋(binding pocket)含有類似于一只折疊的手的7個β折疊,以及1個大的和2個較小的α螺旋[50-51]。ABA的結合促進了包含β3和β4之間的一個門環(gate-loop)的構象變化,這種構象變化關閉結合口袋,形成與ABA的接觸。除了PYR/PYL/RCAR12和PYR/PYL/RCAR13分別含有序列-SDLPA-和-SGFPA-外,在所有的PYR/PYL/ RCAR蛋白的門環中都含有序列-SGLPA-[13]。β5和β6含有不變的序列-HRL-,它們之間的第二個“門閂(latch)”環也發生構象改變;這種改變使受體-配體復合物對接和抑制PP2C。PP2C含有一個高度保守的、定位于A組專一識別環中的色氨酸殘基,該殘基能插入到由門環關閉所產生的小口袋中,并與ABA的酮基產生水介導的接觸。這個水分子位于ABA、門的脯氨酸(-SGLPA-)、門閂的精氨酸(-HRL-)和PP2C的色氨酸鎖之間的H-鍵網絡中心(圖2)[12,50,52]。
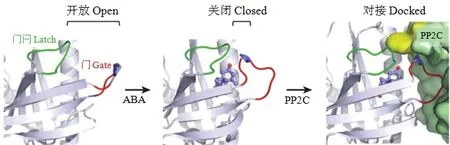
圖2 ABA誘導的受體構象變化(引自CUTLER等[12])Fig.2 ABA-induced changes in receptor conformation (From CUTLER et al.[12])
PYR/PYL/RCAR受體能夠間接地控制亞類ⅢSnRK2的活性,SnRK2在對ABA的反應中磷酸化許多脅迫活化的靶點[53-54]。在對發育信息或者環境脅迫的反應中,當ABA在細胞中積累時,ABA與PYR/PYL/RCAR受體結合,以及觸發受體的構象變化,從而使受體-ABA復合物與PP2C結合并抑制其活性(圖2和圖3)[12]。因而,亞類Ⅲ SnRK2被釋放,SnRK2磷酸化和控制下游因子的活性以激活生理反應。SnRK2的靶點主要有2種類型,包括膜通道蛋白和轉錄因子。膜通道蛋白包括慢陰離子通道1(slow anion channel 1,SLAC1)、擬南芥鉀通道1(potassium channel inArabidopsis thaliana1,KAT1)和NADPH氧化酶呼吸爆發氧化酶同源物F(NADPH oxidase respiratory burst oxidase homolog F,RBOHF),它們是質膜蛋白以及能被SnRK2磷酸化[12,22]。轉錄因子包括含有堿性亮氨酸拉鏈(basic leucine zipper,bZIP)結構域的轉錄因子,例如ABF、AREB和ABI5,它們能夠在ABA誘導的基因啟動子中與ABRE結合(圖3)[12,22]。另外,ABA誘導的基因還可以調控與相容性溶質生物合成、晚期胚胎發生豐富(late embryogenesis abundant,LEA)蛋白和熱休克蛋白(heat shock protein)有關基因的表達,從而增加脫水耐性。ABI5與植物專一的VP1/ABI3轉錄因子結合,可以控制種子休眠[55]。
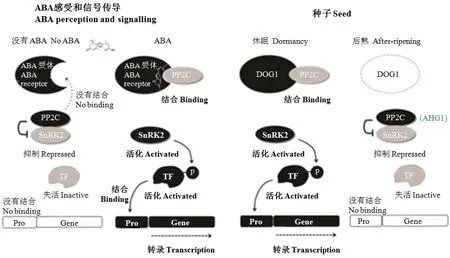
圖3 ABA信號傳遞途徑和DOG1調控種子休眠的新模型(根據NONOGAKI[19]修改)Fig.3 ABA signalling pathway and emerging model of seed dormancy regulated by DOG1 (Modified from NONOGAKI [19])
被子植物的PYR/PYL/RCAR受體分為3個亞家族(Ⅰ、Ⅱ和Ⅲ)[47,56]。亞家族Ⅰ和Ⅱ存在于除苔蘚植物外的所有陸生植物中(苔蘚植物似乎僅僅含有亞家族Ⅰ);亞家族Ⅲ幾乎僅存在于被子植物中[56-57]。大多數亞家族Ⅲ受體形成同源二聚體,它們對ABA的敏感性比亞家族Ⅰ/Ⅱ受體低;而亞家族Ⅰ/Ⅱ為單體,對ABA具有較高的親和性。在擬南芥原生質體中表達不同PYR/PYL/RCAR受體的試驗表明,亞家族Ⅰ和Ⅱ受體介導非脅迫植物中對低水平的ABA起反應,而亞家族Ⅲ受體需要較高水平的ABA來啟動信號傳遞;這些差異與它們具有不同內在的ABA親和力相一致[58]。然而,遺傳分析表明擬南芥受體亞家族之間存在廣泛的冗余,模擬ABA缺失突變體的表型需要去除所有3個亞家族受體[49]。
在擬南芥中,有9個A組PP2C參與ABA的信號傳遞。一些擬南芥PP2C突變體表現出ABA過敏感表型,PP2C的活性被ABA受體選擇性地抑制[58-59]。在A組PP2C中,僅僅ABA過敏感萌發1(ABA hypersensitive germination 1,AHG1)缺乏保守的色氨酸鎖殘基,在受體-配體-PP2C復合物中這個殘基是與ABA的環已烯酮上的氧形成水介導的氫鍵必需的[58-59]。盡管AHG1對ABA受體介導的抑制是抗性的,但在種子萌發分析中ahg1突變體的種子對ABA過敏感,表明AHG1參與了ABA反應[59-60]。
擬南芥中有9個SnRK2,其中3個亞類Ⅲ SnRK2(SRK2D/SnRK2.2、SRK2E/SnRK2.6/OST1和SRK2I/SnRK2.3)被ABA誘導。SnRK2三重突變體在種子萌發、植物生長、氣孔關閉和ABA反應基因表達中幾乎表現出完全ABA不敏感[53,61-63]。因此,ABA的作用是由亞類Ⅲ SnRK2介導的底物(靶)蛋白的磷酸化所觸發,盡管只有少量SnRK2的直接底物被鑒定。野生型或者用ABA處理的SnRK2三重突變體的磷酸化蛋白質組分析鑒定了新的SnRK2候選底物,包括與開花、核苷酸結合、轉錄調控、信號傳遞和葉綠體形成有關的蛋白質[64-66]。此外,SnRK2似乎是一個信號中樞,能夠被多種途徑調控;例如,擬南芥OST1(SnRK2.6)以不依賴于ABA的方式被冷脅迫活化,調節冷誘導的基因表達[67]。另外,被調控的ABA受體和PP2C的蛋白水解、以及受體與不同靶點之間的相互作用已經被報道,表明核心ABA途徑的復雜調控作用[68-71]。
2 ABA在種子發育、休眠解除和萌發中的作用
2.1 種子發育
ABA在種子發育過程中逐漸積累,在種子成熟中后期達到峰值。擬南芥種子成熟中期積累的ABA主要由母體組織(包括種皮)合成[72];在擬南芥和皺葉煙草(Nicotiana plumbaginifolia)中,這種母體來源的ABA有助于胚的發育[73]。擬南芥種子初生休眠的誘導和成熟需要合子組織中合成的ABA,這些ABA在成熟后期積累[74]。擬南芥中有5個NCED,其中NCED6和NCED9在種子發育過程中起促進ABA的積累和誘導休眠的作用[75-76];CYP707A1是種子成熟中期ABA失活的主要同源異構體,而CYP707A2則是成熟后期ABA失活的主要類型[37]。成熟中期(未成熟)的種子分解代謝活性較高,使母體來源的ABA失活。在未成熟和成熟種子中,cyp707a1突變體比cyp707a2突變體積累更多的ABA,但cyp707a2突變體由于種子吸脹后ABA的緩慢下降表現出更強的休眠特性[37]。在大麥(Hordeum vulgare)種子發育過程中和吸脹后,ABA的代謝和敏感性受環境條件調控[16]。
擬南芥哥倫比亞生態型(Col)干種子中大量儲存的mRNA的啟動子富含ABRE,同時也含有豐富的ABI3和ABI4等目標順式元件[77],這些結果表明,在種子成熟后期ABA可能會影響含有這些目標元件的儲存mRNA的組成。
2.2 種子后熟
后熟(after-ripening)是指成熟種子離開母體植株后,需要經過一系列的生理生化變化才能具備萌發能力的一個生理過程。后熟能夠解除許多物種的種子休眠,完成后熟所需要的時間與種子的休眠類型和休眠程度密切相關[78]。許多試驗表明,在禾谷類植物中,后熟不改變干燥種子中ABA的含量或者ABA代謝;而當休眠種子和后熟種子經歷吸脹作用時,ABA含量(或者代謝)發生顯著的變化。剛收獲的成熟小麥和大麥干燥種子仍然是休眠的,其ABA含量與經過3—4個月后熟已解除休眠的種子類似;盡管干燥的休眠種胚和后熟種胚中的ABA含量沒有差異,但后熟種子的萌發時間要比休眠種子短很多[79-81]。在吸脹初期的幾個小時,休眠種子和后熟種子中的ABA含量迅速下降;但在隨后的幾個小時后熟種子中的ABA含量較低,而在休眠種子中保持穩定,在一些品種中甚至增加[16,79-80]。
在大麥種子中,后熟對ABA生物合成基因表達的影響還不明確,但它顯著地增加ABA分解代謝基因HvABA8'OH1的表達。在吸脹的最初幾個小時內,在后熟種子和休眠種子中HvABA8'OH1的表達都增加,隨后降低;然而,在后熟種胚中的表達比休眠種胚中強很多[16,79]。HvABA8'OH2的表達水平在后熟種子和休眠種子的吸脹過程中都非常低;因此,與休眠種胚比較,在吸脹的最初幾個小時,后熟大麥種胚中ABA含量的顯著下降是由于通過增加HvABA8'OH1的表達,從而促進ABA的分解代謝造成的。在吸脹的后熟種子和休眠種子的HvABA8'OH1原位定位顯示,在后熟種胚中,僅僅在胚根鞘(包圍禾谷類種子胚初生根的組織)中檢測到HvABA8'OH1的表達,而在休眠種胚中沒有被檢測到[16]。目前已經發現,胚根鞘在種子休眠的調控中起重要作用,調控的機制可能是基于高水平的ABA阻止胚根鞘的弱化和生長,導致胚根伸長受阻,而增加的ABA分解代謝則可解除這一限制[16,82]。
2.3 種子萌發
種子萌發表現出3個階段的水分吸收。第一階段是由于干種子的被動吸水,其次是少量的水分吸收(第二階段),進一步的水分吸收是與萌發完成和隨后的幼苗生長有關(第三階段)[1]。一系列證據表明盡管在萌發早期階段的ABA含量也起一些作用,但萌發完成前(第二階段后期)種子中的ABA含量是種子萌發的決定因素[17]。
干種子中存留的ABA會在種子吸脹后下降,這在休眠(佛得角群島生態型(Cape Verde Islands ecotype,Cvi))和非休眠(Col)的擬南芥種子中都有發生,主要取決于CYP707A2的活性[16,37,83-84]。在Col和Cvi種子中,CYP707A2在種子吸脹開始后的2—3 h被誘導[84],導致ABA的迅速下降,結果表明與CYP707A2蛋白的從頭合成(de novosynthesis)有關[83]。這種早期誘導能被一些因素例如硝酸鹽[85]、一氧化氮(nitric oxide,NO)[83]和后熟[16]調控。就整個萌發過程而言,雖然休眠的Cvi種子和熱抑制的Col種子在吸脹早期表現出ABA含量下降,但此后會有所增加[86]。
此外,在一些物種中胚的周圍組織(胚乳或者外胚乳和種皮)是胚根伸出的物理障礙[78]。在大麥種子中,這些組織也會引起缺氧,從而抑制ABA的分解代謝和增加對ABA的敏感性[87]。一些物種例如萵苣(Lactuca sativa)、番茄(Lycopersicum esculentum)和擬南芥的胚乳都是由活細胞組成的,它們的弱化對于萌發的完成是必需的。盡管在番茄種子萌發過程中ABA不抑制珠孔端胚乳(micropylar endosperm)內-β-甘露聚糖酶活性的增加[88],但阻止細胞壁降解酶的合成可能是ABA的一個重要功能[89]。研究已經發現,ABA調控細胞壁松弛酶的表達或者活性氧(reactive oxygen species,ROS)的積累,ROS可能氧化細胞壁多糖[78,90]。
3 ABA信號傳遞和DOG1與種子休眠
種子的休眠與萌發不僅與核心ABA信號途徑有關,而且受DOG1-AHG1/AHG3途徑的調控(圖3)[19,91],這兩條途徑在下游組分PP2C產生重疊[19,48,92]。NONOGAKI[19]認為近年來種子休眠研究的突破是在一定程度上揭示了DOG1的生化功能。下面主要介紹該領域的近期進展,包括DOG1對種子休眠的作用,DOG1表達和功能的調控,以及DOG1與ABA信號途徑的關系。
3.1 DOG1對種子休眠的作用
利用擬南芥自然變異的數量性狀位點(quantitative trait locus,QTL)分析已經鑒定了種子休眠的特異位點,包括DOG1[93-95]。DOG1轉錄物在種子成熟階段積累,授粉后14—16 d達到峰值[95],在剛收獲的種子中減少到約20%,在種子吸脹過程中消失[96]。DOG1蛋白也在種子成熟階段積累,但在種子接近成熟時并未降低,故剛收獲的種子含有相對高水平的DOG1蛋白;即使在后熟13周,種子的休眠狀態已經被解除,蛋白水平仍然保持相對較高[96]。因此,在后熟種子中,DOG1蛋白的數量和休眠水平之間缺乏相關性。研究發現,DOG1保持種子休眠特性最重要的是其化學性質而不是數量,在后熟過程中,DOG1蛋白變化成為非功能形式,從而引起種子萌發;事實上,在種子后熟之前和后熟之后,DOG1蛋白的等電點(pI)發生了變化[96]。dog1突變體種子缺乏休眠是由于DOG1主要在成熟階段起作用,在成熟種子中含有的DOG1蛋白可能是其殘留物[96]。
3.2 DOG1表達和功能的調控
DOG1在種子成熟過程中表達,其表達受可變剪接(alternative splicing)[95,97]和可變多腺苷酸化(alternative polyadenylation)的調控[91,98]。DOG1的幾個剪接變體(splicing variant)[95]可產生5種轉錄物變異體(transcript variant,α、β、γ、δ、ε)和3種不同的蛋白(圖4-A)[97];其中DOG1-ε不是一個真正意義上的剪接變體,但是擬南芥發育種子中的主要形式[97];可變剪接可以構成不同功能的蛋白,包括它們的亞細胞定位和增加的休眠潛能。這3種蛋白(α、(β、γ、ε)、δ)都能被轉運到細胞核[97],因此,可以認為DOG1是作為一種調控蛋白以同源二聚體的形式起作用[96-97]。過表達分析結果表明,這3種同源異構體可以誘導種子休眠,且共表達時更為穩定。因此,異源二聚體的形成不能解釋DOG1蛋白具有更好的穩定性。對于DOG1的穩定性,同源異構體共表達的正作用機制尚不夠清楚[91]。當酵母剪接體組分19號復合物相關蛋白1(nineteen complexrelated protein 1)的擬南芥直系同源物(AtNTR1)被突變時,它引起DOG1中內含子保留和外顯子跳躍(intron retention and exon skipping)的主要缺陷。這種DOG1剪接的錯誤能調控種子減少休眠,但這種表型不會由可變剪接本身引起,而可能是這種突變體中DOG1表達水平降低的結果[99]。研究已經發現,轉錄延伸的效率(transcription elongation efficiency)對于DOG1的表達和種子休眠是一種重要的因子[7,100-102],認為AtNTR1是在剪接位點控制著RNA聚合酶Ⅱ(PolⅡ)的作用,并可作為轉錄延伸的校正點(checkpoint)[99]。
產生轉錄變異體的另一種機制是可變多腺苷酸化,在3'端產生不同的轉錄物[98,103]。現已發現可變多腺苷酸化能產生2種形式的DOG1轉錄物——短DOG1(shDOG1)和長DOG1(lgDOG1)[98]。shDOG1終止于近端轉錄終止位點(proximal transcription termination site,pTTS),而lgDOG1可延伸至遠端轉錄終止位點(distal transcription termination site,dTTS)。shDOG1和lgDOG1(第2個內含子/第3個外顯子)的DOG1基因組區域含有一個反義方向的啟動子,它可驅動反義DOG1RNA(antisenseDOG1RNA,asDOG1)的表達[104]。試驗已經證明,從終止子區域(terminator region)的反義RNA表達可能是一種常見的現象[105-106],DOG1中asDOG1的表達可能通過轉錄控制負調控正義DOG1的表達[91]和減少種子休眠[104]。shDOG1與DOG1-ε相同,而lgDOG1包括DOG1-α、DOG1-β、DOG1-γ和DOG1-δ(圖4-A)。在許多物種中,DOG1蛋白的C末端是缺失的或者是不保守的,因此,C末端對于DOG1的功能不是必需的。事實上,shDOG1對于補償dog1突變和恢復種子休眠是足夠的[98]。盡管在已發表的研究結果中關于lgDOG1轉錄本的重要性存在一些分歧,但一致認為由2個外顯子組成的shDOG1是有功能的,是種子休眠所必需的主要蛋白[97-98,104]。
根據編碼的多肽序列,DOG1基因組DNA的第3外顯子區域幾乎沒有保守性。相反,這一區域在DNA水平上是高度保守的,它延伸到內含子2[104]。在DNA水平,DOG1序列的保守性與相同區域蛋白序列的低進化壓力是矛盾的,暗示DOG1基因組區域可能是一個調控長鏈非編碼RNA(long non-coding RNA,lncRNA)的產生位點。事實已證明lncRNA從這個區域(和附近)反義方向表達(asDOG1)(圖4-A)[104];試驗也證實其表達不是假的轉錄噪音,而是被一個轉錄活性啟動子反義方向調控[104]。AsDOG1的表達負影響shDOG1的表達,表明asDOG1是DOG1表達和種子休眠的負調控因子。(正義鏈)DOG1啟動子(dog1-3(T-DNA))、外顯子1(dog1-4(T-DNA))和外顯子2(dog1-1(1 bp刪去))的突變導致減少或者幾乎沒有種子休眠[95,98,104]。相反,外顯子3(asDOG1啟動子)區域(dog1-5(T-DNA))的突變反而增加種子休眠(圖4-A)[98,104],這為asDOG1作為種子休眠負調控因子起作用提供了令人信服的證據。
反義DOG1是一種相對穩定的RNA(半衰期約為46 min)[104],也是典型的調節RNA,因此,asDOG1可能在轉錄后水平依賴于RNA分子。然而,asDOG1表達分析顯示,asDOG1不能反式、但能順式起作用[104];即asDOG1轉錄的產物(RNA分子本身)可能不重要,但轉錄本身的“行為”[107-108]可能是DOG1抑制的原因[104]。研究已經發現,反義表達的共轉錄作用而不是反義RNA分子的轉錄后調控引起轉錄干擾[108]。轉錄干擾可能被不同的機制介導,包括RNA聚合酶不直接結合到啟動子序列上和啟動子競爭(圖4-B)[108-110]。在酵母中,反義介導的轉錄干擾阻斷IME4的轉錄延伸[108,111]。因此,asDOG1的表達可能影響DOG1的轉錄延伸,這是種子休眠的一個關鍵因子(圖4-B)[7,100-102]。由于在種子吸脹過程中DOG1和asDOG1的表達量降低,因此,asDOG1的作用可能被局限在種子成熟階段[104],DOG1蛋白功能的修飾而不是它的轉錄控制對于后熟誘導種子萌發可能是關鍵的[96,112]。asDOG1在種子成熟階段的表達水平可能決定成熟種子的休眠深度,但為了理解asDOG1在種子休眠生物學中的確切作用還有待于進一步研究。
3.3 DOG1與ABA信號傳遞
目前,已經報道DOG1能與AHG1/AHG3和PP2C相互作用[48,92],而AHG1[60]和AHG3[113]是ABA信號傳遞和種子休眠的負調控因子。AHG1(ahg1-5)或AHG3(ahg3-2)的功能缺失突變將增強種子休眠,雙突變體ahg1-5ahg3-2的種子休眠特性增強[92],在ahg1-1ahg3-1雙突變體種子中也觀察到類似現象[48]。這些結果表明,這2個AHG在種子休眠中起冗余的作用。當非休眠突變dog1-2與單一ahg突變的任何一個組合時,雙突變體種子(dog1-2 ahg1-5和dog1-2 ahg3-2)是完全非休眠的[92],這表明DOG1對AHG1和AHG3的拮抗作用。相反,三重突變體dog1-2 ahg1-5 ahg3-2種子像雙突變體ahg1-5 ahg3-2種子一樣仍然是深休眠的[92],表明AHG1和AHG3對DOG1是上位性的(epistatic)。這些遺傳分析表明AHG1和AHG3在DOG1的下游起促進萌發的作用,DOG1通過束縛它們維持種子休眠[19,48]。
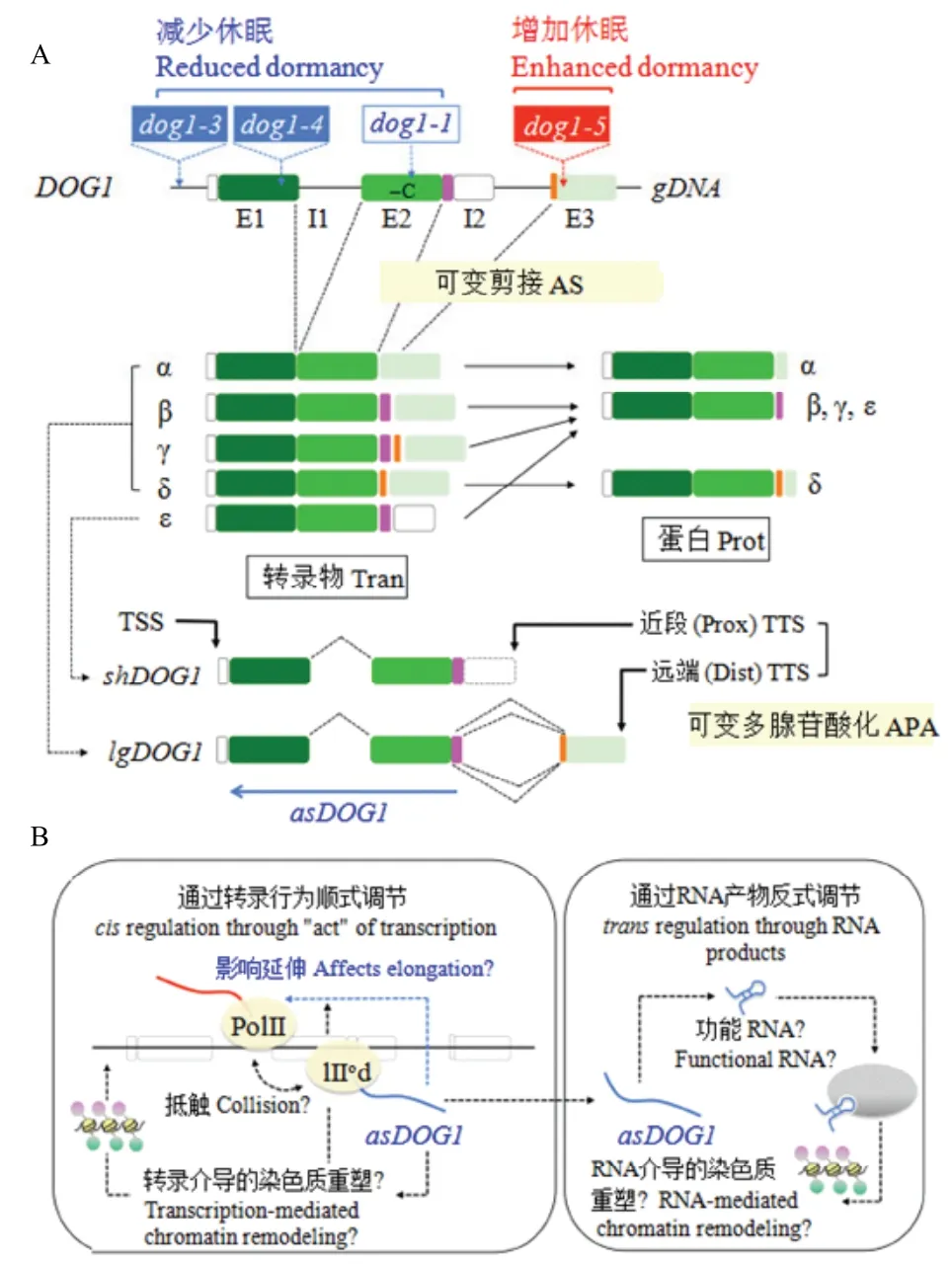
圖4 DOG1表達和功能的調節(引自NONOGAKI[91])Fig.4 Regulation of DOG1 expression and function (From NONOGAKI[91])
AHG1和AHG3的PP2C功能缺失增加種子對ABA的敏感性[48,92]。DOG1被認為通過結合和抑制AHG1和AHG3增加對ABA的敏感性。這種機制類似于ABA感受和信號途徑中通過ABA受體PYR/PYL/RCAR對ABI1亞家族PP2C的抑制(圖3)[12,47,49]。PP2C活性的抑制(ABA受體的主要作用)也在DOG1蛋白中觀察到[48],盡管在不同的實驗室也觀察到一些相互矛盾的結果,這可能是由于在體外試驗中缺失一些因素所致[92]。對于種子休眠,PP2C的失活可能是DOG1功能的一個重要部分。
根據PP2C抑制激酶的典型作用,與種子休眠有關的PP2C的一個顯著特征是AHG1(但不是AHG3)對ABA受體的抑制作用是抗性的[59]。在體外試驗中當激酶與PP2C一起孵育時,激酶的自體磷酸化作用被PP2C抑制;而ABA受體和ABA一起加入到同一反應體系時則抑制PP2C的活性和恢復激酶的自體磷酸化。相反,在ABA和激酶存在下ABA受體和AHG1的共孵育不表現出自體磷酸化,表明AHG1仍然能夠抑制激酶活性,即PP2C對ABA受體的抑制作用是抗性的[59]。AHG1的另一特征表明即使在高水平的ABA存在下,這些種子表達的和與休眠相關的PP2C仍然能夠負調控ABA信號傳遞。這些研究結果表明只要通過這個開放的AHG1窗口,種子萌發程序仍然能夠在含有高水平ABA的發育種子中運行[19]。因此,為了完全暫停萌發程序,必須關閉拮抗ABA抑制的AHG1途徑。DOG1的主要生物學作用可能是阻止AHG1/AHG3途徑以確保種子休眠[19]。DOG1似乎是作為ABA作用的“看門狗(watchdog)”,直到它在種子后熟過程中被化學修飾和失活[19],從而允許種子恢復萌發程序。
另一個種子特異性的ABA信號是DOG1被認為是一種血紅素結合蛋白(heme-binding protein)。血紅素不是DOG1與AHG1相互作用所必需的,AHG1通過DOG1 N端區域中的6個殘基DSYLEW(位置13—18)介導。然而,在DOG1蛋白的His 245和His 249結合的血紅素對于DOG1在種子休眠中的功能是必需的[48]。由于血紅素結合蛋白是作為O2和NO傳感器起作用[114],但至今血紅素怎樣與ABA信號體系相聯系仍不夠清楚。研究發現,種子的氧化還原狀態變化顯著地影響種子的休眠與萌發[112]。NO觸發ABI5的S-亞硝酰化(S-nitrosylation),從而引起萌發抑制因子ABI5的穩定性降低[91,115]。血紅蛋白是一種NO的清除劑以及負影響ABI5的S-亞硝酰化作用,從而穩定ABI5[91];DOG1可能參與了這個過程[19]。
4 展望
ABA是調控種子發育、休眠與萌發以及脫水耐性的重要激素,也顯著地影響種子的產量與質量和幼苗形成[1-2];因此,自1960年以來ABA的代謝、生理作用和信號傳遞就得到了廣泛的研究[12,48,116-117]。盡管近年來這些領域已取得了重要的突破,但仍然有一些重要的科學問題尚不清楚。例如,ABA代謝中ABA被CYP707A家族催化成為8'-羥基-ABA,然后自發地異構化成為PA;ABA葡糖基轉移酶能將ABA轉化成為ABA-GE,作為ABA的儲存池;ABA-GE又能被β-葡糖苷酶水解成為ABA和葡萄糖(圖1)。那么,這些酶及其基因怎樣響應發育和環境變化以維持正常的ABA濃度是不清楚的。
圖3總結了種子中ABA信號途徑的新模型。PYR/PYL/RCAR蛋白與ABA結合,并抑制A組PP2C的活性;PP2C使SnRK2去磷酸化和阻止活性SnRK2的積累;SnRK2又參與bZIP轉錄因子的直接磷酸化;從而負調控ABA介導的轉錄反應[12,19,48]。盡管這個模型能夠解釋核心ABA信號傳遞途徑,但不能解釋ABA生理的許多重要調控因子的作用,包括第二信息[12]。因此,研究已知因子例如Ca2+或者ROS與PYR/PYL/RCAR信號機制的相互關系將是今后的任務之一。此外,DOG1和AHG1/AHG3結合,調控下游組分包括SnRK2和ABI5,組成與核心ABA信號途徑并行的種子休眠與萌發調控系統;這兩條途徑在組分PP2C重疊[19,48,92]。值得注意的是,在整合生理條件或者環境信號時PP2C優先響應哪一條途徑,這兩條途徑怎樣協調,以及PP2C還有哪些新的靶組分都還不夠清楚。
組學(-omics)技術已經應用于種子休眠與萌發的研究[118-120],結合種子ABA生物合成和信號組分突變體,利用相應的專一性抑制劑,構建新的種子休眠與萌發的組學研究體系,包括轉錄組、翻譯組、蛋白質組、代謝組和環境組可能產生一些新的知識和有助于更全面地理解種子休眠的機制。

