水稻花器官發育基因DPS2的鑒定和精細定位
王昌健 陳龍 代麗萍 路雪麗 賀金立 楊龍 胡江 朱麗 董國軍 張光恒 高振宇 任德勇 陳光 沈蘭 張強 郭龍彪 錢前 曾大力
水稻花器官發育基因的鑒定和精細定位
王昌健#陳龍#代麗萍 路雪麗 賀金立 楊龍 胡江 朱麗 董國軍 張光恒 高振宇 任德勇 陳光 沈蘭 張強 郭龍彪 錢前*曾大力*
(中國水稻研究所 水稻生物學國家重點實驗室, 杭州 310006;#共同第一作者;*通信聯系人, E-mail: qianqian188@hotmail.com; dalizeng@126.com)
【】鑒定和克隆花器官發育相關基因,為進一步研究水稻花發育的分子機制奠定基礎。在大田常規種植條件下比較了突變體()和野生型春江06的主要農藝性狀及花器官形態特征差異;掃描電鏡及石蠟切片觀察花藥結構并用染色法觀察花粉和胚囊的育性;利用圖位克隆方法進行基因精細定位;qRT-PCR分析了花發育相關基因在野生型和突變體中的表達水平。突變體抽穗期變長,不能正常揚花,雄蕊和雌蕊皺縮且花藥和柱頭數目增多;進一步研究發現,突變體花藥腔室塌陷,內無可見小孢子,即使部分花藥形成腔室,花粉粒也無淀粉積累呈干癟狀。此外,突變體胚囊育性也受到影響;遺傳分析表明該突變性狀受一對隱性核基因控制,該基因位于第4染色體短臂上91.2 kb的區間內,區間內未見花器官發育相關基因的報道。qRT-PCR檢測發現,水稻ABCDE模型中的B類、C類和E類基因的表達在突變體中顯著升高。突變體的雄蕊及雌蕊均發育異常,最終導致完全不育,推測可能在水稻第3輪雄蕊發育和第4輪雌蕊發育調控中發揮重要作用。
水稻;;花器官發育;基因定位
水稻是重要的糧食作物之一,也是單子葉模式植物,其花器官的形成發育直接影響水稻產量。因此,對水稻花器官發育相關基因的克隆和功能分析不僅有助于進一步認識水稻花發育的調控機理,也具有重要的實踐意義。20世紀90年代初期,學者們通過對金魚草()和雙子葉模式植物擬南芥()大量花器官突變體的研究,提出了經典的花器官發育ABC模型[1, 2]。在ABC模型中,A、B、C三類基因單獨或協同調控萼片、花瓣、雄蕊和雌蕊四輪花器官發育。其中,A類基因()和()單獨調控萼片發育;A類和B類基因()和()協同調控花瓣的發育;B類和C類基因()協同調控雄蕊發育;C類基因單獨調控心皮發育[3]。隨著研究的深入,ABC模型進一步完善并發展成ABCDE模型,其中,D類基因()與C類基因互為冗余地調控胚珠發育;而E類()基因參與調控所有花器官的發育[3, 4]。
研究表明雙子葉植物的ABCDE模型也部分適用于單子葉植物。對于模式植物水稻而言,其小穗由2枚護穎、2朵退化的不育花和1朵可育花構成;可育花由外到內依次由1枚外稃、1枚內稃、2枚漿片、6枚雄蕊和1枚雌蕊共四輪花器官構成。與雙子葉植物相比,水稻B類、C類基因和D類基因在功能上具有一定保守性,但也有部分基因發生了復制和功能分化。在水稻B類基因中,的RNA干涉株系中,其漿片變大,但不影響雄蕊發育[5-6];主要在花粉、絨氈層及柱頭中表達,其RNA干涉株系表現為漿片變成內稃和外稃狀結構,雄蕊變成心皮狀結構,說明主要調控水稻漿片和雄蕊的發育[7];()主要在漿片和雄蕊中表達,在雌蕊中也能檢測到表達,該基因突變導致漿片向內稃狀結構轉變,雄蕊向心皮結構轉變[8],研究表明與、協同調控花器官的形態[9],可能通過介導的調控途徑來參與水稻第2輪漿片和第3輪雄蕊發育[10]。目前在水稻中發現2個C類基因,分別是和,二者都是擬南芥同源基因;其中,只在雄蕊、雌蕊和胚珠原基中表達,該基因突變導致雄蕊向漿片轉變,形成異位漿片,但心皮發育正常[11-12]。在的RNA干涉株系中,其花器官由重復的漿片、雄蕊和心皮狀組織構成,說明主要參與調控花分生組織的決定和心皮的發育[12]。水稻中存在2個D類同源基因,即和。主要在胚珠中表達,特異調控胚珠的發育,該基因突變導致雌性不育[13-14];主要在發育的種子中表達,在胚珠中不表達,突變后其胚珠發育正常,說明可能不參與胚珠的發育調控[14]。此外,水稻中可能的E類基因有、、、、和。突變導致小穗內、外稃呈葉狀,漿片伸長,雄蕊數目減少,心皮數目增加[15]。突變后小穗內稃結構和心皮發育異常,花分生組織特征缺失。和雙突變體植株的突變表型更加嚴重,二者協同調控水稻花器官形態[16]。另外,和都可以與互作,這兩個基因在花分生組織、雄蕊和雌蕊中都有表達,在功能上具有冗余性,突變后雄蕊數目增加,心皮發育異常[17]。
除了用ABCDE模型來解釋花器官發育的機制外,有研究表明其它基因也能影響花器官的發育,如花器官發育過程中參與調控花器官數目的基因(),包括[18]、[19]、[20]、[21]和[22],在水稻中這些基因的突變導致雄蕊或雌蕊數目不同程度的增加。而且,這5類基因的上游或下游調控因子也在花器官發育過程中發揮著重要的作用[23]。研究并克隆這類基因將有助于闡明水稻花器官發育的分子機理,為提高水稻產量、品質和挖掘水稻潛在的種質資源奠定基礎。
本實驗室從春江06和TN1構建的代換系中獲得了一個能穩定遺傳的、花器官發育異常并完全不育的突變體。該突變體表現為小穗雄蕊和雌蕊結構發育異常,且部分小穗的花藥和柱頭數目增加。為明確導致突變體表型特征和花器官發育異常的分子機制,我們對突變體進行了形態學觀察和組織學分析;通過圖位克隆的策略精細定位了水稻基因;結合實時熒光定量PCR分析了花器官發育相關基因在野生型和突變體中的表達差異。
1 材料與方法
1.1 試驗材料
在春江06和TN1的代換系中發現一個能穩定遺傳的不育株系,將該突變體命名為。由于突變體完全不育,以雜合體形式保存種質資源。供試材料種植于中國水稻研究所杭州富陽和海南陵水實驗基地。
1.2 植株和穎花形態觀察、花粉育性鑒定
抽穗期開始在田間觀察鑒定并標記不育植株,取突變體及其野生型的成熟小穗,在解剖鏡下觀察花器官形態和數目并做統計。在當日開花前,取突變體和野生型的穎花,每株3個重復,體視鏡下剝離花藥,1% I2-KI染色鏡檢,拍照并統計花粉敗育數目。
1.3 愛氏蘇木精染色法觀察胚囊育性
在水稻胚囊成熟期取植株小穗,FAA固定液固定24 h后,用50%乙醇沖洗2次,體式鏡下分離出子房,并以梯度酒精(50%、30%)和蒸餾水復水,然后用2%的硫酸鋁鉀染色20 min,愛氏蘇木精染液染色30 min,水洗3次,梯度酒精(30%、50%、70%、80%、90%、無水乙醇)脫水。用無水乙醇和水楊酸甲酯等體積混合液浸泡4 h,水楊酸甲酯透明20 h,最后將子房置于載玻片上,并用LEICA熒光顯微鏡觀察、拍照。
1.4 花藥和花粉粒的掃描電鏡觀察
用尖頭鑷子剝出野生型和突變體花藥,立刻置于2.5%戊二醛固定液中,使用真空抽氣泵抽真空使材料沉到固定液底部,室溫下固定2 h,4℃下固定24 h。0.2 mol/L磷酸緩沖液(pH=7.0)漂洗3次,依次經過30%、50%、70%、80%、90%的梯度酒精脫水各10 min,無水乙醇脫水兩次,每次20 min。于乙酸異戊酯中置換25分鐘后CO2臨界點干燥,真空鍍膜后在掃描電鏡上選用不同倍數觀察、拍照。
1.5 花藥的石蠟切片觀察
取野生型和突變體幼穗和成熟小穗,立即置于FAA固定液中4℃下固定24 h,5%氫氟酸軟化7 d,經乙醇梯度脫水、二甲苯透明、浸蠟、包埋、脫蠟、切片(厚度為10 μm),1%番紅和1%固綠染色,梯度乙醇復水,中性樹脂封片后,在LEICA熒光顯微鏡下觀察和拍照。
1.6 遺傳分析和定位群體構建
用雜合體分別與日本晴和9311配制雜交組合,雜交獲得F1種子并分單株全部收種,將F1種子按單株播種,每株系種約100株,構成數個小F2群體。于成熟期調查每個小群體,觀察并統計是否出現育性分離,把育性分離株系的F1種子全部播種得到大的F2群體,觀察并分別統計F2分離群體中正常表型個數和表型個數,計算分離比。所有實驗材料于2018年及2019年種植在中國水稻研究所杭州試驗基地和海南陵水試驗基地。用雜合體和日本晴雜交產生的能分離的F2株系作為定位群體,從F2群體中選取成熟期表現不育性狀的單株(共2353個)進行基因定位。
1.7 DPS2的基因定位
利用本實驗室保存的250對均勻分布于12條染色體上的InDel標記,根據混合分析法,對野生型、突變體、F1及混池(30個突變體表型單株等量混合)進行基因型鑒定及連鎖分析。參考初定位區間內日本晴和CJ06的全基因組序列,用Primer premier 3.0 在線網站設計新的InDel和dCAPS標記進行精細定位(表1),PCR產物用4%瓊脂糖凝膠電泳和8%聚丙烯酰胺凝膠電泳檢測。
1.8 花器官發育相關基因的表達分析
用AXYGEN公司的植物RNA小量提取試劑盒,按照說明書步驟分別提取野生型和突變體0.5 ~1 cm幼穗的總RNA。反轉錄使用TOYOBO公司的ReverTra Ace quantitative PCR RT Master Mix試劑盒,步驟參照試劑盒說明書。qPCR體系(20 μL)為包括cDNA 2 μL,正、反向引物(10 μmol/L)各1 μL,SYBR qPCR Mix 10 μL,蒸餾水6 μL。反應在Bio-Rad PCR儀上進行,反應程序如下:95℃下4 min,95℃下30 s,60℃下1 min,40個循環,12℃下保存。水稻(LOC_Os01g22493)基因作為內參,正向引物序列為5′-CTCGCCGACTACAACAT CCA-3′,反向引物序列為5′-TCTTGGGCTTGGTGT ACGTCTT-3′。每個樣品設3次重復,采用2-法分析基因相對表達量[24]。

表1 部分實驗引物
2 結果與分析
2.1 dps2突變體的表型鑒定
突變體在營養生長期與野生型春江06相比在植株形態上沒有明顯差異(圖1-A、B),但其抽穗期比野生型晚約5.5 d(圖1-E),野生型開花時突變體未能正常開花(圖1-C~D)。在成熟期,野生型春江06能正常灌漿結實,而突變體小穗穎殼顏色逐漸變黃但無籽粒形成(圖1-F~I),自然結實率為0%,顯著低于春江06(92.7%,圖1-J)。
2.2 dps2突變體雄蕊發育異常
觀察野生型和突變體的成熟穎花,發現野生型小穗花藥數目為正常的6枚,花藥飽滿呈黃色,花絲正常伸長(圖2-A),而突變體的6枚花藥全部皺縮(圖2-B)或表現出不同程度的皺縮(圖2-C),花藥透明呈淺黃色,約10%突變體小穗花藥數目增多,多至7~12枚(圖2-D)。利用掃描電鏡觀察野生型和成熟花藥及其外壁,發現野生型花藥具有4個花藥室,表皮細胞均勻分布且結構規則(圖2-E),而花藥短小皺縮,花藥腔室發育不完整,表皮細胞褶皺(圖2-F),野生型花藥外壁表面飽滿并由線狀物質構成(圖2-G),而突變體外表面光滑且沒有蠟質和角質等線狀物質分布(圖2-H)。進一步用碘染法觀察野生型和突變體的花粉活性,結果顯示,野生型98%的花粉粒能被染成深色,育性正常(圖2-I),而突變體以典敗型花粉為主,只有約5%的花粉能正常染色(圖2-J)。
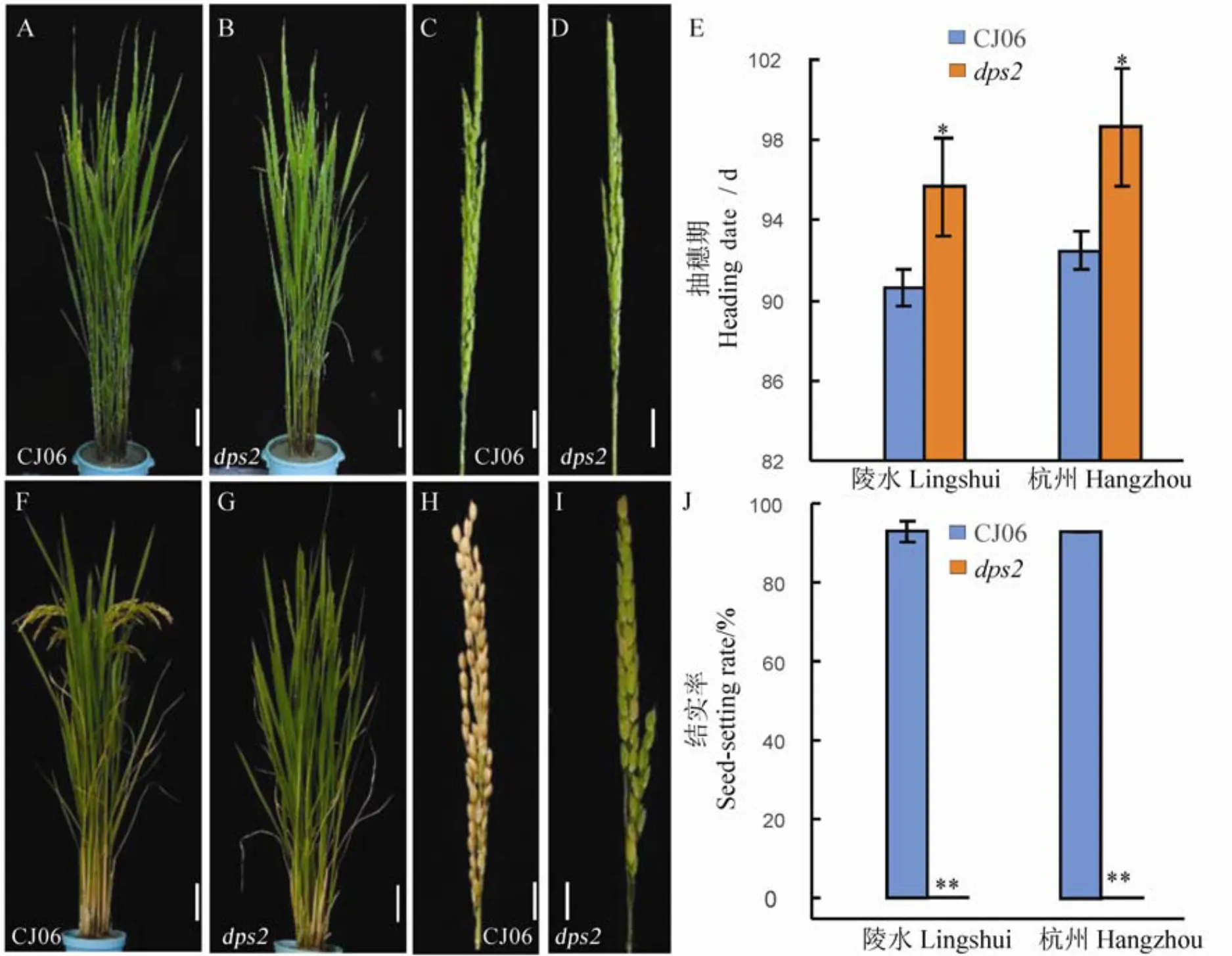
A, B?抽穗期植株; C, D?抽穗期穗部表型; E?在海南陵水和浙江杭州的抽穗期; F, G?成熟期植株; H, I?成熟期穗部表型, J?在海南陵水和浙江杭州的結實率。誤差線表示3次獨立實驗的標準差。*和**分別表示野生型與突變體間差異達0.05和0.01顯著水平(t檢驗)。在A, B, F, G圖中,標尺為10 cm; C, D, H, I標尺為2 cm。CJ06?春江06。
Fig. 1. Phenotypic comparison ofmutant and wild type CJ06 at heading and maturity stage.

A?野生型去除內外稃的穎花; B~D?突變體dps2去除內外稃的穎花; E?野生型花藥; F?dps2花藥; G?野生型花藥外壁; H?dps2花藥外壁; I?野生型花粉鏡檢; J?dps2花粉鏡檢。lo?漿片; An?花藥; F?花絲。A~D圖中標尺為1 mm, E, F標尺為100 μm, G, H標尺為10 μm, I, J標尺為50 μm。
Fig. 2. Stamens phenotypic observation of wild type Chunjiang 06(CJ06) andmutant.
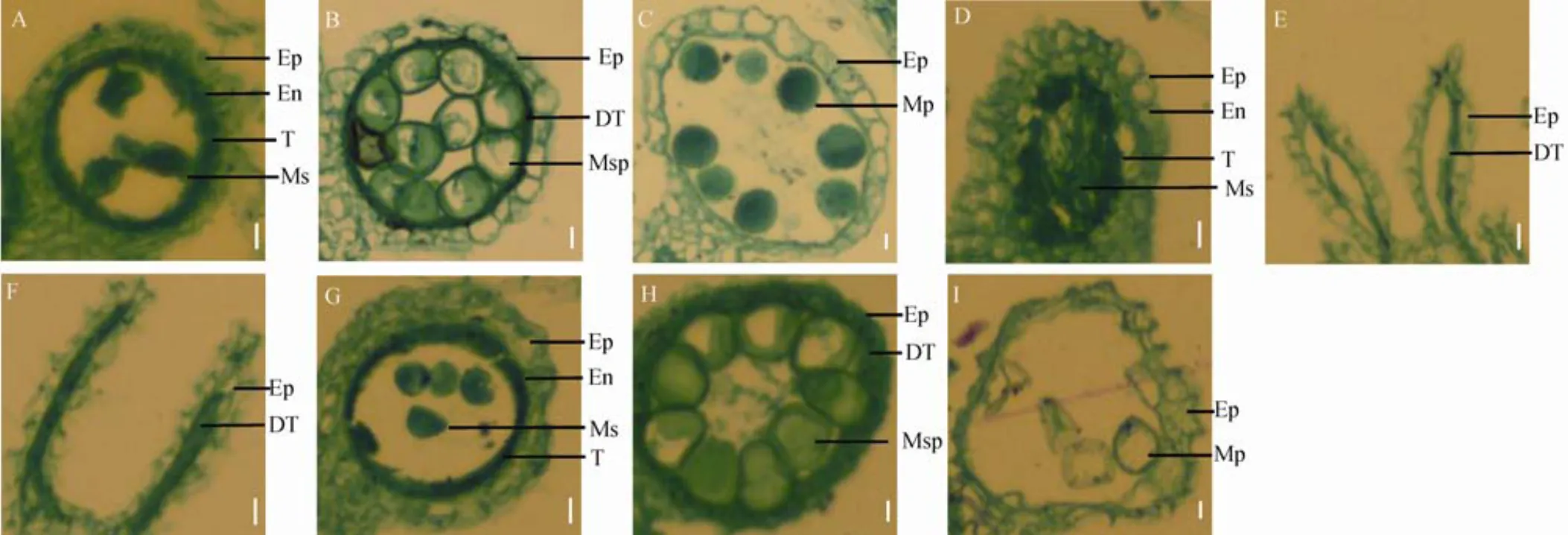
A到C為野生型; D到I為突變體dps2。A, D和G?花藥發育第9時期花藥橫切面; B, E和H?第10時期花藥橫切面; C, F和I?第12時期花藥橫切面。Ep?表皮層; En?內皮層; T?絨氈層; DT?退化絨氈層; Ms?小孢子母細胞; Msp?小孢子; Mp?成熟花粉。標尺為10 μm。
Fig. 3. Transverse section of anthers ofmutant and wild type Chunjiang 06(CJ06) at different stages.
2.3 dps2突變體花藥及花粉的發育過程
通過花藥橫切來比較野生型和突變體花藥及花粉粒發育過程。張大兵等[25]將花藥發育過程分為14個時期。結果表明,在花藥發育第9時期,野生型藥室飽滿呈圓形,小孢子正常被釋放到藥室中,絨氈層濃縮,中間層完全消失(圖3-A);而在相同時期的突變體花藥中,藥室發育成橢圓形,絨氈層不規則分散且包裹了小孢子(圖3-D)。在第10時期,野生型小孢子液泡化成圓形,絨氈層細胞基本降解呈帶狀(圖3-B),而突變體花藥空腔進一步縮小,內部無可見小孢子(圖3-E)。第12時期,野生型的花粉粒發育成熟,絨氈層完全消失(圖3-C),而突變體花藥室完全塌陷(圖3-F)。此外,我們觀察到未完全皺縮的花藥在第9時期具有正常的花藥腔室,內含小孢子母細胞(圖3-G),在第10時期小孢子液泡化后呈圓形,到第12時期,即使花藥外表皮細胞皺縮,腔室內部分花粉粒發育飽滿呈圓形,多數花粉粒干癟內無淀粉積累(圖3-I)。
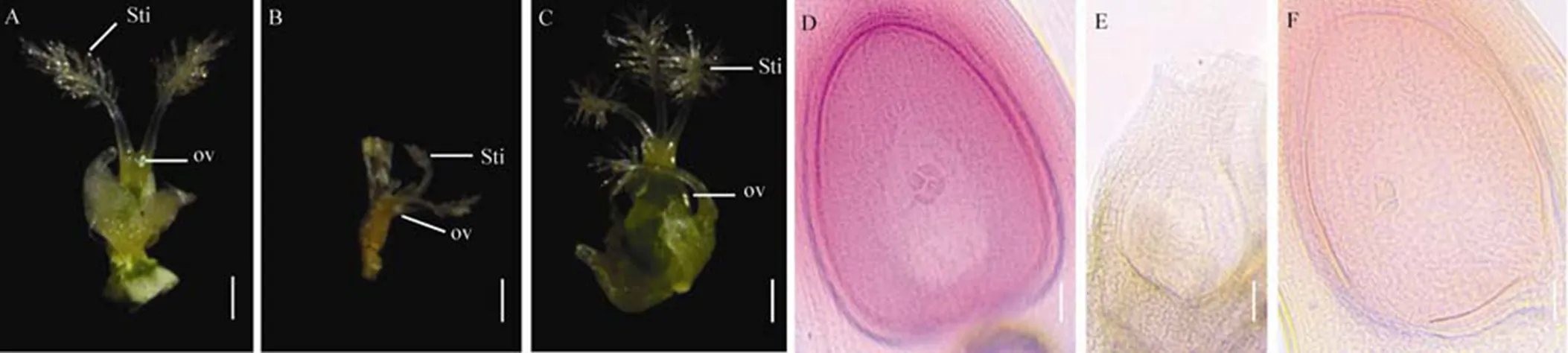
A?野生型春江06的雌蕊形態; B, C?突變體dps2的雌蕊形態; D?春江06胚囊鏡檢; E, F?突變體dps2胚囊鏡檢。Sti?柱頭; ov?子房。在A~C圖中,標尺為1 mm;在D~F圖中,標尺為50 μm。
Fig. 4. Pistils phenotypic observation of wild type Chunjiang 06(CJ06) andmutant.
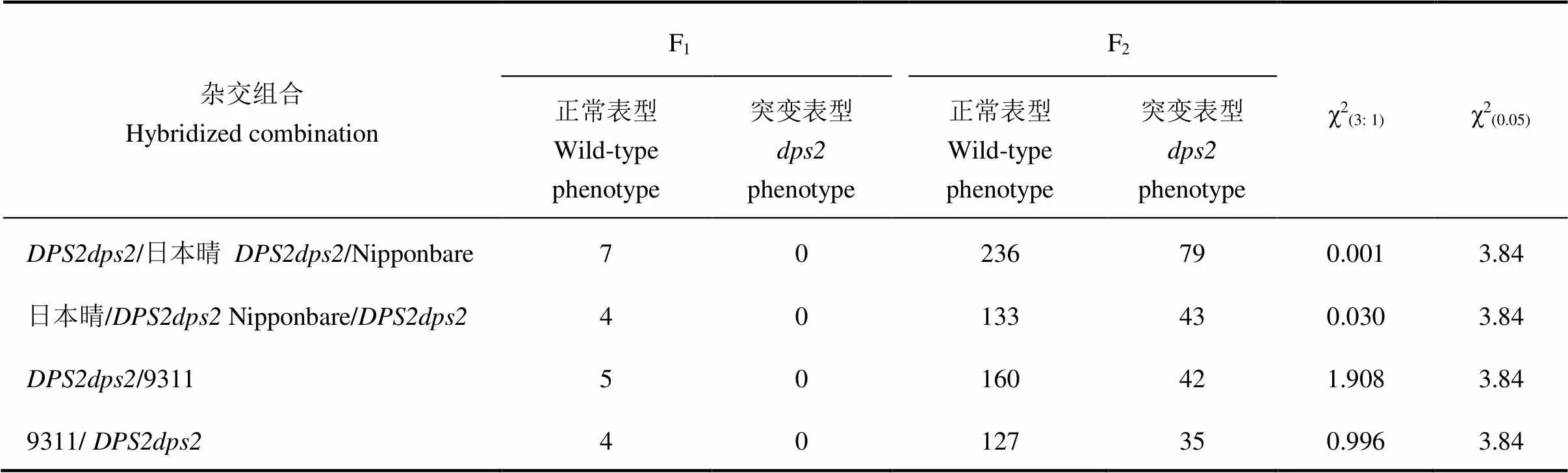
表2 dps2突變位點的遺傳分析
2.4 dps2突變體雌蕊發育異常
突變體有育性正常的花粉粒卻表現為完全不育,因此,我們觀察突變體雌蕊發育是否受到影響。結果表明,野生型雌蕊有2枚柱頭和1個子房,二者發育正常(圖4-A),但突變體柱頭和子房皺縮(圖4-B),部分突變體雌蕊的柱頭數目增至2~4枚(圖2-C)。透明法觀察胚囊育性發現,野生型發育成四核胚囊,胚囊壁正常加厚,助細胞和反足細胞消失(圖2-D),而突變體內胚囊中央無極核結構并出現細胞退化的痕跡(圖2-E)。此外,我們在突變體中觀察到胚囊中央有兩個細胞核組成的極核結構,助細胞和反足細胞均消失(圖2-F)。這說明突變體具有胚囊敗育的特征,但也可能存在育性正常的胚囊。
2.5 突變體遺傳分析
由于突變體植株雄蕊和雌蕊都發育異常,且突變體完全不育,以代換系中分離出的雜合體和常規粳稻日本晴及秈稻9311配制雜交組合,育性調查結果表明,所有組合的F1植株均表現為可育,在F2群體中發生育性分離。經卡方檢驗,育性性狀的分離符合3∶1的分離規律(χ2<3.84, 表2)。這表明該突變性狀由單基因隱性核基因控制。
2.6 DPS2基因的初定位和精細定位
利用均勻分布于12條染色體上的250對多態性標記,對野生型、突變體、F1及混池(30個突變體表型單株等量混合)進行基因型鑒定,將基因界定在位于第4染色體上的BY4和BY19標記之間(圖5-A)。進一步擴大定位群體,用DNASTAR和Primer 3.0在該連鎖區間里開發InDel和dCAPS標記,最終利用F2群體中的2353個突變體表型植株將目的基因定位在BY6-2和BY7-3標記之間,物理距離為91.2 kb(圖5-B)。根據水稻基因組數據庫(Rice Genome Annotation Project)中的基因注釋,該區間內共有12個基因,包含有表達蛋白、轉座子蛋白、C2H2鋅指蛋白等(表3)。
2.7 花藥發育相關基因的表達分析
突變體的雄蕊和雌蕊發育異常,利用實時定量PCR比較了野生型和突變體中花器官發育相關基因的表達量。這些基因包括花器官數目相關的、、基因,生長素調控相關的、基因,以及MADS-Box家族中參與雄蕊和心皮發育的3類基因。結果表明,與花器官數目相關的基因和在野生型和突變體中均未檢測到表達,基因在突變體中的表達量顯著升高;與生長素調控相關的基因、在野生型和突變體中同樣未檢測到;與野生型相比,MADS-Box家族中的B類基因、、,C類基因、和除了、外的E類基因、、、在中均顯著上調表達(圖6)。結果表明,以上花藥發育相關基因的表達量在中上調,這很可能導致花器官發育缺陷。
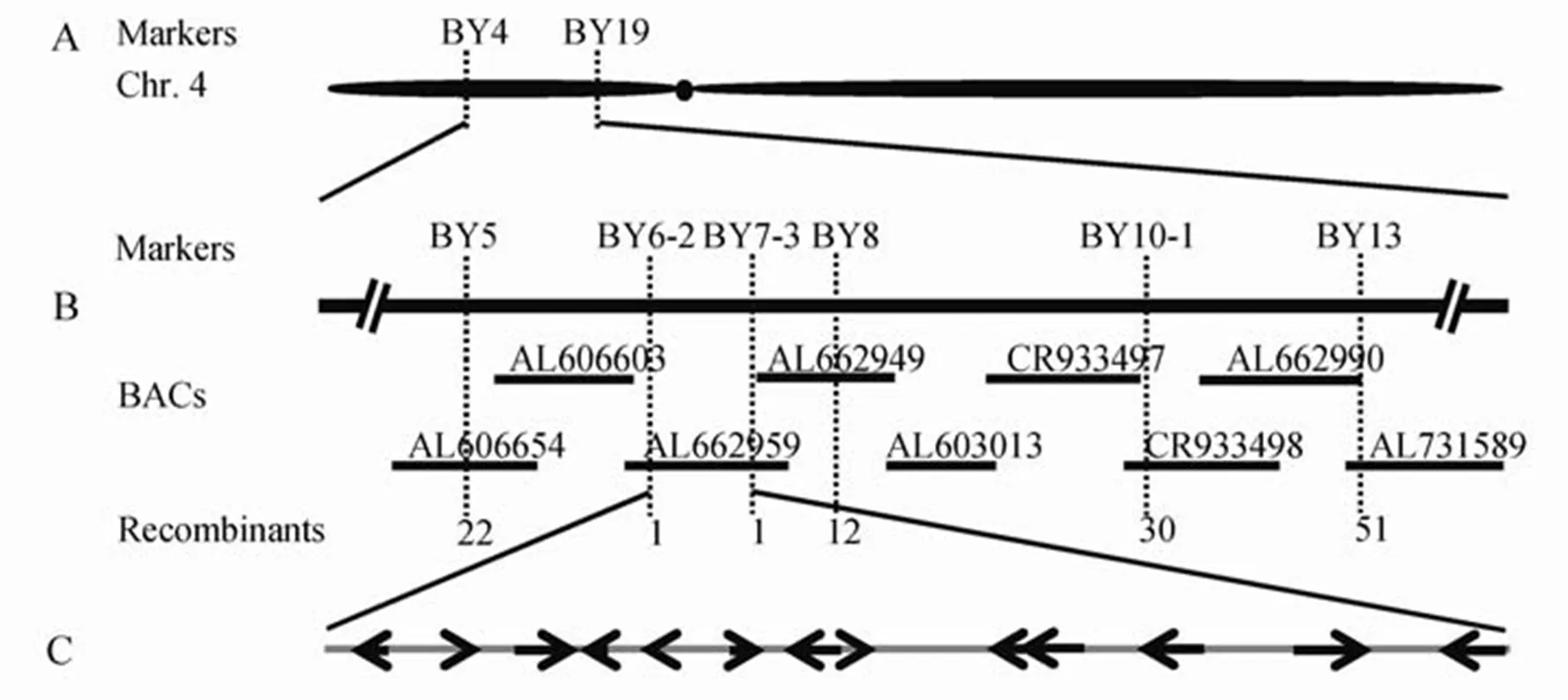
A?突變基因的初步定位; B?突變基因的精細定位; C?標記BY6-2和BY7-3區間內開發閱讀框。
Fig. 5. Location ofon rice chromosome 4.
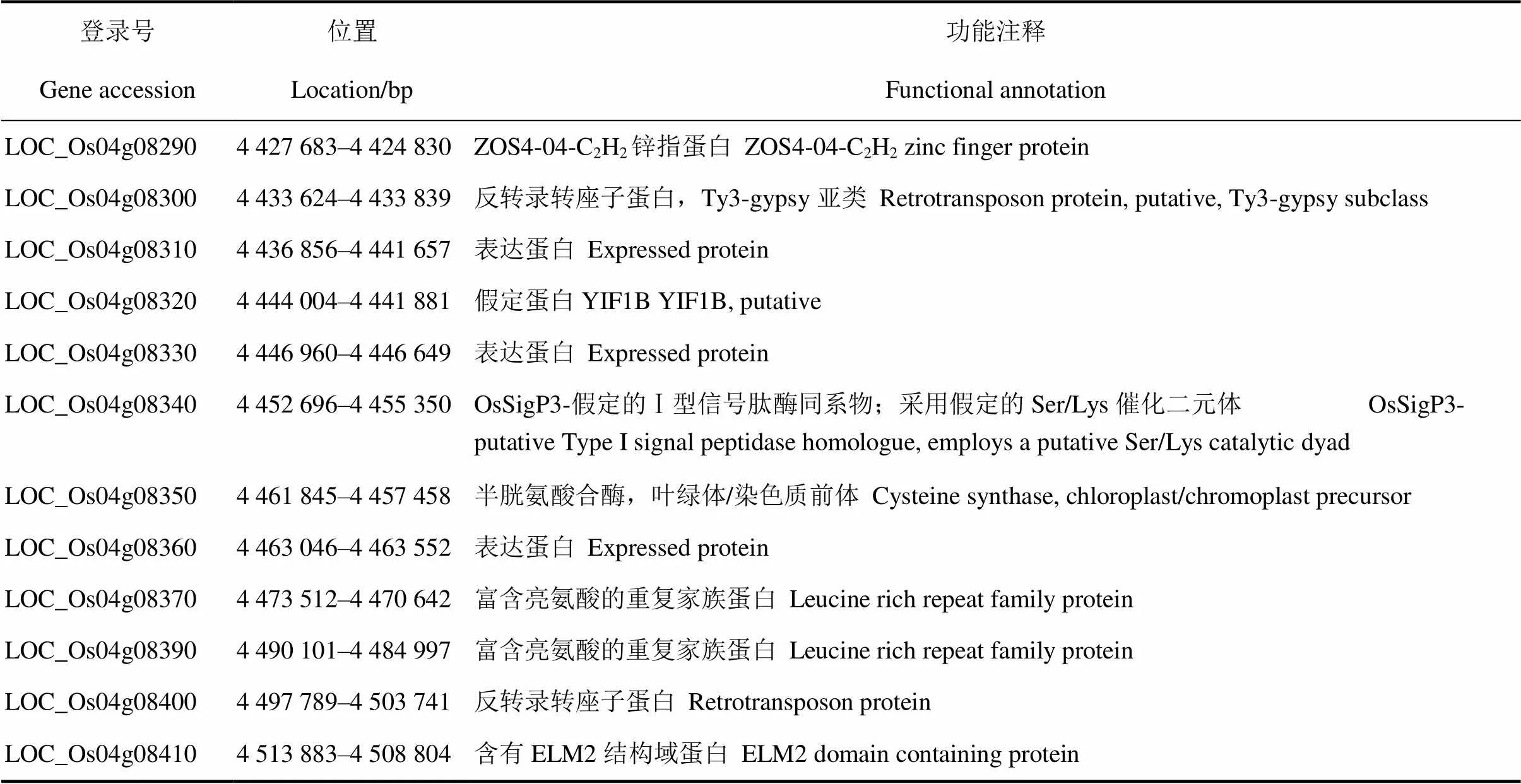
表3 第4染色體候選區間內注釋的12個基因
3 討論
水稻花器官發育是一個非常復雜的過程,每一步都涉及嚴格的遺傳調控,而水稻穎花的異常發育往往導致育性下降、千粒重減少、結實率降低等,從而致使水稻大幅減產[26]。Ikeda等[27]根據花器官原基形成起始順序將水稻小穗發育分成8個時期,Sp6、Sp7和Sp8分別對應雄蕊原基形成期、心皮原基形成期及胚珠和花粉形成期。在Sp6時期形成6枚雄蕊原基并呈環狀排列。在()突變體中,雄蕊的數目增加,藥室發育異常,雌蕊無柱頭或柱頭毛,胚囊發育正常[28]。突變體和突變體具有部分相似的表型,穎花雄蕊數目為6枚,部分小穗雄蕊數目增至7到12枚,說明突變體在雄蕊原基形成期就開始出現異常。突變體在花藥發育過程中花藥室塌陷,內無可見小孢子,即使部分花藥能夠形成腔室,內部花粉也發育異常導致大部分花粉敗育。但是約5%的花粉粒具有活性,而突變體植株在成熟期表現為完全不育。突變體雌蕊的柱頭數目增至2到4枚,胚囊育性異常。此外,突變體呈晚花表型。說明突變體的不育性狀可能由雄蕊和雌蕊發育異常及開花異常共同造成。
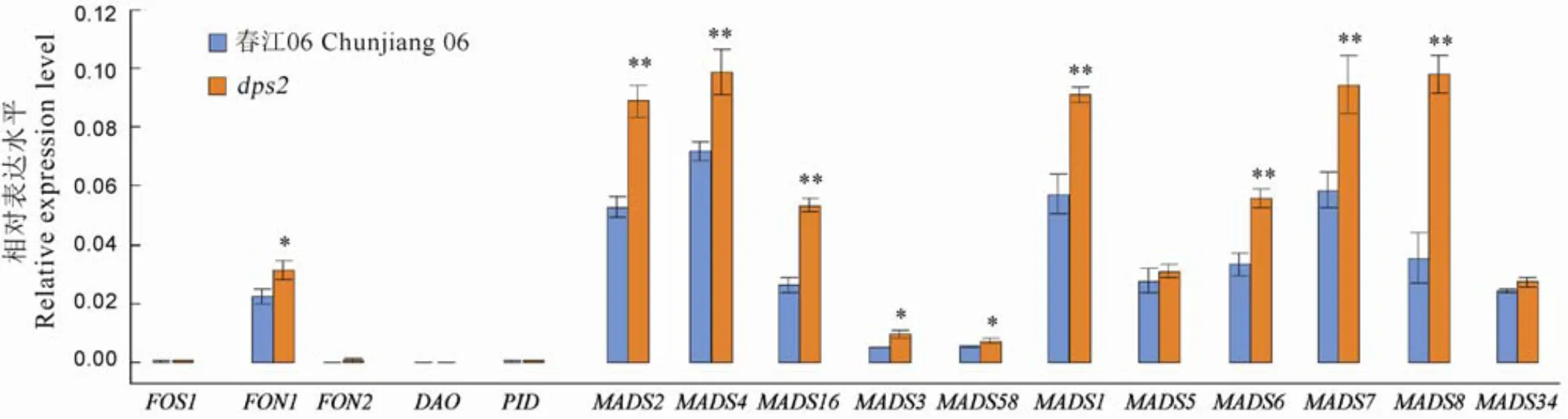
誤差線表示3次生物學重復試驗的標準差。*和**分別表示野生型春江06和突變體dps2間差異達0.05和0.01顯著水平(t檢驗)。
Fig. 6. Expression profile of the genes involved in the number and development of flower organs ofmutant and wild type Chunjiang 06.
在水稻中,已被報道主要調控第2輪漿片和第3輪雄蕊發育[8],能和、相互作用,參與調控花器官的形態[9],和在雄蕊原基中有部分重疊的表達模式[29]。在突變體中,這3個基因的表達水平都顯著升高,說明突變體中B類和C類基因的轉錄都受到影響。水稻中可能通過介導的調控途徑影響漿片和雄蕊發育。另外,和、互作來調控花分生組織活性[10]。和也能與形成相互作用,影響雄蕊和雌蕊發育[17]。在突變體中,、、和表達水平都顯著升高了。因此,我們推測基因在水稻B、C和E這3類基因調控途徑中發揮作用。
遺傳分析及基因定位表明基因是一個單隱性核基因,位于第4染色體短臂的BY6-2和BY7-3兩個標記之間,物理距離約91.2 kb,該區間內共有12個注釋基因,包括編碼C2H2型的鋅指蛋白、表達蛋白、含有ELM2結構域蛋白等。許多含有MYB[30]、鋅指[31]、堿性螺旋-環-螺旋[32]、MADS[33]和其他DNA結合結構域的轉錄調節因子被認定為具有調控花器官發育的功能。其中C2H2型鋅指蛋白可以和DNA、RNA和蛋白質結合,它們不僅參與轉錄調控,還通過獨特的位點修飾參與染色質調控和RNA代謝[34]。在擬南芥中,基因編碼一個具有C2H2鋅指DNA結合域和EAR抑制域的轉錄抑制因子[35],在花發育過程中參與控制雄蕊原基、心皮原基和胚珠[36, 37]。通過調節生長素和細胞分裂素這兩個途徑來抑制B類基因和的表達,從而實現其平衡花發育第3輪和第4輪之間邊界的功能[31, 38]。、和在部分冗余的途徑調控花分生組織活性[39]。結合突變體的表型及突變體中B、C和E這3類基因的表達量變化,推測基因功能可能與擬南芥的類似,候選基因LOC_Os04g08290編碼C2H2型鋅指蛋白,但通過測序分析并未發現該基因和其余11個基因有堿基突變。因此,推測基因可能受表觀遺傳調控,這有待于下一步轉基因實驗驗證。
[1] Pelaz S, Ditta G S, Baumann E, Wisman E, Yanofsky M F. B and C floral organ identity functions requireMADS-box genes[J].,2000, 405(6783): 200-203.
[2] Coen E S, Meyerowitz E M. The war of the whorls genetic interactions controlling flower development[J].,1991, 353(6339): 31-37.
[3] Ditta G, Pinyopich A, Robles P, Pelaz S, Yanofsky M F. Thegene offunctions in floral organ and meristem identity[J].,2004, 14(21): 1935-1940.
[4] Causier B, Schwarz-Sommer Z, Davies B. Floral organ identity: 20 years of ABCs[J].,2010, 21(1): 73-79.
[5] Kalika P, Usha V. Double-stranded RNA interference of a rice PI/GLO paralog, OsMADS2, uncovers its second-whorl-specific function in floral organ patterning[J].2003, 165(4): 2301-2305.
[6] Shri R Y, Kalika P, Usha V. Divergent regulatoryfunctions control size, shape and differentiation of the highly derived rice floret second-whorl organ.,2007, 176(1): 283.
[7] Shan G Y, Shinnosuke O, Mayumi K, Hitoshi Y. Unequal genetic redundancy of riceorthologs,and, in lodicule and stamen development[J].,2008, 49(5): 853.
[8] Nagasawa M, Miyoshi M, Sano Y, Satoh H, Hirano H, Sakai H, Nagato Y.andgenes control floral organ identify in rice[J]., 2003, (130): 708-718
[9] Yun D P, Liang W Q, Dreni L D, Yin C S, Zhou Z G, Kater M M, Zhang D B.genetically interacts withandin specifying floral patterning in rice[J].,2013, 6(3): 743-756.
[10] Hu Y, Liang W Q, Yin C S, Yang X L, Ping B Z, Li A X, Jia R, Chen M J, Luo Z J, Cai Q, Zhao X X, Zhang D B, Yuan Z. Interactions ofwith floral homeotic genes in rice flower development[J].,2015, 8(9): 1366-1384.
[11] Hu L F, Liang W Q, Yin C S, Cui X, Zong J, Wang X, Hu J P, Zhang D B. Rice MADS3 regulates ROS homeostasis during late anther development[J].,2011, 23(2): 515-533.
[12] Yamaguchi T, Nagasawa N, Kawasaki S, Matsuoka M, Nagato Y, Hirano H Y. Thegeneregulates carpel specification and midrib development in[J].,2004, 16(2): 500-509.
[13] Lopez-Dee ZP, Wittich P, Enrico P M, Rigola D, Del B I, Gorla M S, Kater M M, Colombo L., a novel rice MADS-box gene expressed during ovule development[J].,2015, 25(3): 237-244.
[14] Dreni L, Jacchia S, Fornara F, Fornari M, Ouwerkerk P B, An G, Colombo L, Kater M M. The D-lineage MADS-box genecontrols ovule identity in rice[J].,2007, 52(4): 690-699.
[15] Prasad K, Sriram P, Kumar C S, Kushalappa K, Vijayraghavan U. Ectopic expression of ricereveals a role in specifying the lemma and palea, grass floral organs analogous to sepals[J].,2001, 211(6): 281-290.
[16] Li H F, Liang W Q, Rui D J, Yin C S, Zong J, Kong H Z, Zhang D B. The AGL6-like generegulates floral organ and meristem identities in rice[J].,2010, 20(3): 299.
[17] Cui R F, Han J K, Zhao S Z, Su K M, Feng W, Du X Q, Xu Q J, Kang C, Theissen G, Zheng M. Functional conservation and diversification of class E floral homeotic genes in rice () [J].,2010, 61(5): 767-781.
[18] Suzaki T, Sato M, Ashikari M, Miyoshi M, Nagato Y, Hirano H Y. The generegulates floral meristern size in rice and encodes a leucine-rich repeat receptor kinase orthologous toCLAVATA1[J].,2004, 131(22): 5649-5657.
[19] Suzaki T, Toriba T, Fujimoto M, Tsutsumi N, Kitano H, Hirano H Y. Conservation and diversification of meristem maintenance mechanism in: Function of thegene[J].,2006, 47(12): 1591-1602.
[20] Li J, Zhang W L, Xia Z H, Jiang G H, Qian Q, Li A L, Cheng Z K, Zhu L H, Long M, Zhai W X. A paracentric inversion suppresses genetic recombination at thelocus with breakpoints corresponding to sequence gaps on rice chromosome 11L[J].2007, 277(3): 263-272.
[21] 張向前, 鄒金松, 朱海濤, 李曉燕, 曾瑞珍. 水稻早熟多子房突變體的遺傳分析和基因定位[J]. 遺傳, 2008, 30(10): 1349-1355.
Zhang X Q, Zou J S, Zhu H T, Li X Y, Zeng R Z. Genetic analysis and gene mapping of an early flowering and multi-ovary mutant in rice (L) [J].,2008, 30(10): 1349-1355.
[22] 趙福永,王潔雅, 黃顯波, 鄧則勤, 林成豹, 嚴寒, 田志宏. 水稻花器官數目突變體的研究初報[J]. 雜交水稻, 2011, 26(2): 52-57.
Zhao F Y, Wang J Y, Huang X B, Deng Z Q, Lin C B, Han Y, Tian Z H. A preliminary study on the floral organ number mutantin rice[J].,2011, 26(2): 52-57.
[23] Thomson B, Zheng B, Wellmer F. Floral organogenesis: When knowing your ABCs is not enough[J].,2017, 173(1): 56-64.
[24] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].,2001, 25(4): 402-408.
[25] Zhang D B, Wilson Z A. Stamen specification and anther development in rice[J].,2009, 54(14): 2342-2353.
[26] Xing Y Z, Zhang Q F. Genetic and molecular bases of rice yield[J].,2010, 61(1): 421-442.
[27] Ikeda K, Sunohara H, Nagato Y. Development course of inflorescence and spikelet in rice[J].,2004, 54: 147-156.
[28] 吳華茂. 水稻穗粒數相關QTL分析及水稻花器官發育突變體的鑒定[D]. 中國科學院大學,2018.
Wu H M. Studies on rice QTL of grain number per panicle and mutantdefective in floral organ development[D]. University of Chinese Academy of Science, 2018.
[29] Yamaguchi T, Lee D Y, Miyao A, Hirochika H, An G, Hirano H Y. Functional diversification of the two C-class MADS box genesandin[J].,2006, 18(1): 15-28.
[30] Moreau F, Thévenon E, Blanvillain R, Lopezvidriero I, Francozorrilla J M, Dumas R, Parcy F, Morel P, Trehin C, Carles C C. The Myb-domain protein ULTRAPETALA1 INTERACTING FACTOR 1 controls floral meristem activities in[J].,2016, 143(7): 1108-1119.
[31] Prunet N, Yang W B, Das P, Meyerowitz E M, Jack T P.prevents class B gene expression and promotes stem cell termination in the fourth whorl offlowers[J].,2017, 114(27): 7166.
[32] Sharma N, Xin R J, Kim D H, Sung S, Lange T, Huq E. NO FLOWERING IN SHORT DAY (NFL) is a bHLH transcription factor that promotes flowering specifically under short-day conditions in[J].,2016, 143(4): 682.
[33] Hugouvieux V, Silva C S, Jourdain A, Stigliani A, Charras Q, Conn V, Conn S J, Carles C C, Parcy F, Zubieta C. Tetramerization of MADS family transcription factorsandis required for floral meristem determinacy in[J].,2018.
[34] Sommer R J, Retzlaff M, Goerlich K, Sander K, Tautz D. Evolutionary conservation pattern of zinc-finger domains of Drosophila segmentation genes[J].,1992, 89(22): 10782-10786.
[35] Hiratsu K, Ohta M, Matsui K, Ohme-Takagi M. The SUPERMAN protein is an active repressor whose carboxy-terminal repression domain is required for the development of normal flowers[J].,2002, 514(2): 351-354.
[36] Sakai H, Medrano LJ, Meyerowitz E M. Role ofin maintainingfloral whorl boundaries[J].,1995, 378(6553): 199-203.
[37] Gaiser J C, Robinson-Beers K, Gasser C S. Thegene mediates asymmetric growth of the outer integument of ovules[J].,1995, 7(3): 333-345.
[38] Nibau C, Stilio V S D, Wu H M, Cheung A Y. Arabidopsis and Tobaccoregulate hormone signalling and mediate cell proliferation and differentiation[J]., 2011, 62(3): 949-961.
[39] Uemura A, Yamaguchi N, Xu Y, Wee W Y, Ichihashi Y, Suzuki T, Shibata A, Shirasu K, Ito T. Regulation of floral meristem activity through the interaction of,, andin[J].,2017, 31(1): 89-105.
Identification and Fine Mapping ofin Rice
WANG Changjian#, CHEN Long#, DAI Liping, LU Xueli, HE Jinli, YANG Long, HU Jiang, ZHU Li, DONG Guojun, ZHANG Guangheng, GAO Zhenyu, REN Deyong, CHEN Guang, SHEN Lan, ZHANG Qiang, GUO Longbiao, QIAN Qian*, ZENG Dali*
(State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 310006, China;#These authors contributed equally to this work;*Corresponding auther,E-mail: qianqian188@ hotmail.com; dalizeng@126.com)
【】 Identification and cloning of organ development-related genes can lay a foundation for further study on the molecular mechanism of rice flower development.【】The main agronomic traits and morphological characteristics of floral organs of wild type Chunjing 06 and() mutant were compared under conventional planting conditions in field. The structure of anther was observed under a scanning electronic microscope by paraffin sectioning, and the fertility of pollen and embryo sac was observed by staining. Map-based cloning was used for the gene localization. Quantitative RT-PCR was performed to analyze the relative expression of genes associated with flower development in the wild type and the mutant. 【】Longer heading date, abnormal flowering, shriveled pistils and stamens, increased anthers and stigmas were presented in themutant. Further study revealed that the anther chamber of themutantcollapsed, and no microspores were found. Though some anthers had their chambers, there was no starch accumulation in the shriveled pollen grains, and the embryo sac fertility ofwas also affected. Genetic analysis indicated that the mutant’s phenotype ofwas controlled by a single recessive nuclear gene. Thegene was mapped to a 91.2 kb region on the short arm of chromosome 4. The expression levels of some genes associated with class B, C and E genes in ABCDE model were up-regulated in the mutant. 【】 The abnormal development of stamens and pistils attributed to the complete infertility of themutant, which indicated thatplay an important role in third round of stamen development and the fourth round of pistil development.
rice;; floral organ development; gene mapping
Q755; S511.01
A
1001-7216(2020)02-0115-10
10.16819/j.1001-7216.2020.9122
2019-11-15;
2019-12-27。
國家自然科學基金資助項目(31971872, 31661143006);中國農業科學院科技創新工程項目。

