不同HbA1c水平2型糖尿病患者的胰島細胞功能比較
王春華,蘇建彬,王雪琴
0 引 言
糖尿病是一組由多種病因導致以慢性高血糖為特征的終身性代謝性疾病,很多因素參與糖尿病的發生發展,如飲食習慣、血脂異常、激素水平紊亂等,發病率在世界范圍內呈上升趨勢[1-3]。糖尿病的急慢性并發癥不僅可影響患者的生活質量甚至可危及患者生命。目前中國成年人糖尿病患病率為11.6%,而約有一半的中國人處于糖尿病邊緣[4]。糖尿病是一種“雙激素”疾病,其發病不僅與胰島素分泌及作用有關,同時與胰高血糖素(glucagon,GLA)密切相關,兩者在血糖調節及能量代謝等方面的作用日益受到重視[5]。2016年美國糖尿病協會(ADA)指南糖尿病診斷主要基于空腹血糖(FPG)、口服75 g葡萄糖耐量試驗(75 g OGTT)、2小時血糖(2hPG)以及糖化血紅蛋白(hemoglobin Alc,HbA1c),由于國內有關HbA1c水平在種族差異、不同人群、不同年齡段的診斷切點及有效性等方面仍存在較多爭議,限制了HbA1c在國內的廣泛應用[6]。但HbA1c反映既往3個月左右血糖波動水平,與糖尿病的慢性并發癥關系密切相關[7]。而HbA1c水平與糖尿病患者的血漿C肽、GLA水平的關系報道卻較少。本研究主要目的在于了解2型糖尿病患者不同水平的HbA1c與血漿C肽、GLA變化的關系,探討血糖控制與2型糖尿病患者胰島α、β細胞功能的關系。
1 資料與方法
1.1 研究對象回顧性分析2016年1月至2017年7月在南通市第一人民醫院內分泌科住院就診的467例2型糖尿病患者臨床資料。納入標準:符合2007年中國2型糖尿病防治指南診斷標準:糖尿病癥狀+空腹血糖≥7 mmol/L(或隨機血糖≥11.1 mmol/L,或葡萄糖負荷后2 h血糖≥11.1 mmol/L)。排除標準:1型糖尿病;糖尿病急性并發癥如糖尿病酮癥酸中毒、糖尿病高滲性昏迷;合并有嚴重感染性疾病;合并惡性腫瘤、結核活動期等消耗性疾病;有嚴重肝腎功能損害、貧血、急性心腦血管事件;近期使用糖皮質激素等影響血糖波動。根據HbA1c水平分為3組,即HbA1c≤7%組(低HbA1c組)117例、7.0% 1.2研究方法統計受試者的身高、體重、收縮壓、舒張壓。空腹12 h后取靜脈血,全自動生化分析儀(日立7600)測量肝腎功能、血脂、尿酸、血糖。糖化血紅蛋白分析儀(美國BIO-RAD10)檢測HbA1c(HPLC法)。放免計數器(SN-697γ)檢測GLA。使用APVIA Centanv xp檢測C肽(直接化學發光法)。行75 g OGTT前1天停用胰島素及胰島素促泌劑并禁食12 h,分別檢測空腹及口服75 g葡萄糖后30、60、120、180 min后的血糖(GLU)、C肽和GLA。采用同一時點GLU與GLA的比值(GLU/GLA)矯正高血糖對GLA的抑制作用。比較各組各時間點C肽曲線下面積(AUCC肽)、GLU/GLA曲線下面積(AUCGLU/GLA)的變化。曲線下面積(area under the curve,AUC)計算公式: AUC=15×空腹值+30×(30 min值+180 min值)+45×60 min值+60×120 min值 2.1 一般資料的比較3組性別構成、年齡、三酰甘油、血紅蛋白比較差異無統計學意義(P>0.05),3組隨HbA1c的逐步升高,低密度脂蛋白膽固醇(LDL-C)逐步升高,糖尿病病程時間逐步延長,差異有統計學意義(P<0.05)。隨著HbA1c的逐步升高,高密度脂蛋白膽固醇(HDL-C)、尿酸逐步下降,差異有統計學意義(P<0.05)。中HbA1c組的收縮壓、舒張壓、BMI均高于低HbA1c組及高HbA1c組,差異有統計學意義(P<0.05)。見表1。 2.2空腹及OGTT后各時間點C肽及GLU/GLA比較隨著HbA1c的逐步升高,空腹及OGTT后各時間點的C肽呈現逐步下降趨勢,差異有統計學意義(P<0.05),各組均于口服75 g葡萄糖后120 min達高峰。隨著HbA1c的逐步升高,中HbA1c組與高HbA1c組空腹及OGTT后30 min的GLU/GLA雖逐步上升,但差異無統計學意義(P>0.05),其余各組各時間點的GLU/GLA呈逐步上升趨勢,差異亦有統計學差異(P<0.05),各組均于口服75 g葡萄糖后120 min達高峰。見表2。 2.3AUCC肽及AUCGLU/GLA的比較3組AUCC肽及AUCGLU/GLA變化與各時間點C肽及GLU/GLA變化的趨勢相一致,隨著HbA1c的逐步升高,AUCC肽呈現逐步下降趨勢,而AUCGLU/GLA呈現逐步升高趨勢,差異均有統計學意義(P均<0.05)。見表3。 表1 不同HbA1c水平2型糖尿病患者一般資料比較 項目低HbA1c組(n=117)中HbA1c組(n=149)高HbA1c組(n=201)P值男/女(n)53/6483/66112/890.1480年齡(歲)51.74±15.9453.85±13.1955.23±15.080.1272體重指數(kg/m2)25.0±3.8026.01±3.9324.53±3.160.0085收縮壓(mmHg)130.50±16.65135.91±18.18132.65±15.490.0284舒張壓(mmHg)75.97±9.9779.44±10.5778.95±10.770.0167三酰甘油(mmol/L)1.59(1.02,2.61)1.84(1.18,2.97)1.71(1.05,2.66)0.0705總膽固醇(mmol/L)4.28(3.81,5.03)4.68(4.06,5.47)4.64(3.73,5.20)0.0099LDL-C(mmol/L)2.22(1.94,2.78)2.54(1.96,3.21)2.56(1.91,2.99)0.0296HDL-C(mmol/L)1.14(0.91,1.35)1.05(0.89,1.25)0.98(0.82,1.17)0.0022尿酸(mmol/L)313.50(235.50,395.00)297.00(251.00,351.00)276.50(220.50,328.50)0.0019血紅蛋白(g/L)141.1±13.2139.6±15.2143.7±14.50.7531病程(年)4.01±5.874.81±5.726.22±6.580.0096 1 mmHg=0.133 kPa 表2 不同HbA1c水平2型糖尿病患者空腹及OGTT后各時間點C肽、GLU/GLA的比較[M(QL,Qu)] 項目低HbA1c組(n=117)中HbA1c組(n=149)高HbA1c組(n=201)C肽(ng/mL) 空腹1.59(1.13,2.15)1.29(0.73,1.86)?0.60(0.37,1.09)?# 30min3.83(2.61,5.51)2.10(1.32,3.01)?1.02(0.59,1.68)?# 60min5.93(3.94,7.59)3.40(2.17,4.77)?1.55(0.93,2.79)?# 120min6.56(5.02,9.32)4.58(2.96,6.22)?2.45(1.45,3.77)?# 180min4.69(3.05,6.46)3.87(2.48,5.67)?2.41(1.48,3.56)?#GLU/GLA(mmol/ng) 空腹0.043(0.030,0.058)0.048(0.037,0.069)?0.051(0.036,0.075)? 30min0.080(0.055,0.107)0.091(0.071,0.120)?0.098(0.075,0.134)? 60min0.103(0.072,0.136)0.123(0.098,0.178)?0.143(0.108,0.188)?# 120min0.105(0.067,0.144)0.146(0.102,0.209)?0.181(0.138,0.246)?# 180min0.072(0.046,0.108)0.110(0.072,0.155)?0.158(0.112,0.229)?# 與低HbA1c組比較,*P<0.05;與中HbA1c組比較,#P<0.05 表3 不同HbA1c水平2型糖尿病患者AUCC肽及AUCGLU/GLA的比較[M(QL,Qu)] 項目低HbA1c組(n=117)中HbA1c組(n=149)高HbA1c組(n=201)AUCC肽960.30(726.75,1259.85)636.90(437.55,860.70)?332.10(214.65,524.10)?#AUCGLU/GLA16.61(12.47,22.14)20.99(16.51,29.32)?25.61(20.29,35.87)?# AUCC肽:C肽曲線下面積;AUCGLU/GLA:GLU/GLA曲線下面積 與低HbA1c組比較,*P<0.05;與中HbA1c組比較,#P<0.05 2.4HbA1c與AUCC肽、AUCGLU/GLA的相關性分析Pearson相關分析結果顯示,HbA1c與AUCC肽呈負相關(r=-0.6093,P<0.05),HbA1c與AUCGLU/GLA呈正相關(r=0.3679,P<0.05),見圖1。以AUCC肽、AUCGLU/GLA、BMI、血壓、總膽固醇、LDL-C、HDL-C、尿酸、病程作為自變量,以HbA1c為因變量進行多元逐步回歸分析,結果提示HbA1c與AUCC肽呈負相關[β(SE)=-0.0031(0.0002),P<0.05],HbA1c與AUCGLU/GLA呈正相關[β(SE)=0.0359(0.0057),P<0.05]。 a: C肽曲線下面積;b: GLU/GLA曲線下面積 圖1 2型糖尿病患者HbA1c與C肽曲線下面積、GLU/GLA曲線下面積的相關性 2.5AUCC肽與AUCGLU/GLA的相關性分析進一步將AUCC肽及AUCGLU/GLA行Pearson相關分析結果顯示,AUCC肽與AUCGLU/GLA呈負相關(r=-0.3230,P<0.05),見圖2。以AUCC肽、HbA1c、BMI、血壓、總膽固醇、LDL-C、HDL-C、尿酸、病程作為自變量,以AUCGLU/GLA為因變量進行多元逐步回歸分析,結果提示AUCC肽與AUCGLU/GLA呈負相關[β(SE)=-0.0133(0.0023),P<0.05]。進一步將AUCC肽10等分,作為等級變量入模型,結果示[β(SE)=-2.0558(0.3315),P<0.05],提示隨著AUCC肽每下降10%,AUCGLU/GLA上升2.0558(數值),由于AUCGLU/GLA平均值為26.5,即AUCC肽每下降10%,AUCGLU/GLA上升7.8%。 圖2 2型糖尿病患者C肽曲線下面積與GLU/GLA曲線下面積的相關性 HbA1c是血紅蛋白與糖類結合發生不可逆的非酶促反應的產物。其濃度主要取決于血紅蛋白與葡萄糖,可反映過去3~4個月的平均血糖水平,不受飲食、運動及降糖藥物等因素的影響[8-10]。早在2002年美國糖尿病學會(ADA)就將HbA1c作為控制血糖的“金指標”。從2010年起,ADA將HbA1c≥6.5%作為糖尿病的診斷標準之一。本研究發現3組在性別構成、年齡、三酰甘油、血紅蛋白等均無明顯統計學差異,但HbA1c與HDL-C、LDL-C密切相關,隨HbA1c逐步升高,HDL-C呈現逐步下降,LDL-C逐步升高,3組之間存在統計學差異(P<0.05),與英國前瞻性糖尿病研究(UKPDS)研究發現HbA1c、HDL-C、LDL-C均與糖尿病大血管并發癥密切相關相符合。本研究還觀察到隨HbA1c水平逐步升高,尿酸呈現逐步下降趨勢,3組間差異有統計學意義(P<0.05),其可能的機制為,雖2型糖尿病患者,因為胰島素抵抗及糖酵解中間產物向5-磷酸核糖轉移,使得血尿酸產生增多,但高血糖導致的血滲透壓升高使腎血流量增加,尿酸通過腎臟排泄增多,同時近端腎小管對尿酸的重吸收因為尿糖的增多而降低,使得血尿酸降低。 胰島細胞主要由胰島α細胞和β細胞組成,α細胞分泌GLA,具有升糖的作用,β細胞分泌胰島素,具有降糖作用,機體的葡萄糖代謝調節由兩者共同參與完成,即為目前研究較熱的“雙激素”模式[11]。而血糖升高是因為“雙激素”模式改變而引起的,由于胰島α細胞和胰島β細胞功能改變,使血糖賴以穩定的GLA與胰島素的比值改變從而導致高血糖。 GLA是“雙激素”學說中糖代謝調控的主要升糖激素,健康人GLA在餐后30 min略升高,而后逐漸下降,至180 min稍低于空腹水平[12]。GLA最為有效的調節因素為葡萄糖,但嚴重的高血糖狀態對胰島α細胞有糖毒性,使α細胞產生近似于對血糖無反應的狀態,葡萄糖喪失抑制GLA分泌的能力,本研究使用GLU/GLA矯正高血糖對GLA的抑制作用用來評價胰島α細胞功能。 “雙激素”學說中主要的降糖激素為胰島素,胰島素和C肽水平測定均是評價胰島β細胞胰島素分泌功能的重要方法。胰島素是由胰島β細胞合成其前體,經加工分泌的降糖激素。C肽亦是胰島β細胞的分泌產物,它和胰島素有一個共同的前體-胰島素原。一個分子的胰島素原在特殊的作用下,裂解成一個分子的胰島素和一個分子的C肽,理論上C肽和胰島素是等同分泌的,但C肽不被肝臟攝取,半衰期較胰島素長,且不受體內產生的胰島素抗體和外源性胰島素的干擾[13],本研究使用血漿C肽水平代替胰島素反映胰島β細胞功能,3 h內 C肽曲線下面積反應總體胰島素分泌指標[14]。 本研究觀察到隨HbA1c逐步升高,3組各時間點C肽及C肽曲線下面積均有統計學差異(P<0.05),且HbA1c與AUCC肽呈負相關(r=-0.6093,P<0.05),3組HbA1c與GLU/GLA及AUCGLU/GLA亦均有統計學差異(P<0.05),呈正相關(r=0.3679,P<0.05),且多元回歸分析亦呈現相同結果,其機制可能為HbA1c隨血糖濃度的升高而升高,對于糖尿病患者來講,空腹血糖及餐后血糖對HbA1c均有影響。有研究[15]認為GLA/胰島素是調節空腹血糖水平的主要因素,隨著胰島素的分泌減少和GLA的異常高分泌,空腹血糖可明顯升高,同時對于正常人進餐后30 min時胰島素水平迅速升高5~10倍,此時無論GLA是否受抑制均可導致肝臟門靜脈中GLA/胰島素明顯下降,可維持正常血糖。而對于2型糖尿病患者由于胰島素第一時相分泌減弱,胰島素僅升高2~3倍,無法抑制GLA的分泌,導致GLA異常高分泌,GLA/胰島素升高,從而使餐后血糖明顯升高。空腹及餐后血糖的升高導致全天血糖濃度明顯升高進而導致HbA1c升高。 本研究發現AUCGLU/GLA的上升與AUCC肽的下降具有相關性(r=-0.3230,P<0.05),且具體闡述了隨AUCC肽(即胰島β細胞功能)每下降10%,AUCGLU/GLA(即胰島α細胞功能)升高7.8%。其可能的機制為2型糖尿病患者絕大部分均存在胰島素抵抗和胰島素分泌的絕對或相對不足,α細胞表面亦存在胰島素抵抗,葡萄糖需要在胰島素的作用下進入α細胞代謝產生能量,從而抑制GLA的分泌,但存在胰島素抵抗時,進入α細胞的葡萄糖不能產生足夠的能量,不能有效抑制α細胞分泌GLA;而GLA水平的升高,進一步刺激β細胞分泌胰島素,長此以往,β細胞數量逐步減少及功能逐步衰竭。 本研究的不足之處:首先,進入此研究樣本量較少,沒有采用多種、大樣本的研究,且為回顧性分析,研究數據存在一定的局限性;其次,本研究患者均為住院患者,用藥情況不均一,針對初發糖尿病未使用藥物治療患者進一步研究可彌補可這一局限。 綜上所述,胰島α細胞和β細胞分泌的胰島素和GLA共同影響著體內葡萄糖的代謝,與HbA1c密切相關,調節雙激素穩態平衡將更有利于血糖控制平穩,減少糖尿病慢性并發癥的發生和發展。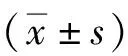
2 結 果





3 討 論

