單寧酸對小麥醇溶蛋白結構及功能性質的影響
,3,*
(1.華中農業大學食品科技學院,湖北武漢 430070;2.環境食品學教育部重點實驗室,湖北武漢 430070;3.湖北省功能食品工程技術研究中心,湖北武漢 430070)
食品體系中往往共存多種大分子和小分子,如蛋白質、多糖、多酚等,它們之間難免會發生相互作用[1]。其中兩種組分之間,如蛋白質與多糖、蛋白質與多酚等產生相互作用會改變蛋白質的構象,導致膠體結構(如復合物、納米顆粒和微膠囊)的形成,進而影響蛋白質的物化性質,實現單一組分不具備的某些功能特性,擴展了其在食品和藥品等工業領域的應用。例如,多糖的加入提高了蛋白質在模擬胃液條件下的乳化性[2]。相互作用的類型可分為非共價相互作用(氫鍵、疏水相互作用和靜電力等)與共價相互作用(酶誘導和非酶誘導(堿誘導、自由基誘導)),對此兩種相互作用的研究近年來取得一定的進展。例如單寧酸與玉米醇溶蛋白非共價結合可以提高其乳化特性[3],蛋白質與多糖間共價結合可以有效提高蛋白質的穩定性和溶解度[4]。
單寧酸(Tannic Acid,TA)是一種天然多酚,屬于一種可水解單寧。它含有約25個羥基,可用來參與氫鍵、疏水鍵等非共價鍵的形成,也可通過氧化后形成醌進行席夫堿等反應參與共價鍵的形成[5-6]。因此,它可以與許多小分子(生物堿)和大分子(蛋白質、多糖等)反應[7]。由于其廣泛的來源和多種生物學特性,如抗氧化、抗菌、抗腫瘤、抗病毒等[8],單寧酸廣泛應用于食品工業。小麥醇溶蛋白是谷類中的一種醇溶性蛋白,富含脯氨酸[9]。小麥醇溶蛋白(gliadin)由一個短的N末端,中間重復區域和C末端組成[10],可使其具有兩親特性。近年來,小麥醇溶蛋白由于生物兼容、可生物降解、可生物代謝等優點經常被作為食品添加劑使用,例如肉制品填充劑、面包改良劑等。
小麥醇溶蛋白由于其雙親性,可以自組裝形成膠體顆粒。近年來,研究者發現在乳液遞送系統中小麥醇溶蛋白納米顆粒可以作為穩定劑來使用,但單獨的小麥醇溶蛋白具有較差的穩定性[11],并且穩定的Pickering乳液只能維持數天[12]。引入單寧酸期望可以改善納米顆粒的穩定性,增加蛋白穩定Pickering乳液的保質期。
相同的兩種組分在不同的處理條件下可能需要不同的組裝方式,從而導致不同理化性質的產生。因此基于之前的報道[3,13],實驗研究了小麥醇溶蛋白與單寧酸之間通過非共價與堿誘導的共價方式形成復合體系,采用紫外、熒光、紅外等技術手段,分析了單寧酸以不同方式結合小麥醇溶蛋白時兩者間不同的組裝機制,并探究了不同組裝機制對小麥醇溶蛋白的結構及功能特性的影響。同時比較了兩者通過不同組裝機制結合對復合物功能性質的影響,為將兩者在乳液遞送系統中的應用奠定理論基礎。
1 材料與方法
1.1 材料與儀器
谷朊粉 食品級,封丘縣華豐粉業有限公司;二氯乙烷 分析純,國藥集團化學試劑有限公司;單寧酸(Mw 1701) 阿拉丁化學試劑有限公司;鄰苯二甲醛(OPA)、ABTS(2,2′-azino-di-(3-ethylbenzothiazoline)-6-sulfonic acid)、DPPH(1,1-diphenyl-2-picrylhydrazyl) 分析純,美國Sigma公司。
F-4600熒光分光光度計 日本Hitachi公司;DSC-60差示掃描量熱儀、UV-1700紫外-可見分光光度計 日本島津公司;Nexus470傅立葉紅外光譜儀 美國Nicolet公司。
1.2 實驗方法
1.2.1 小麥醇溶蛋白的提取 小麥醇溶蛋白的提取過程參考Joye等[14]的方法。在室溫下使用二氯甲烷對谷朊粉進行脫脂2 h(谷朊粉/二氯甲烷溶液為1∶7,w/v)后,抽濾收集粉末。并將上述過程重復2次,將得到的粉末室溫下干燥12 h,至溶劑揮發完全。干燥后將粉末加入70%(v/v)乙醇-水溶液中(粉末/溶液為1∶10,w/v),攪拌3 h,然后以9000×g 4 ℃的條件離心10 min收集上清液。在40 ℃下旋蒸30 min除去乙醇,直至有少量粉末析出。最后,將所得懸濁液冷凍干燥后收集小麥醇溶蛋白,并用研缽研至粉末狀。通過氮分析儀(FP-428,Leco Corp.,St. Joseph,MI,USA)分析粉末中蛋白含量為88.86%。
1.2.2 小麥醇溶蛋白/單寧酸復合物制備 小麥醇溶蛋白/單寧酸的非共價/共價復合物的制備過程參考已報道的研究方法[15]。將醇溶蛋白和單寧酸溶于70%(v/v)乙醇-水溶液中,用0.2 mol/L NaOH調至pH9.0,使其充分接觸空氣(敞口攪拌)并在室溫下攪拌24 h。得到的溶液再在室溫下靜置24 h來確保完全分散和溶解,所得溶液為小麥醇溶蛋白/單寧酸共價復合物溶液(標記為共價復合物)。所用小麥醇溶蛋白與單寧酸的質量比為1∶0.01~1∶0.09 (w/w),對應圖1中小麥醇溶蛋白濃度固定時,相對應的單寧酸濃度為0.29、0.87、1.45、2.03、2.61 μmol/L。相同條件下不添加單寧酸制得堿處理后的蛋白樣品(標記為gliadin,經堿處理)。
非共價復合物(標記為非共價復合物)在以上述方式但不調節pH與隔絕氧氣(閉口攪拌)的條件下制備而得,以此相同條件不添加單寧酸時制得對照蛋白溶液(標記為gliadin)。
1.2.3 小麥醇溶蛋白/單寧酸復合物的熒光光譜分析
1.2.3.1 熒光光譜的測定 室溫條件下,小麥醇溶蛋白的內源熒光用熒光分光光度計檢測。小麥醇溶蛋白濃度固定為0.5 mg/mL,非共價復合物的測定中所用單寧酸濃度依次為0.005、0.015、0.025、0.035、0.045 mg/mL,共價復合物的測定中所用單寧酸濃度為0.025 mg/mL。其中激發波長設置為290 nm,發射波長為280~500 nm[16],激發和發射狹縫寬均為5 nm。
1.2.3.2 淬滅類型分析 利用Stern-Volmer方程對熒光數據進行分析,以求得淬滅類[17]。
式(1)
式中:F-有淬滅劑時小麥醇溶蛋白的熒光強度;F0-無淬滅劑時小麥醇溶蛋白的熒光強度;Kq-速率常數;t0-沒有淬滅劑時生物大分子的平均熒光壽命;[Q]-淬滅劑濃度;Ksv-Stern-Volmer淬滅常數。
針對靜態淬滅與動態淬滅同時存在的情況,利用Stern-Volmer方程修正形式進行分析[18]。
式(2)
式中:F0、F、[Q]代表含義同上;KD-動態淬滅常數;KS-靜態淬滅常數。
1.2.3.3 結合位點計算 通過以下方程計算結合常數和結合位點[19]:
式(3)
方程中:Ka-結合常數;n-結合位點數。
1.2.3.4 熱力學參數計算 熱力學參數通過以下公式計算得到[20]:
式(4)
ΔG=ΔH-TΔS
式(5)
方程中:R-氣體常數,空氣的氣體常數約為8.314 J/(mol·K);T-實驗溫度(開氏度);Ka-與溫度T對應的結合常數。
1.2.4 小麥醇溶蛋白/單寧酸復合物的自由氨基含量測定 本實驗采用鄰苯二甲醛(OPA)法[21]測定蛋白與復合物中自由氨基的含量。準確稱取80 mg鄰苯二甲醛溶于2 mL乙醇中,然后依次加入50 mL 0.1 mol/L硼砂,200 μL巰基乙醇,和5 mL 20%(w/w)十二烷基硫酸鈉(SDS),定容至100 mL,此為OPA試劑。測定時取4 mL OPA試劑于試管中,將1.2.2中所得到的小麥醇溶蛋白或復合物溶液稀釋至適當濃度后注入400 μL于試管中,室溫下混勻后反應2 min,340 nm下測量吸光值。以4 mL OPA試劑中加入 400 μL 70%乙醇-水溶液為空白。以L-亮氨酸作標準曲線,根據曲線與測得的吸光度算出樣品中自由氨基的含量。
1.2.5 傅立葉變換紅外光譜分析(FTIR) 采用溴化鉀壓片法測定紅外光譜。將1.2.2中所得溶液凍干后得到小麥醇溶蛋白與復合物粉末,將凍干后的粉末與溴化鉀以1∶100 (w/w)的比例進行混合,烘干后用瑪瑙研缽研磨至均勻粉末后壓制成片。光譜的掃描范圍是4000~400 cm-1,采用溴化鉀為空白對照。采用PeakFit v 4.12進行處理,利用高斯去卷積和求二次導數的方法對酰胺I帶區域(1700~1600 cm-1)的原始光譜進行分析。利用Thermo Scientific OMNIC軟件對FTIR光譜進行基線校正。通過對酰胺I帶區域進行二階求導,蛋白質二級結構的主要峰可以分為α-螺旋(1646~1664 cm-1),β-折疊(1615~1637 cm-1和1682~1700 cm-1),β-轉角(1664~1681 cm-1)和無規則卷曲(1637~1645 cm-1)。通過高斯方程計算各個峰的面積所占百分比來對比二級結構的變化。
1.2.6 紫外可見吸收光譜分析(UV-visible) 將1.2.2中所得樣品溶液稀釋至適當濃度后置于1 cm比色皿中測量。波長的掃描范圍是190~400 nm,掃描速度為200 nm/min。
1.2.7 復合物熱穩定性及抗氧化性分析
1.2.7.1 差示掃描量熱分析(DSC) 取5.0 mg 1.2.5中凍干得到的粉末,置于鋁盤中并進行密封,以密封空鋁盤作為空白對照。升溫速率設為10 ℃/h,加熱范圍為25~150 ℃,氮氣流速為30 mL/min。
1.2.7.2 DPPH自由基清除活性 自由基清除活性參考Gong等[22]的方法。1 mmol/L DPPH乙醇溶液,置于4 ℃冰箱中儲藏以備使用。使用時將DPPH用乙醇稀釋至0.1 mmol/L。試驗中將1.2.2中所得溶液稀釋至適當濃度后,取20 μL與3.8 mL DPPH乙醇溶液混合20 s后,暗中儲藏1 h,在517 nm下測量吸光值。
式中:As為樣品吸光度;Ac為空白對照的吸光度。
1.2.7.3 ABTS自由基清除活性 ABTS自由基清除活性參考Pellegrini等[23]的方法。將5 mL ABTS(7 mmol/L)母液與5 mL 過硫酸鉀溶液(2.45 mmol/L)混合,并避光靜置12 h以上,制備成ABTS工作液。實驗時將工作液用乙醇稀釋至λ734=0.7±0.02。將1.2.2中所得溶液稀釋至適當濃度后,取0.1 mL與3.9 mL ABTS工作液充分混合后并在黑暗環境下靜置8 min,734 nm下測量吸光值。通過以下方程計算ABTS自由基清除活性:
式中:As是樣品吸光度,Ac是空白對照的吸光度。
1.3 數據處理
數據統計分析使用SPSS 19.0軟件進行單因素ANOVA檢驗,顯著水平為0.05。所有測試至少進行3次,數據為三次測定的平均值,結果以平均值±標準差(SD)表示。
2 結果與分析
2.1 單寧酸與小麥醇溶蛋白反應作用力探究
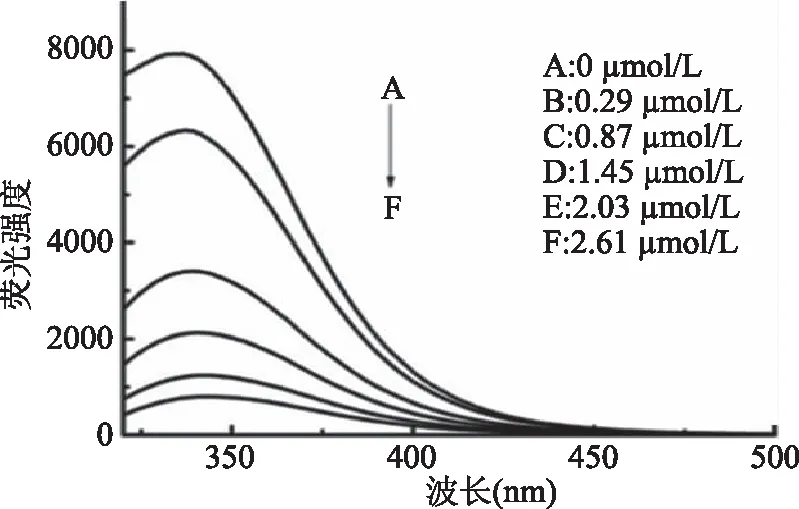
圖1 小麥醇溶蛋白/單寧酸非共價復合物熒光發射圖譜Fig.1 Fluorescence emission scans ofgliadin/TA non-covalent complex注:A到F分別表示不同單寧酸濃度下小麥醇溶蛋白的內源熒光。
2.1.1 熒光光譜分析 圖1為小麥醇溶蛋白/單寧酸非共價復合物的熒光發射圖譜。小麥醇溶蛋白的最大發射波長約在340 nm,這與醇溶蛋白之前報道過的最大發射波長相似[24]。相比于水溶液中色氨酸的最大發射波長在約355 nm處,最大發射波長有所偏移。這是由于本實驗采用的溶劑為70%乙醇-水溶液,相對于水溶液來說,70%乙醇-水溶液的溶劑極性降低,所以造成色氨酸的最大發射波長藍移。隨著單寧酸濃度的增加,最大發射波長發生紅移,表示復合物的疏水性增加,可能是單寧酸的結合導致蛋白質分子結構更加舒展而使更多疏水基團暴露出來所致。
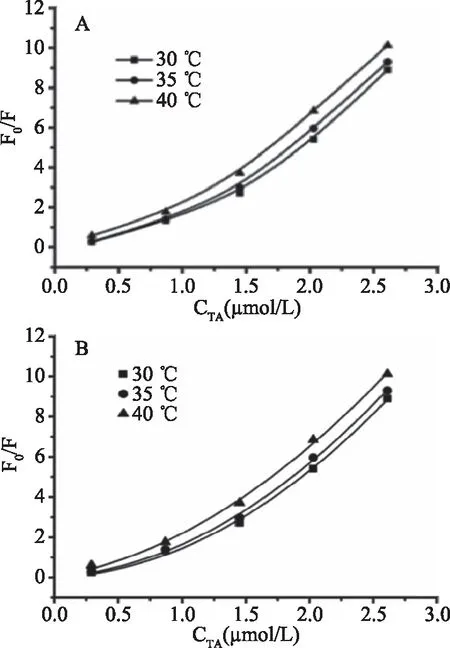
圖2 小麥醇溶蛋白的Stern-Volmer曲線(A)及其修正曲線(B)Fig.2 Stern-Vlommer curve(A)and the modifiedform of Stern-Volmer equation(B)of gliadin
根據式1分析熒光淬滅類型。圖2A代表三個溫度下Stern-Volmer方程的分析結果,不同溫度下的Stern-Volmer圖均表現了向上曲率,且向y軸凹。此結果表明單寧酸對醇溶蛋白的淬滅機制是靜態淬滅與動態淬滅同時存在的[16]。基于此結果,引入式(2)分析熒光淬滅數據。

表1 小麥醇溶蛋白/單寧酸非共價相互作用的熱力學參數Table 1 Thermodynamic parameters of the non-covalent interaction of gliadin and TA
圖2B顯示了不同溫度下單寧酸對醇溶蛋白的淬滅曲線,單寧酸與醇溶蛋白間的Stern-Volmer淬滅常數Ksv(Ksv=KD+KS)在30、35、40 ℃三個溫度下分別為0.2600×106、0.4515×106和1.1433×106M-1。根據已知的Ksv和色氨酸的t0為3 ns[25]可以算出速率常數Kq(Kq=Ksv/t0)分別為8.67×1012、1.51×1013和3.81×1013M-1s-1。在動態淬滅中,最大碰撞淬滅常數為 2.0×1010M-1s-1,本研究中得到的淬滅速率常數遠大于2.0×1010M-1s-1。單寧酸的加入引起了醇溶蛋白熒光分子吸收光譜的紅移,可以推測單寧酸與醇溶蛋白的淬滅機制中靜態淬滅占主導地位,并且兩者之間形成了復合物。
利用式(3)分析小麥醇溶蛋白與單寧酸的結合位點數與結合常數。如圖3為單寧酸淬滅醇溶蛋白的雙對數曲線,在30、35、40 ℃時,單寧酸與醇溶蛋白之間的結合常數Ka分別為6.74×109M-1(lg(F0-F)/F=9.8289+1.5987 lg[Q])、6.24×109M-1(lg(F0-F)/F=9.7953+1.5875 lg[Q])和1.42×108M-1(lg(F0-F)/F=8.1546+1.2905 lg[Q])。數據表明從30 ℃到40 ℃,單寧酸與小麥醇溶蛋白的結合常數Ka較大,說明兩者間具有較強的結合力。隨著溫度升高,表觀結合常數降低,表明溫度升高對兩者間的結合不利,復合物變的相對不穩定。結合位點數n分別為1.5987、1.5875和1.2905,說明兩者大約是以1∶1(摩爾比)的比例結合[16]。

圖3 單寧酸與小麥醇溶蛋白相互作用的雙對數曲線Fig.3 Double-lg plots of interactionbetween TA and gliadin at different temperatures
根據式(4)、式(5),焓變(ΔH)和熵變(ΔS)可以通過lnK對1/T曲線的斜率與橫坐標估算得到。據圖4和表1可知,ΔG<0表明兩者間為自發的反應。并且單寧酸與醇溶蛋白反應的ΔH<0,且ΔS<0,故可推斷兩者間主要是通過氫鍵相結合[26]。
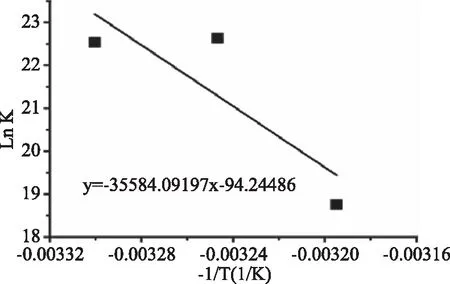
圖4 單寧酸與小麥醇溶蛋白相互作用的熱力學參數Fig.4 Thermodynamic parameters for interactionbetween TA and gliadin at different temperatures
2.1.2 自由氨基的變化 本研究采用鄰苯二甲醛(OPA)法檢測蛋白質中的自由氨基含量,可以用來反應賴氨酸側鏈的相關信息[27]。由表2可知,相同單寧酸含量下,共價復合物中自由氨基含量比非共價復合物中的自由氨基含量低。因加入的SDS可以破壞非共價鍵,所以自由氨基含量的降低說明了堿處理會使醇溶蛋白中的自由氨基-NH2與氧化后的單寧酸發生席夫堿反應[28],生成C-N鍵,醇溶蛋白與單寧酸形成共價復合物。與此同時,體系內隨著單寧酸含量的增加,同一復合物體系中自由氨基含量也隨之增加,其原因可能是由于單寧酸的結合,蛋白分子結構發生去折疊,導致更多的氨基暴露出來,因此會使得自由氨基含量增加。

表2 小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的自由氨基含量Table 2 Free amino groups of gliadinand gliadin/TA complexes
注:同行不同字母表示差異顯著(P<0.05)。
2.2 結構的變化
2.2.1 三級結構的變化
2.2.1.1 紫外光譜的測定 通過紫外可見光譜來探究單寧酸對于小麥醇溶蛋白三級結構的影響。圖5A的紫外吸收光譜可清晰的觀察到280 nm附近存在一個吸收峰,此吸收峰主要由色氨酸和酪氨酸殘基產生。引入單寧酸后該吸收峰的強度增加說明小麥醇溶蛋白與單寧酸間形成了復合物并進一步改變了蛋白的三級結構。非共價與共價兩種復合物的吸光度分別比小麥醇溶蛋白與經堿處理的小麥醇溶蛋白的吸光度高,說明單寧酸的結合導致蛋白三級結構展開,使得芳香雜環疏水基團周邊的微環境極性增大[29-30]。此外,共價復合物的吸光度明顯高于非共價復合物的吸光度,表明共價交聯方式使得小麥醇溶蛋白分子更加伸展,導致更多的芳香雜環疏水基團暴露。
2.2.1.2 內源熒光的測定 通過內源熒光光譜來探究單寧酸對于小麥醇溶蛋白三級結構的影響。圖5B可以看出經過堿處理后,醇溶蛋白的內源熒光強度增強,可能是由于堿處理改變了蛋白質中色氨酸的內環境所致。基于先前的研究結果,多酚的芳環可以與蛋白質的色氨酸或酪氨酸反應,造成蛋白內源熒光淬滅[31]。因此,復合物的熒光淬滅也進一步表明醇溶蛋白與單寧酸之間發生了相互作用。與非共價復合物相比,共價復合物中醇溶蛋白的內源熒光強度更低,說明共價相互作用更強,單寧酸會與色氨酸側鏈上的自由氨基不可逆交聯。最大發射波長發生藍移,說明色氨酸處于非極性環境下;而當蛋白分子三級結構開始伸展,色氨酸更多的暴露在極性環境下時,最大發射波長會發生紅移[32]。與醇溶蛋白相比,復合物的最大發射波長發生紅移,說明形成復合物時蛋白分子發生去折疊,使色氨酸暴露在更加親水的環境中。與非共價復合物相比,共價復合物的最大發射波長紅移的程度更深,說明共價交聯對蛋白的三級結構影響更多。

圖5 小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的紫外可見圖譜(A)與熒光發射圖譜(B)(gliadin∶TA=1∶0.05,w/w)Fig.5 UV-visible spectra(A)and fluorescence spectra(B)ofgliadin and gliadin-TA complexes(preparedwith a gliadin/TA ratio of 1∶0.05,w/w)
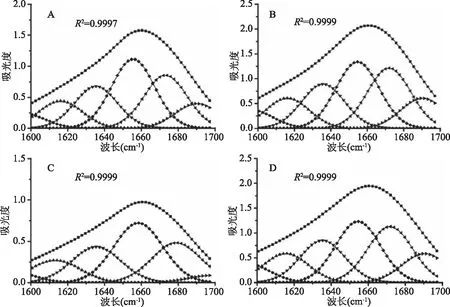
圖7 小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的二級結構酰胺I帶擬合曲線Fig.7 Curve-fitted amide I region with secondary structure determination 注:A:醇溶蛋白;B:非共價復合物;C:醇溶蛋白(經堿處理);D:共價復合物;醇溶蛋白∶TA=1∶0.05 (w/w)。
2.2.2 傅立葉變換紅外光譜分析 圖6為凍干并烘干去除水分后小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的紅外光譜圖。如圖6A單寧酸在3385 cm-1處的特征峰代表酚基或羥基的伸縮振動[33],該峰在單寧酸如圖6A,單寧酸在3385 cm-1處的特征峰代表酚基或羥基的伸縮振動[33],該峰在單寧酸與小麥醇溶蛋白反應之后發生右移,說明單寧酸的羥基或酚基參與了兩者間的反應。與小麥醇溶蛋白反應之后發生右移,說明單寧酸的羥基或酚基參與了兩者間的反應。1716 cm-1是酯鍵基團的特征峰,1613、1533、1448 cm-1是由于苯環的骨架振動產生[34]。小麥醇溶蛋白的光譜表現出的主要峰值為3312(酰胺A帶,N-H的伸縮振動)、1659(酰胺I帶,C=O的伸縮振動)和1540 cm-1(酰胺II帶,C-N的伸縮振動和N-H的平面彎曲振動)。在與單寧酸形成復合物后,主要峰分別移動到3215、1662和1537 cm-1,說明了氫鍵相互作用的存在,與之前非共價復合物熒光結果一致(圖1D)。圖6B中所示兩條線段a和b代表一樣的長度,可看出隨著單寧酸含量的增加,1540 cm-1處的吸收峰強度明顯變弱,說明兩者間發生了化學反應[35-36]。1258 cm-1代表OC-NH伸縮振動,引入單寧酸后,該峰吸收明顯增強,說明反應過程中有C-N鍵的形成[37]。1540 與1258 cm-1處吸收峰強度分別變弱和增強,共同說明了單寧酸與小麥醇溶蛋白在堿誘導過程中發生了化學反應。
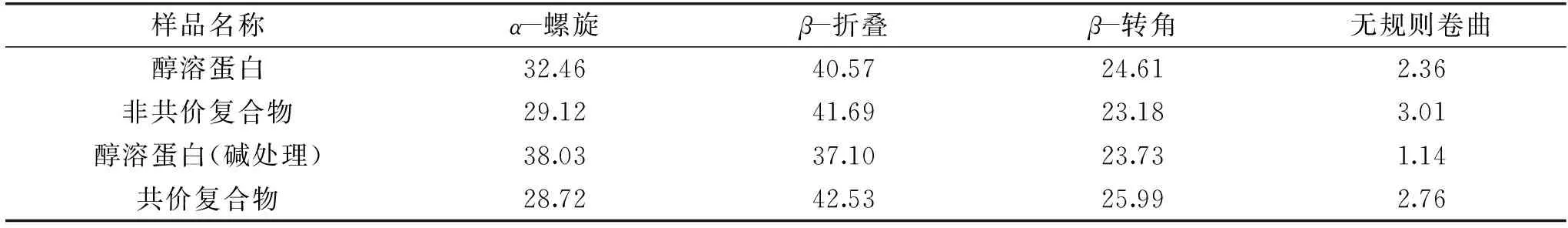
表3 小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的二級結構含量(%)Table 3 Secondary structure content of gliadin and gliadin/TA complexes(%)
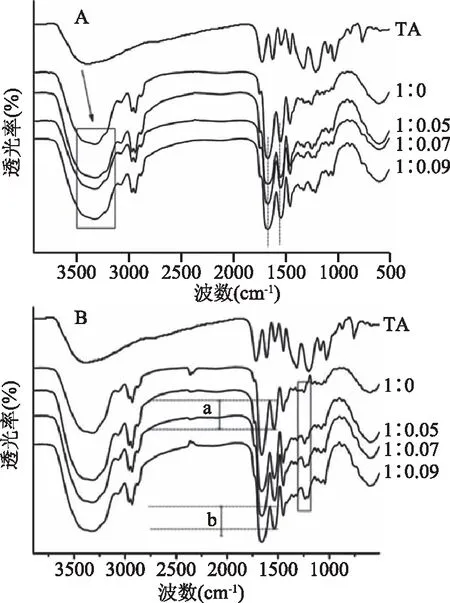
圖6 小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的紅外光譜Fig.6 FTIR spectra of gliadin and gliadin/TA complexes注:A:非共價復合物;B:共價復合物,圖中所示比例為醇溶蛋白∶TA(w/w)。
由于蛋白質的紅外光譜通常伴隨著二級結構的改變,本研究進一步采用傅立葉自解卷積的方法對1600~1700 cm-1區域的紅外光譜進行高斯線性擬合,得到蛋白質的二級結構信息。如圖7和表3所示,經過堿處理后小麥醇溶蛋白中α-螺旋含量從32.46%增加到38.03%,β-折疊、β-轉角和無規則卷曲的含量均有不同程度的下降。形成非共價復合物時的小麥醇溶蛋白分子中α-螺旋和β-轉角的含量比未與單寧酸結合時的小麥醇溶蛋白分別降低3.34%和1.43%,β-折疊和無規則卷曲的含量分別增加1.12%和1.65%。形成共價復合物時的小麥醇溶蛋白中α-螺旋的含量比經過堿處理的小麥醇溶蛋白降低9.31%,β-折疊、β-轉角和無規則卷曲的含量分別增加5.43%、2.26%和1.62%。結果表明單寧酸的結合會使蛋白的二級結構變的更加無序,同時以共價交聯方式形成復合物會使蛋白的二級結構改變更多。這可以用來解釋表2中非共價復合物和共價復合物中的自由氨基隨著復合物中單寧酸含量的增加分別增多的現象,單寧酸的加入使蛋白去折疊,游離氨基更多的暴露了出來。
2.3 功能特性的變化
2.3.1 熱穩定性 通過差示掃描量熱(DSC)可以反應單寧酸的結合對于小麥醇溶蛋白熱穩定性的影響。圖8可以看出小麥醇溶蛋白在 60.94 ℃存在一個吸熱峰,這代表蛋白質的熱變性溫度。經過堿處理后蛋白的吸熱峰變為62.76 ℃,這表明采用堿處理的方法可以使蛋白的熱穩定性小幅度增加。非共價復合物的熱變性溫度為55.55 ℃,共價復合物的熱變性溫度為63.78 ℃。表明單寧酸采用非共價方式與醇溶蛋白相互作用時,不利于蛋白的熱穩定性,而醇溶蛋白通過共價鍵與單寧酸結合可以提高其熱穩定性,這與之前報道過的結果相似[38]。
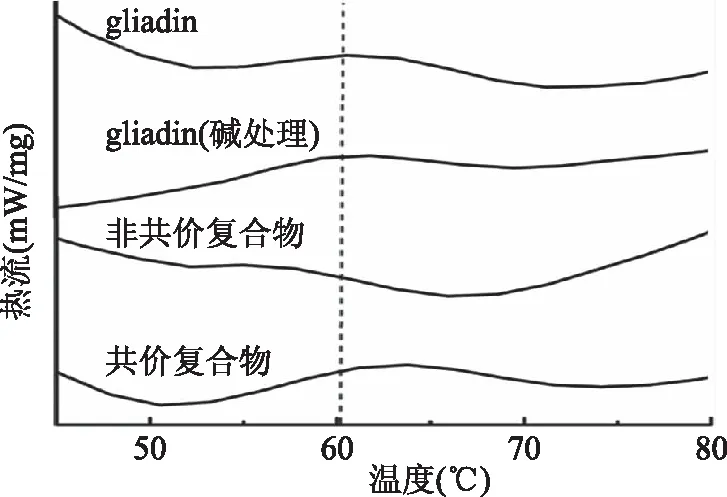
圖8 小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的差示掃描量熱圖譜Fig.8 DSC analyses of gliadin and gliadin/TA complexes
2.3.2 抗氧化活性 通過DPPH和ABTS自由基清除實驗可以反應單寧酸的結合對于小麥醇溶蛋白抗氧化活性的影響。圖9表示出了各個樣品的抗氧化活性,小麥醇溶蛋白本身不具有抗氧化活性,單寧酸的加入使復合物具有了抗氧化活性。這是由于單寧酸的羥基對于抗氧化能力有較大的貢獻[39],兩者形成復合物后相對于小麥醇溶蛋白引入了更多的羥基,使其抗氧化活性得到提高。相比于游離單寧酸,單寧酸與小麥醇溶蛋白結合后對其本身的抗氧化能力有一定的抑制作用,這可能是由于單寧酸上一部分羥基參與了與蛋白間的相互作用所致。共價復合物的抗氧化能力比非共價復合物的抗氧化能力小,是由于在使用堿交聯的方法形成共價復合物時,單寧酸上的羥基氧化生成醌[40],導致了羥基數量的減少,從而造成抗氧化能力的進一步降低。

圖9 小麥醇溶蛋白和小麥醇溶蛋白/單寧酸復合物的抗氧化性 Fig.9 Antioxidant activities of gliadinand gliadin/TA complexes
3 結論
目前,為了擴展蛋白在食品工業中的應用,蛋白質與多酚間的非共價相互作用已被研究的較為透徹。本實驗從探究兩者間非共價與共價相互作用力出發,對比了形成的兩種復合物對蛋白質的結構、熱穩定性與抗氧化性方面造成的差異,為蛋白質在食品中的應用增加了新的可能性。實驗采用簡單的堿處理方法,使單寧酸可以成功接枝到小麥醇溶蛋白分子上并與其側鏈上的氨基發生反應。非共價復合時,小麥醇溶蛋白與單寧酸主要通過氫鍵相互作用進行靜態結合,并且結合常數大約為1∶1。與單寧酸復合后,蛋白中α-螺旋含量降低,β-轉角含量升高,蛋白分子結構展開,導致蛋白分子中自由氨基含量升高。與非共價結合方式相比,共價交聯方式對蛋白的二、三級結構影響更大。非共價復合使小麥醇溶蛋白的熱變性溫度降低,而共價結合方式使小麥醇溶蛋白的熱變性溫度小幅度提升。單寧酸的引入使蛋白具有了抗氧化活性,非共價復合物的抗氧化性強于共價復合物。

