新工藝制備Hib 結合疫苗原液長期穩定性試驗
朱文勇,王明清,宋紹輝,李雙麗,胡文著,廖國陽
(中國醫學科學院北京協和醫學院醫學生物學研究所云南省重大傳染病疫苗研發重點實驗室,云南昆明 650118)
b 型流感嗜血桿菌(Haemophilus influenzae type b,Hib),是引起小兒細菌性腦膜炎和急性呼吸道傳染病的主要致病菌,也可導致敗血癥、會厭炎、脊髓炎等多種侵襲性疾病[1-2]。目前,Hib 結合疫苗是國際公認的最為有效的細菌性疫苗之一[3]。目前上市的Hib 結合疫苗,都是由Hib 莢膜多糖經活化,通過己二酰肼(adipyl dihydrazide,ADH)與破傷風類毒素(tetanus toxoid,TT)蛋白共價結合制備而成。其中莢膜多糖的提取均采用傳統工藝[4],過程中使用大量的苯酚,而多糖活化也采用極毒的溴化氰,嚴重影響操作者的身體健康,破壞生態環境。為此,國內外開展了細菌莢膜多糖提取新工藝[5-8]及疫苗制備新方法的研究[9-12],其中筆者所在團隊建立了利用Triton X-114 提取Hib 莢膜多糖的新工藝[13]及基于1-氰基-4-二甲基氨基吡啶·四氟化硼(1-cyano-4-dimethylaminopyridinium tetrafluoroborate,CDAP)活化的疫苗制備新方法[14]也做了相應研究,初步結果證明,新工藝所制備Hib 結合疫苗質量和效果完全達到目前新版藥典要求,但如真正投入生產還需對其穩定性進行檢測。本研究通過對制備疫苗的長期穩定性進行監控,為新工藝投入生產提供試驗數據支持。
1 材料與方法
1.1 材料
多糖及載體蛋白多糖3 批(批號:20120301、20120512、20130218)載體蛋白3 批(破傷風類毒素,TT)(批號:20110506、20110712、20110920),均由中國醫學科學院醫學生物學研究所制備。實驗動物Bablb/c 小鼠購自湖南斯萊克景達實驗動物有限公司,實驗動物生產許可證號:SCXK(湘)-2013-0004,豚鼠,兔均購自昆明楚商科技有限公司,實驗動物生產許可證號:SCXK(滇)K2012-0002。CDAP、ADH、碳二亞胺[1-ethyl-3-(3-dimethylaminopmpylcarbodiimide,EDAC]均購自美國Sigma 公司。Hib 抗血清、HRP標記羊抗鼠IgG 抗體均購自美國BD 公司。TT 抗體購自中國食品與藥品檢定研究院。NaCl(藥用級)購自自貢鴻鶴公司。AKTA 純化儀及填料購自美國GE 公司。
1.2 結合疫苗原液的制備
Hib 菌株發酵后經Triton X-114 方法提取莢膜多糖[13],莢膜多糖經CDAP 活化后,與ADH 在堿性條件下衍生,制備出多糖-酰肼基衍生物,在EDAC 作用下與TT 偶聯,形成多糖-蛋白結合物,經Sepharose 4FF 純化,收集KD≤0.2 的結合物,用0.22 μm 濾膜除菌過濾,即為Hib 結合疫苗原液,后經稀釋為Hib 結合疫苗。本實驗所用3 批Hib 結合疫苗批號分別為:20130402、20130403、20130504。
1.3 Hib 結合疫苗原液檢定
鑒定項目與方法均參照2010 年《中國藥典》三部中《b 流感嗜血桿菌結合疫苗制造檢定規程》中規定進行。本實驗設計2-8℃長期穩定性試驗,具體檢定項目與檢定時間見表1。
2 結果
按照2010 年《中國藥典》三部中規定中的方法對制品進行了穩定性試驗,Hib 結合疫苗2~8℃保存了36 個月,結果見表1,其指標中鑒別試驗、pH 值、多糖含量、無菌、異常毒性、熱源、細菌內毒素含量結果穩定,每次檢測結果差異不大,分子量大小隨時間增長略有下降,高分子結合物含量及效力試驗結果變化顯著,保存30 個月時,仍能達到《b 流感嗜血桿菌結合疫苗制造檢定規程》80%~100%的要求,陽轉率也能維持在80%,符合藥典要求。保存36 個月時,201304003 批疫苗高分子結合物含量低于80%,效力試驗陽轉率也低于80%,不符合藥典要求。
3 討論
穩定性試驗是疫苗質量控制研究的主要觀察項目之一,目的在于考察疫苗的質量穩定性,為疫苗在合理有效期或使用期提供科學依據[15]。原則上一般包括3 種方式[12]:(1)強制條件試驗研究,用于了解產品在短期偏離儲存條件和極端情況下產品的變質或降解情況;(2)加速穩定性研究,用于確定產品在處理和使用過程中引起的降解,數據可作為制定有效期的輔助依據;(3)實際儲存條件下的實時穩定性研究(長期穩定性研究),研究可以作為設定產品保存條件和有效期的主要依據。
本研究主要檢測了新工藝制備的Hib 結合疫苗的長期穩定性試驗,驗證了該工藝在儲存條件(2~8℃)下,保存30 個月仍符合2015 年《中國藥典》三部的質量標準,初步說明該疫苗能夠滿足2 年有效期要求,與傳統工藝制備Hib 結合疫苗結果[3]類似,為新工藝投入生產提供了依據。但是,
如上述穩定性試驗研究原則所述,為全面評估該疫苗應對運輸、極端環境及生產處理中的各種情況,后續仍應該對其進行強制穩定性試驗和加速穩定性試驗研究。通過本研究發現,在疫苗的儲存過程中,其鑒別試驗、pH 值、多糖含量及異常毒性等關乎安全性的指標相對穩定,而其高分子結合物含量與效力試驗變化較明顯,且兩者結果具有相關性,這提示我們在后續實驗及生產過程中應重視高分子結合物含量的指標,同時應該進行更多批次的疫苗穩定性試驗,對試驗數據進行科學統計,制定出合理的企業內部生產放行標準,以免上市疫苗達不到預期效果。
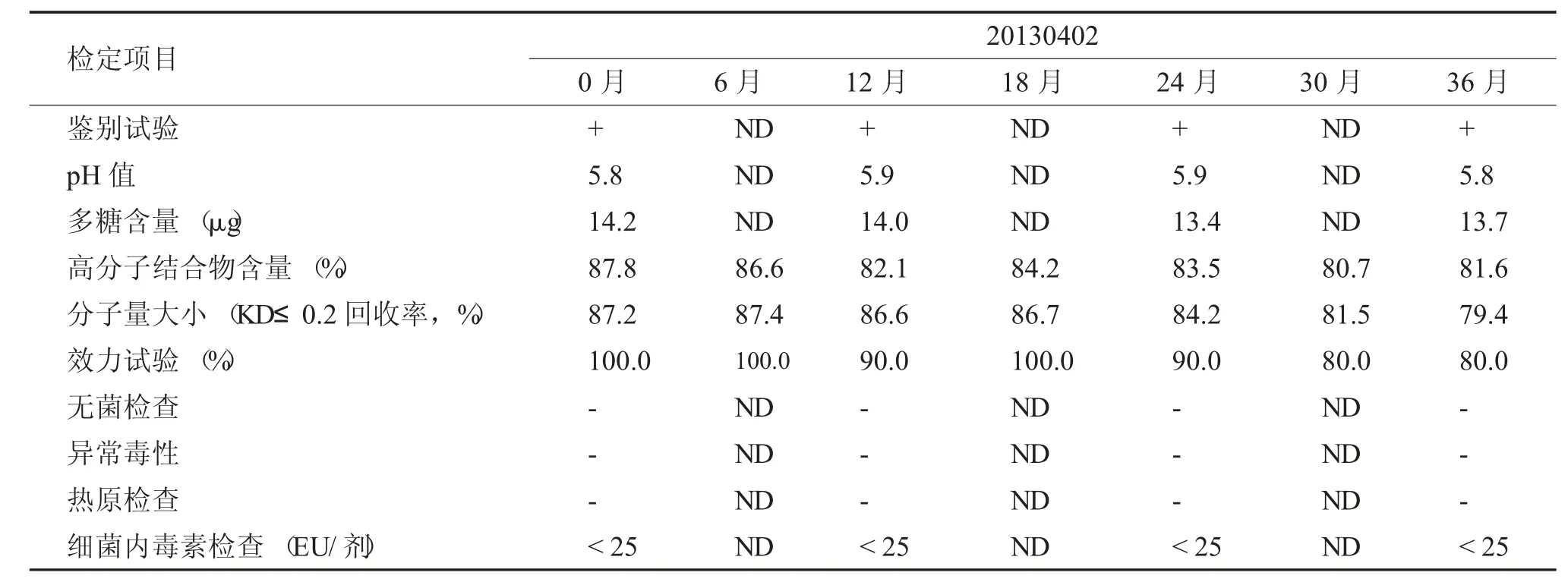
表1 Hib 結合疫苗原液2~8℃長期穩定性實驗檢測結果(1)Tab.1 Long term stability results of Hib conjugate stock solution at 2~8 ℃(1)
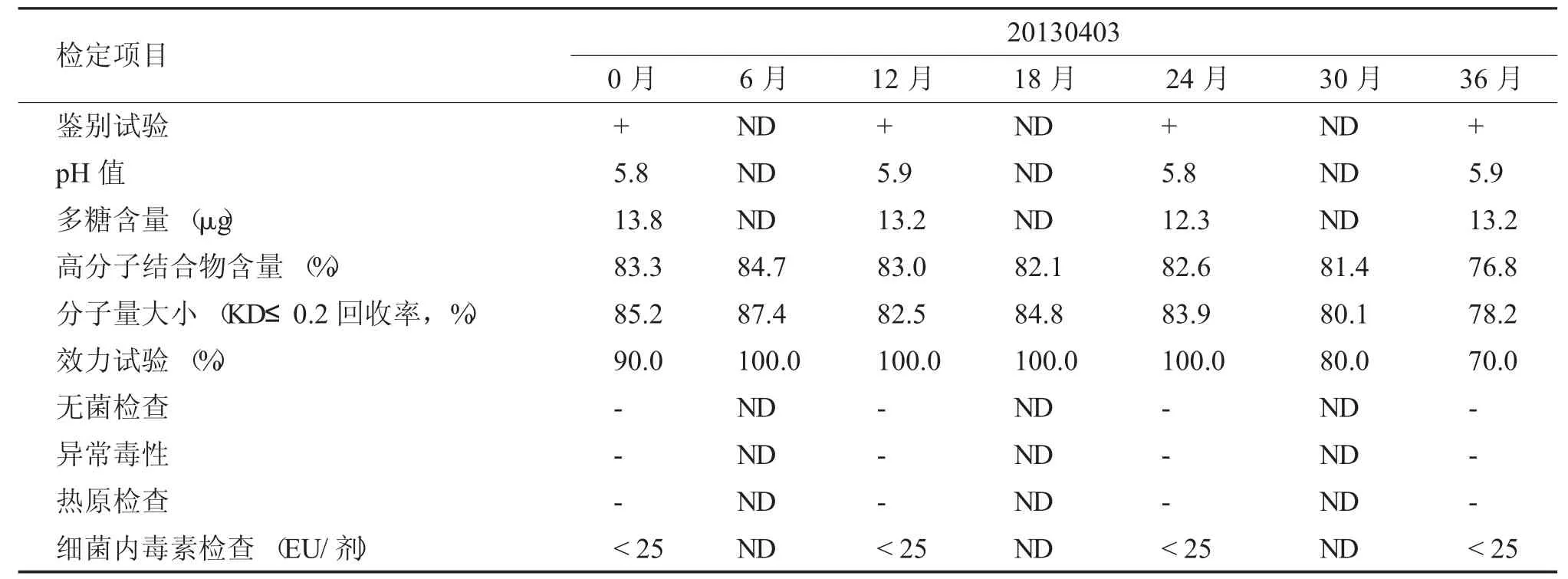
表1 Hib 結合疫苗原液2~8℃長期穩定性實驗檢測結果(2)Tab.1 Long term stability results of Hib conjugate stock solution at 2~8 ℃(2)
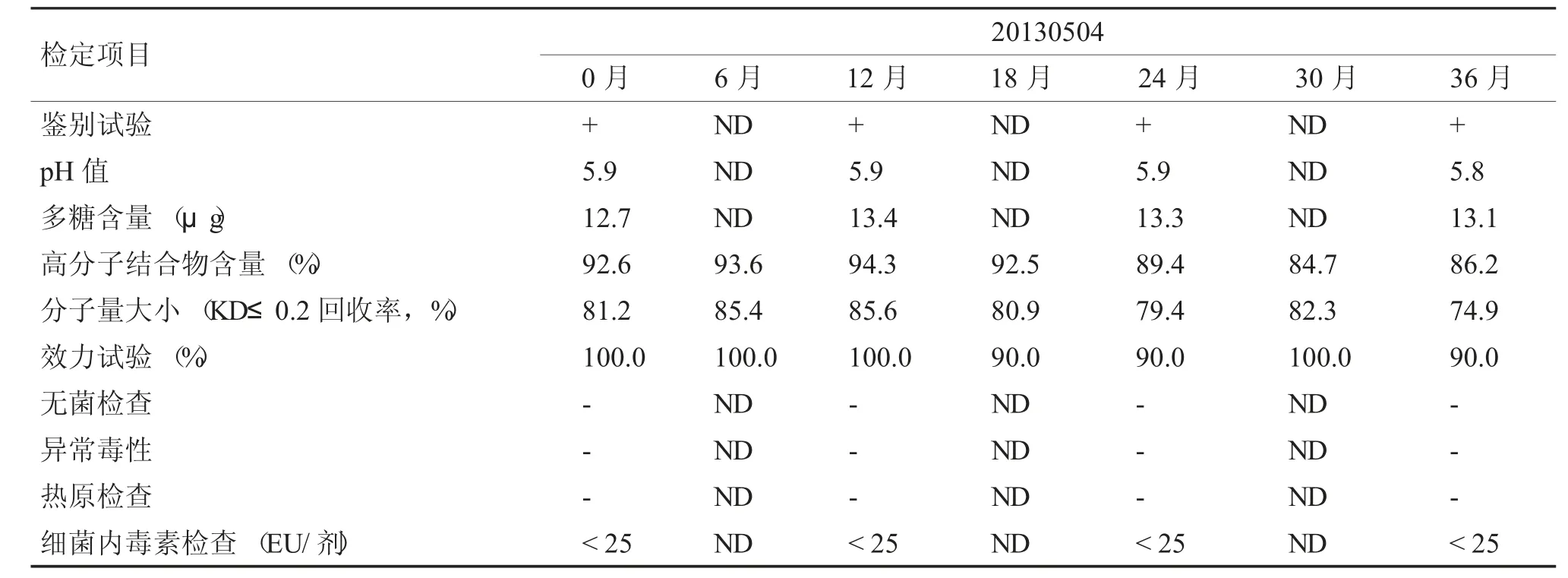
表1 Hib 結合疫苗原液2~8℃長期穩定性實驗檢測結果(3)Tab.1 Long term stability results of Hib conjugate stock solution at 2~8 ℃(3)

