潰瘍型壞疽性膿皮病合并皮膚真菌感染一例
黃舒婷 秦思 溫炬孫大煒廣東省第二人民醫院皮膚性病科,廣州 5037;廣東省第二人民醫院創傷外科,廣州5037
黃舒婷、溫炬現在南方醫科大學第二臨床醫學院,廣州 510630
患者男,64歲,因頸背部反復潰瘍伴疼痛3年余入院。3年前患者無明顯誘因頸部出現數個米粒大小的水皰,伴疼痛,自行外敷中草藥后,水皰破潰,周圍皮膚糜爛,經當地醫院清理創面、換藥及自行涂抹多種藥膏(具體不詳)后,皮損無明顯好轉,呈潛行性擴大,形成手掌大小的潰瘍,累及背部,伴明顯疼痛。3個月前雙下肢出現凹陷性水腫,當地醫院予補充白蛋白后水腫消退,但仍反復發作。2個月前在外院對背部皮損潰瘍基底分泌物進行培養示皺落假絲酵母菌(Candida rugosa)陽性,考慮為皮膚真菌感染,予抗真菌及止痛治療1個月后,效果欠佳。后對右背部潰瘍邊緣皮膚行病理檢查示,淺表表皮缺失,可見痂皮及壞死組織,真皮淺表及血管周圍可見中等量淋巴細胞及中性粒細胞浸潤,未見上皮細胞團塊,未見腫瘤組織,不排除壞疽性膿皮病。患者未予進一步診療。近1周皮損較前擴大,局部潰瘍深達皮下組織,上覆大片痂皮,疼痛劇烈,伴頭暈不適,無法平臥。病程中無畏寒、發熱,無乏力、關節疼痛。既往有頸椎增生病史3年余,家族中無類似疾病及傳染性疾病史。
體檢:一般情況尚可,頸部活動受限,淺表淋巴結無腫大,雙肺呼吸音清,聞及雙下肺濕啰音。雙小腿、踝部及雙足背對稱性凹陷性水腫(圖1A),皮溫正常。皮膚科檢查:頸背部見大片不規則潰瘍,約25 cm×20 cm,深約0.3 cm,呈潛行性,邊界清楚,基底凹凸不平,上覆厚層褐色干燥性痂皮,潰瘍中央見紅色肉芽組織,頸部發際線處潰瘍深約1.2 cm,內有黃白色膿性分泌物,觸之劇痛,潰瘍外周繞以邊界尚清的環形紅斑,見圖1B。
實驗室檢查:血常規示白細胞13.11×109/L,中性粒細胞比例0.86,C反應蛋白>270.0 mg/L。尿糞常規、肝腎功能、抗HIV抗體和梅毒螺旋體抗體、血培養、自身免疫性抗體、腫瘤標志物檢測均未見異常。頸椎及胸部X線片示:①雙下肺野病變(考慮感染性病變);②頸椎退行性變。下肢血管彩超示右側腘靜脈、腓靜脈、肌間靜脈和左側腓靜脈上段血栓形成。頸背部潰瘍面分泌物培養示,光滑念珠菌及肺炎克雷伯菌肺炎亞種生長。頸項部皮損組織病理示表皮缺失,可見纖維脂肪組織及少量橫紋肌組織,部分區域大片壞死、化膿,其內混雜大量真菌菌絲及孢子,過碘酸雪夫染色、六胺銀染色和阿辛藍染色均陽性,符合真菌感染,見圖2。頸項部皮損深部組織培養示誕沫假絲酵母(Candida zeylanoides)生長,無細菌生長。結合臨床及以上檢查,診斷:潰瘍型壞疽性膿皮病(PG)合并皮膚真菌感染、雙下肢靜脈血栓形成。
治療經過:入院后予靜脈滴注甲潑尼龍40 mg/d及頭孢地嗪2 g/d,口服沙利度胺(25 mg每日2次)及雷公藤多苷(10 mg每日3次)、伏立康唑(0.2 g每日2次)和華法林(2.5 mg每日1次)。20 d后潰瘍較前愈合,面積縮小,背部大片痂皮脫落,紅色肉芽組織生長,頸項部潰瘍仍較深,上有約15 cm×10 cm厚層黑褐色痂難以清除。于創傷外科行雙下肢血管介入治療及頸背部清創術,后予大腿取皮及頸背部植皮術,期間予負壓吸引及換藥治療,術后2周頸背部淡紅色篩狀瘢痕形成,頸項部中央見一約15 cm×10 cm的膚色移植皮片(圖1C),創面恢復良好出院。
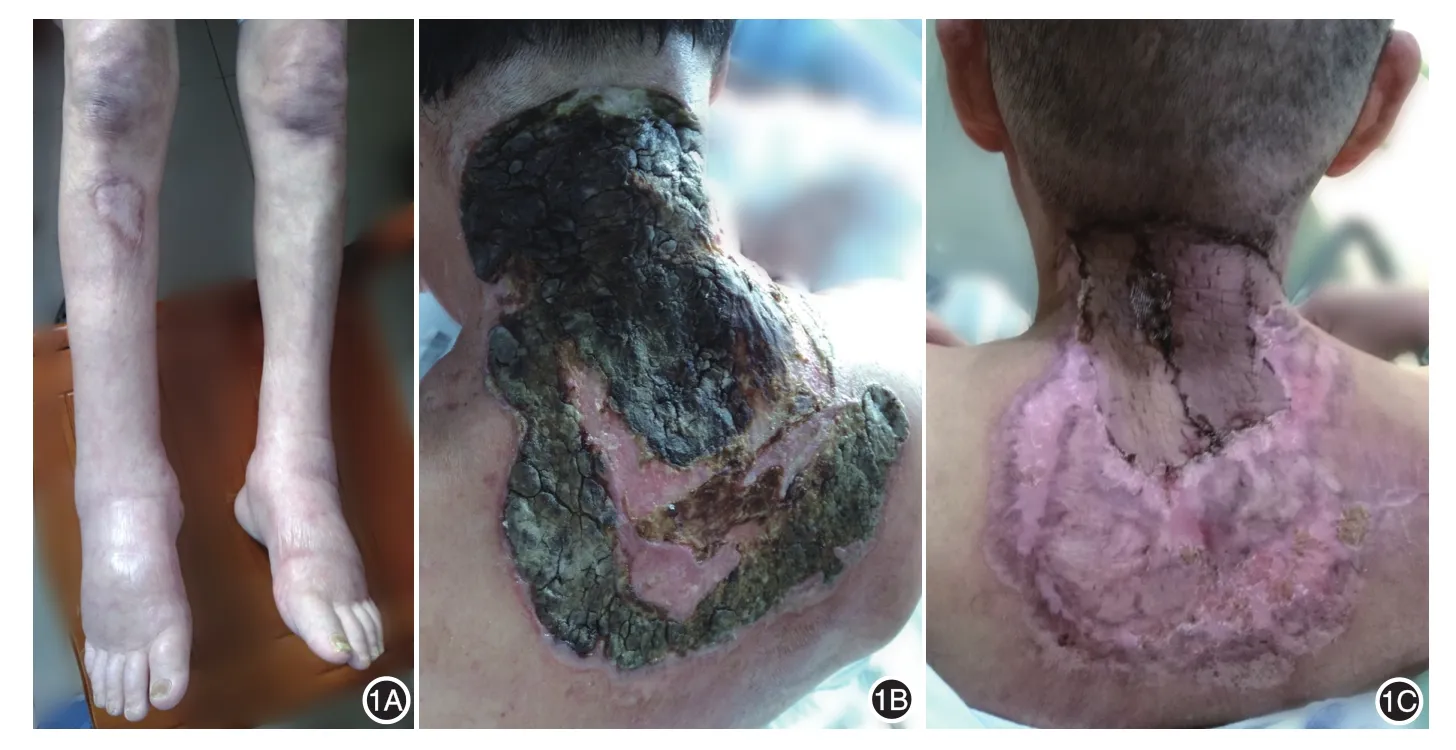
圖1 潰瘍型壞疽性膿皮病合并皮膚真菌感染患者潰瘍治療前后表現 1A:治療前雙下肢凹陷性水腫;1B:治療前頸背部大片不規則潰瘍,邊界清楚,上覆厚層褐色干燥性痂皮,潰瘍中央見紅色肉芽組織;1C:治療2個月后,背部形成淡紅色篩狀瘢痕
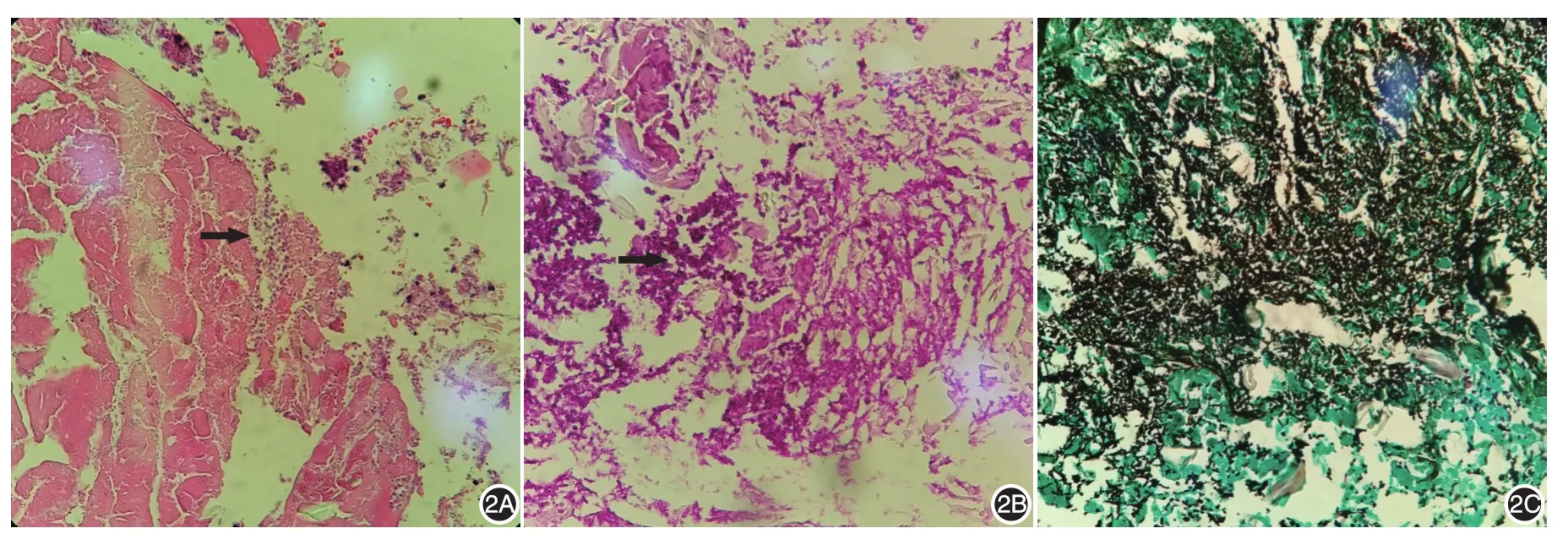
圖2 皮損組織病理表現 2A(HE×200)、2B(HE×400):表皮缺失,可見纖維脂肪組織及少量橫紋肌組織,部分區域大片壞死、化膿;箭頭示大量真菌菌絲及孢子;2C:六胺銀染色陽性,見大量呈黑褐色的菌絲及孢子(×400)
討論PG是一種以皮膚破壞性潰瘍和疼痛為特征的非感染性嗜中性皮膚病,臨床少見,病情較嚴重,常伴有潛在的系統疾病。臨床上本病按皮損特點分為潰瘍型、化膿型、大皰型和增殖型4型[1],本例依據臨床特點屬于潰瘍型。PG的病因及發病機制尚不明確,目前多歸于免疫系統疾病。PG的組織病理無特異性,可因皮損的類型、位置及治療等不同而表現不同。2018年,Delphi共識[2]提出了PG的診斷標準,包括1個主要標準和8個次要標準,主要標準是潰瘍邊緣活檢提示中性粒細胞浸潤,8個次要標準包括:①排除感染(組織學染色或組織培養);②病理性反應(外傷部位潰瘍);③炎性腸病或炎性關節炎病史;④皮損出現后4 d內有丘疹、膿皰或水皰、潰瘍;⑤外周紅斑,邊界破壞,潰瘍部位壓痛;⑥多發性潰瘍,至少1處位于小腿前側;⑦潰瘍愈合部位呈篩狀或“皺褶紙”樣瘢痕;⑧使用免疫抑制劑1個月內潰瘍變小。除了活檢示中性粒細胞浸潤外,還必須至少滿足4個次要標準才可以診斷PG。
本例經多次分泌物培養提示真菌感染,血培養陰性,但患者皮損自發病以來長期明顯疼痛,期間曾自行外用多種藥物且外院予抗真菌治療,效果欠佳。根據病史、體征及外院病理結果(提示嗜中性粒細胞浸潤),排除腫瘤性和血管炎性疾病等所致潰瘍的可能。入院后經糖皮質激素及免疫抑制劑兼抗真菌治療3周后,皮損較前縮小,無新發,治療有效,符合Delphi共識的診斷標準,考慮為PG合并皮膚真菌感染。
目前PG的治療常以經驗性治療為主,主要分為局部藥物、系統藥物和其他手段[3]。局部藥物治療適用于早期或輕度PG患者,可聯合系統治療促進潰瘍愈合。最近一項針對英國66例PG患者的前瞻性研究[4]顯示,0.05%丙酸氯倍他索是最常用的PG局部治療方法,且43.8%的患者在6個月內通過局部治療痊愈,33%需要系統治療。對較為嚴重的PG病例,需行系統性藥物治療,目前糖皮質激素是治療PG應用最廣且最為有效的藥物。在給予充足劑量之后,糖皮質激素能夠快速控制臨床癥狀。另外,與免疫抑制劑如環孢素、環磷酰胺、苯丁酸氮芥、硫唑嘌呤、秋水仙堿等聯合使用可減少糖皮質激素的不良反應。Del Giacco等[5]報道1例PG患者在常規使用糖皮質激素及免疫抑制劑治療無效后,聯合使用英夫利西單抗治療12個月,皮損愈合無復發。
對于病情穩定但皮損經久不愈者,可進行外科清創、植皮,聯合高壓氧治療[6]。局部手術清創治療能促進正常組織生長和修復,及時進行清創手術可明顯加速疼痛緩解和組織修復[7]。在1篇多中心病例分析報道中,15例PG患者在適當的免疫調節治療后接受植皮手術和負壓創傷療法(negative-pressure wound therapy)[8],10例皮損完全愈合,3例病情明顯改善,90%以上的創面愈合,2例出現輕微復發。Mazokopakis等[9]曾報道1例PG患者經系統藥物治療后潰瘍長期不愈,接受多次高壓氧治療后潰瘍痊愈。本例患者經抗炎及抗真菌治療后,疼痛較前稍緩解,但仍反復發作,局部厚層痂皮不易脫落,行清創和植皮手術后,創面恢復良好,形成淡紅色篩狀瘢痕,無新發潛行皮損。半年后隨訪本例患者,皮損無復發,偶感頭暈,頸部活動度可。
利益沖突所有作者均聲明不存在利益沖突

