清熱化瘀方通過調控自噬相關基因P62/LC3保護大鼠腦缺血再灌注損傷*
胡躍強,陳 煒,祝美珍,梁 妮,吳 林,唐 農△
1.廣西中醫藥大學第一附屬醫院 (南寧 530023);2.廣西中醫藥大學(南寧 530001)
最近的研究結果提示,自噬在腦缺血再灌注損傷(Ischemia/reperfusion,I/R)過程中發揮重要的作用。在自噬過程中,自噬因子如LC3、P62調節自噬的強度和持續時間,近年來受到廣泛的關注[1]。P62與LC3的直接作用招募自噬體降解聚集蛋白并引起自噬激活[2],但其在腦I/R損傷中的信號調控機制鮮見。清熱化瘀方是治療腦梗死有較好療效的中藥復方制劑[3],前期研究證實其有抗內質網過度應激的作用,由于內質網應激和自噬密切相關[4],因此我們試圖探討本方可能通過調節自噬發揮神經保護作用。本研究即是通過探討該方對P62和LC3表達的影響,以進一步闡明其抗腦缺血損傷的機制。
材料與方法
1 實驗材料
1.1 藥物制備:①清熱化瘀方:由水牛角、生牡蠣各30 g,丹參、赤芍各15 g,地龍、石菖蒲、郁金、川芎、天竺黃各10 g,酒大黃6 g等藥物組成,單味中藥濃縮顆粒劑由江陰天江藥業有限公司提供(批號:0904099)。②清開靈顆粒:由哈爾濱一洲制藥廠制備(國藥準字Z10930010)。
1.2 動物分組及動物飼養:雄性SD大鼠160只,SPF級,體質量250~300 g(合格證號:SCXK2016-0002)。將大鼠采用隨機數字表法分為4組:即假手術組(Sham-operation,SO)、模型組(Ischemia/reperfusion,I/R)、清熱化瘀顆粒組(Qingre Huayu,QRHY)和清開靈顆粒對照組(Qingkailing,QKL)。每組按再灌注后處死的時間點再分為12 h、1 d、2 d、3 d 四個亞組(n=10)。各組大鼠分別作如下處理:SO 組:以假手術代替缺血再灌注;I/R組:動物行大腦中動脈梗阻 2 h,再灌注后規定時間點處死;造模后灌胃等體積的生理鹽水;QRHY 組:在制作大鼠模型前 30 min予以QRHY顆粒溶液灌胃14 g/(kg·d),在造模麻醉清醒后 1 h 繼予該顆粒灌胃,每天上、下午各 1 次;QKL 對照組:在制作大鼠模型前 30 min予以QKL顆粒溶液灌胃 20 g/(kg·d),在造模麻醉清醒后 1 h 繼予該顆粒灌胃,每天上、下午各 1 次。動物灌胃濃度及等效劑量按人和動物間體表面積比值表折算獲得。
1.3 主要試劑:總RNA 提取試劑盒(北京天根公司);PCR反應試劑盒及逆轉錄試劑盒Trizol reagent(日本Takara);引物及內參(桂林恒順公司);小鼠抗大鼠 P62及兔抗LC3單克隆抗體(英國Abcam);羊抗小鼠或兔 IgG二抗(北京中杉公司)。
1.4 造模方式:采用Longa’s法并加以改良。大鼠術后2 h將尼龍線輕輕拔退約2 cm,此時記為再灌注0 h,假手術插線深度為9 mm。術后單籠飼養,進食顆粒食物。取腦時發現有蛛網膜下腔出血及提前死亡的大鼠予以剔除。
2 實驗檢測方法
2.1 電子透射顯微鏡觀察:神經元自噬及形態學改變將大鼠右側海馬分離,切割成約1 mm3大小,固定于2.5%戊二醛溶液中。0.01 mmol/L磷酸緩沖液漂洗3次,后固定于1%鋨酸緩沖液中2h,再予50%丙酮脫水10 min、浸透,然后包埋、切片及檸檬酸鉛與醋酸鈾雙重染色染色。最后H-600型透射電子顯微鏡(日本日立)攝片觀察。
2.2 熒光定量PCR檢測:P62和LC3 mRNA表達變化①按TRIzol提取細胞總RNA,合成cDNA;②目的基因引物序列: P62:上游引物5’- ACCCATCCACAGGTGAA CTC-3’;下游引物 5’-GTGGG AGATGTGGGTACAGG-3’;LC3:上游引物5’-GCAGCCT GGATGTTCAGAAT-3’,下游引物 5’- TGGATTGCCTGAGACTCCTT-3’;β-actin:上游引物TGTCACCAA CTGGGA CGATA;下游引物GGGGTGTTGAAGGTCTCAAA;③反應條件:反應體系均為10 μl,在 DNA Engine Opticon TM 2 連續熒光檢測系統中進行擴增反應。PCR反應條件為:96 ℃ 4 min,然后3步反應:94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共進行40個循環,第3步72 ℃ 30 s收集熒光信號,同時擴增β-actin做內參照。⑤結果處理:ΔΔCT法:A=CT(目的基因)-CT(內標基因),B=CT(目的基因)-CT(內標基因),K=A-B,表達倍數=2-K。ΔCT值與mRNA表達量成反比,即ΔCT值越小,表明mRNA表達量越多。
3 Western blot檢測P62和LC3蛋白表達測定①標本的制備:在SDS上樣緩沖液中裂解大鼠缺血半暗帶組織; ②SDS-PAGE電泳:制備電泳凝膠,進行SDS-PAGE;③轉膜:恒流1 mA/cm2,轉移1.5 h。將有蛋白標準的條帶染色,放入膜染色液中50 s后,在50%甲醇中多次脫色,至背景清晰。④雜交:用0.01 M PBS洗膜,5 min×3次。加入稀釋好的鼠抗P62和LC3一抗,4℃ 放置12 h以上。然后加入辣根過氧化物酶偶聯的二抗,室溫2 h。最后加入顯色液。⑤檢測:增強化學發光檢測(ECL)。⑥結果處理:獲取各組免疫印跡條帶的平均吸光度(A)值,內參為β-actin,目的蛋白的相對值=目的蛋白/內參A值。

結 果
1 各組腦組織超微結構變化 SO組大鼠神經元結構完整,未見細胞自噬結構;I/R組大鼠神經元線粒體腫脹,可見空泡樣變性,部分內質網及嵴破裂,并見不同程度自噬溶酶體形成(見紅色箭頭),胞核染色質固縮;部分神經元出現凋亡改變,核染色質形成半月狀的或結節狀的團塊附著于核膜下,核膜碎裂;QRHY干預后較I/R組神經元細胞器損傷明顯減輕,自噬及凋亡程度顯著降低(圖1)。
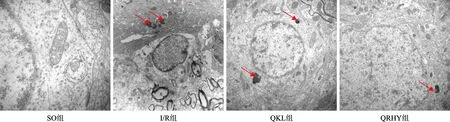
圖1 各組2d透射電鏡染色結果(×15000)
2 各組P62 mRNA表達變化SO組有少量P62 mRNA表達 I/R組大鼠腦缺血再灌注缺血半暗帶P62 mRNA表達于1 d時最低(P<0.01),隨再灌注時間點延長其表達仍維持較低水平 (P<0.05);與I/R組比較,QKL能明顯升高各時間點其表達水平 (P<0.05);QRHY能較QKL進一步升高各時間點其表達水平 (P<0.05)。見表1。

表1 大鼠缺血半暗帶P62 mRNA表達的ΔCT比較
注:與 SO 組比,#P<0.05,▲P<0.01;與I/R組比,*P<0.05;與QKL組比,ΔP<0.05,◇P<0.01
3 各組P62蛋白表達變化 SO組可檢測到較弱的P62蛋白表達,I/R組大鼠腦缺血再灌注缺血半暗帶P62蛋白12 h開始降低,于1 d時最低(P<0.01),隨再灌注時間點延長其表達仍維持較低水平(P<0.05);與I/R組比較,QKL能明顯升高各時間點其表達水平 (P<0.05);QRHY能較QKL進一步升高各時間點其表達水平 (P<0.05,P<0.01)。見表2和圖2。
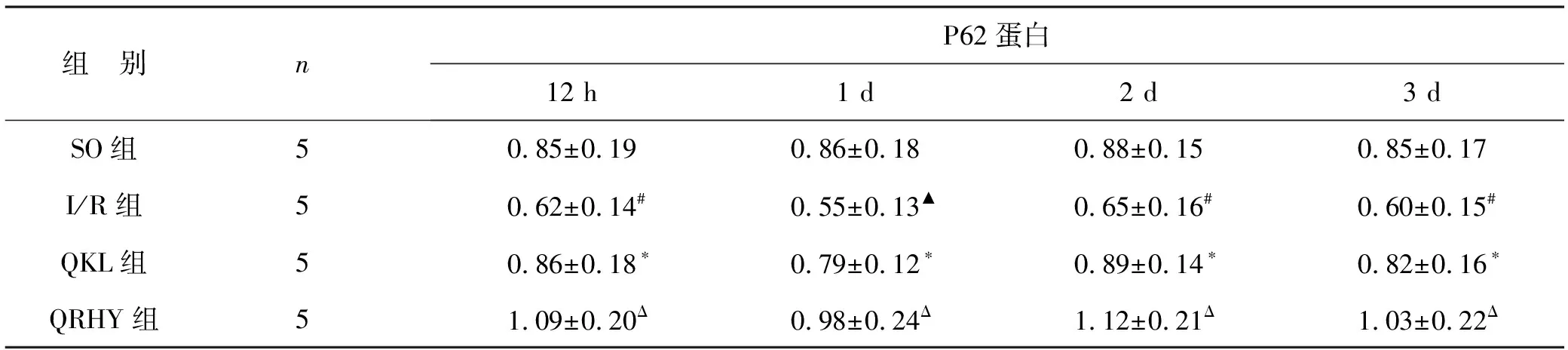
表2 各組P62蛋白表達的OD值比較
注:與SO組相比,#P<0.05,▲P<0.01;與I/R組相比,*P<0.05;與QKL組比較,ΔP<0.05
4 各組LC3 mRNA表達變化SO組有少量LC3 mRNA表達;I/R組大鼠其表達1d到達高峰(P<0.01),隨再灌注時間延長其表達逐漸下降,但3 d時仍維持較高表達水平(P<0.05);與I/R組比較,QKL能明顯降低各時間點其表達水平 (P<0.05);QRHY能較QKL進一步降低各時間點其表達水平 (P<0.05)。見表3。
5 各組LC3蛋白表達變化 假手術組可檢測到較弱的LC3蛋白表達,模型組大鼠腦I/R損傷12 h其表達開始升高,1 d時達到高峰(P<0.01),其后表達漸趨下降,但3 d時仍維持較高水平表達 (P<0.05);清開靈能明顯降低各時間點其表達水平 (P<0.05);清熱化瘀方能較清開靈進一步降低各時間點其表達水平 (P<0.05)。見表4和圖3。
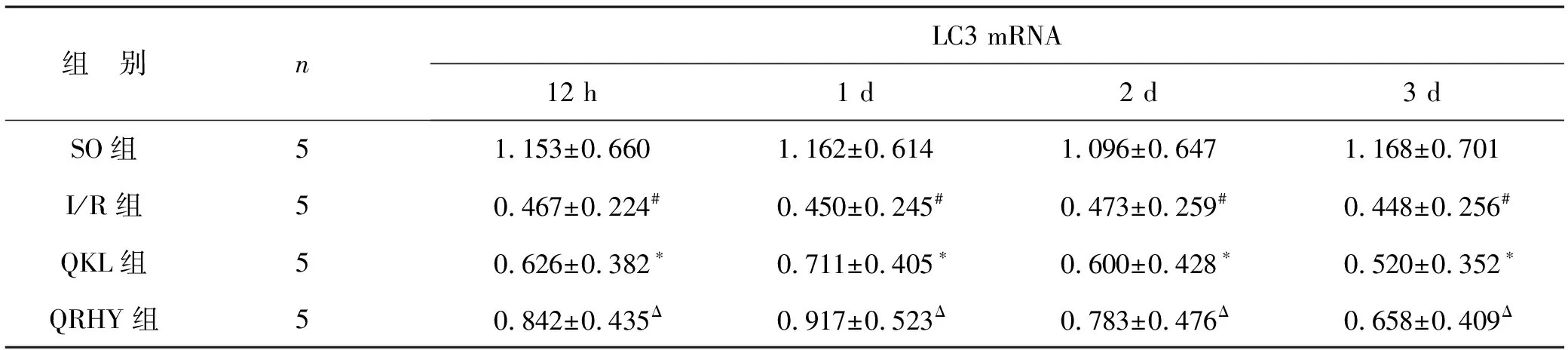
表3 各組LC3 mRNA表達變化比較
注:與 SO 組相比,#P<0.01;與I/R組相比,*P<0.05;與QKL組相比,ΔP<0.05
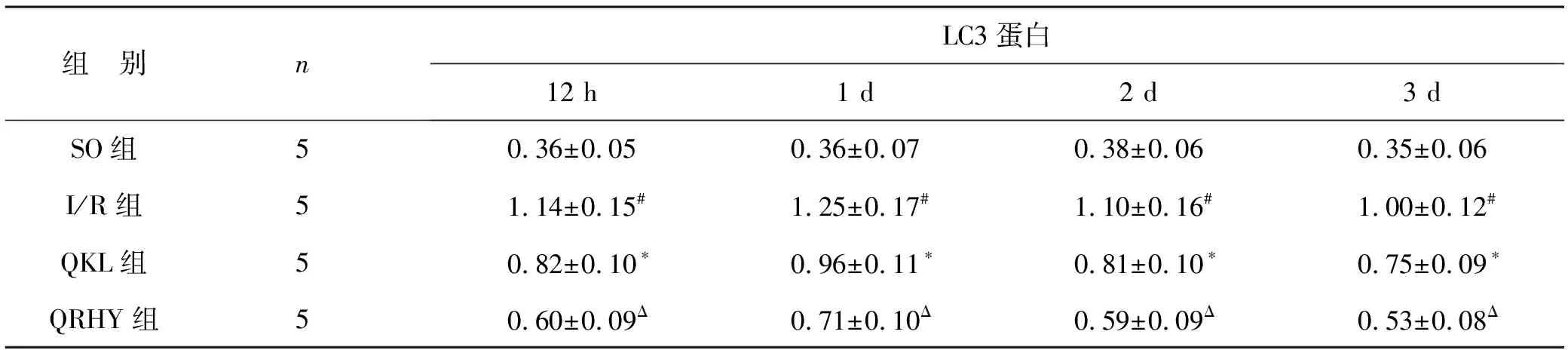
表4 各組 LC3蛋白表達的OD值比較
注:與SO組相比,#P<0.01;與I/R組相比,*P<0.05;與QKL組相比,ΔP<0.05
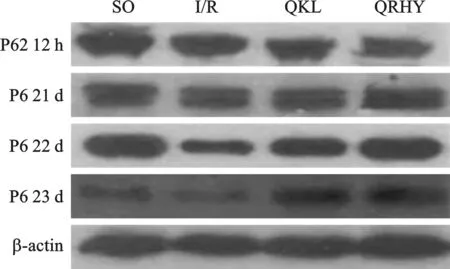
圖2 各組P62蛋白的表達圖(Western blot)

圖3 各組LC3蛋白的表達圖(Western blot)
P62作為一種自噬底物,是自噬的首選靶位,在選擇性自噬過程中起重要作用,是最先發現并被廣泛研究的自噬負荷物受體,同時它參與多種細胞信號轉導調控及自噬過程,在對抗氧化應激及線粒體凋亡等方面起著重要的作用[5]。它可以直接和微管結合蛋白輕鏈3(LC3)相結合,通過N端再與定位于自噬小體內膜上的 LC3-II 蛋白形成復合物,一同在自噬溶酶體內降解并引起自噬[6-7]。出現自噬時,在細胞質中 P62 蛋白不斷被降解;當自噬活性減弱或功能缺陷時,P62 蛋白會在細胞質中不斷累積[8-9]。微管相關蛋白輕鏈3(LC3)在自噬體和溶酶體膜上存在,其表達量的多少可以間接反映自噬體和溶酶體的多少,由此可將LC3 看作自噬體體形成的關鍵分子[10]。許多研究表明,在包括低氧缺血、局灶性或全腦缺血動物模型中,自噬能夠在神經元中被誘導,且神經元的凋亡可能受自噬調節[11-13]。但有關P62/LC3介導的自噬信號通路在腦缺血損傷中的調控機制鮮有研究。因此,探討其在腦缺血損傷中的作用,可為腦保護治療提供新靶點和新思路。
我們認為中風病病變的核心在于“腦絡”,其病機的核心是氣血逆亂。主要的病機是痰瘀阻滯腦絡,痰淤郁久化熱,繼而產生各種毒性物質,引發腦髓受損加重。由于痰瘀火熱密切相關,故痰毒、瘀毒、熱毒往往交織為患,故認為淤痰熱毒并治抗急性腦缺血損傷是提高中風療效的關鍵和重要策略[14]。針對以上病機, 本課題組提出“清熱解毒,化瘀通絡”的治則治法,使毒邪去則絡脈不再受損而易復,絡通則氣血暢,神機自復。具有解毒、化痰祛瘀之功效的解毒化瘀方可能正是根據這一思想所創制。前期研究證實其可以顯著減輕內質網應激反應,減少神經元凋亡等神經保護作用[15-16]。基于該方前期的抗內質網應激效應,我們推測其可能通過P62介導的信號通路發揮調控細胞自噬的作用。
本研究結果顯示腦缺血再灌注損傷后,P62表達明顯下調,而LC3表達明顯上升,這表明腦缺血損傷后細胞自噬明顯加劇,而過度激活的自噬可引起細胞裂解而死亡,即自噬性細胞死亡[17-18]。清熱化瘀方可能正是通過升高P62的表達以及減少LC3的表達從而抑制自噬的過度激活,發揮神經元保護的作用。

