表達KsdD 重組大腸桿菌的構建及轉化工藝優化
湯 睿,申雁冰,耿宇菡,趙云秋,王 敏
工業發酵微生物教育部重點實驗室,天津市工業微生物重點實驗室,天津科技大學生物工程學院,天津 300457
甾體藥物是僅次于抗生素的第二大類藥物,在臨床上具有重要應用。目前,對甾體骨架結構的修飾和改造是甾體藥物主要的合成途徑,包括羥化、脫氫、側鏈降解等[1-3]。其中,甾體化合物的C1,2 位脫氫反應在甾藥合成中具有重要意義,在甾體藥物的C1,2 位引入雙鍵有助于其藥用效能的提高[4-6]。而化學法脫氫過程中總伴有硒的殘留,且很難去除;因此采用微生物催化的方法進行甾體化合物的脫氫反應具有重要意義。
催化甾體化合物的C1,2 位脫氫反應的關鍵酶是3-甾酮-Δ1-脫氫酶(KsdD[EC 1.3.99.4]),為了提高甾體C1,2 位脫氫效率,一方面可以通過遺傳學操作手段,提高分支桿菌或簡單節桿菌等菌體自身KsdD蛋白的基因表達水平[7];另一方面可以將KsdD蛋白于大腸桿菌、枯草芽孢桿菌、畢赤酵母等工程菌株中外源表達,構建具有C1,2 位脫氫能力的工程菌株。已有研究將煙曲霉來源的ksdDF基因于Pichia pastorisGS115 中進行外源表達[8],使1.5 g/L 底物雄甾-4-烯-3,17-二酮(AD)幾乎能夠全部被轉化,但P.pastoris的培養周期較長,此外由于P.pastoris中存在17β-羰基還原酶的作用,其產物中還有寶丹酮的產生。雖然將Mycobacterium neoaurumJC-12 來源的ksdD基因于Bacillus subtilis中進行外源表達[9],可使AD 的轉化率達65.7%,為野生菌株的18 倍,但其轉化效率依然無法達到工業生產的需求。因此,為了解決現有研究中存在的工程菌生長代謝周期長、催化脫氫的KsdD酶活性低等問題,本研究通過蛋白序列及關鍵氨基酸位點的比對分析,結合酶活性及催化性能比較,篩選出具有較高C1,2 位脫氫催化活性的KsdD蛋白,并構建了含有該KsdD蛋白的大腸桿菌重組表達菌株;經對該重組大腸桿菌轉化底物AD 條件的優化,實現了產物雄甾-1,4-二烯-3,17-二酮(ADD)的高效生產,為利用工程菌株高效生產C1,2 位脫氫甾體化合物的研究奠定了理論基礎。
1 材料和方法
1.1 材料和試劑
1.1.1 菌株和質粒Escherichia coliBL21 (DE3),Rhodococcus rhodochrousDSM43269,A.simplexCPCC 140451,M.neoaurumTCCC 11028 MNR(MNR):本實驗室保藏;pET28a(+):本實驗室保藏。
1.1.2 培養基LB 培養基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10,pH 7.5。固體培養基中添加2%瓊脂粉。固體和液體培養基在需要時加入卡那霉素50 μg/mL。
簡單節桿菌培養基(g/L):葡萄糖10,玉米漿10,蛋白胨5,磷酸二氫鉀2.5,pH7.2。
分枝桿菌培養基(g/L):磷酸氫二鉀0.5,硫酸鎂0.5,檸檬酸鐵銨0.05,檸檬酸2,硝酸銨2,丙三醇20,葡萄糖5,碳酸鈣10。
紅球菌培養基(g/L):蛋白胨4,酵母膏12,葡萄糖12,pH 7.0。
1.1.3 化學試劑 葡萄糖、乙酸乙酯:天津市福晨化學試劑廠;酵母提取物、胰蛋白胨:英國OXOID公司;甲醇(色譜純):天津市康科德科技有限公司;AD(D)(≥98%):天津市津津藥業有限公司;羥丙基-β-環糊精(HP-β-CD):西安德立生物化工有限公司;DNA 聚合酶、DNA 連接酶、限制性內切酶:大連寶生物工程有限公司;IPTG、卡那霉素、質粒提取試劑盒、DNA 純化回收試劑盒、切膠回收試劑盒:北京Solarbio 科技有限公司;細菌基因組DNA 提取試劑盒:北京天根生化科技有限公司;其他試劑均為分析純:國藥化學試劑有限公司。
1.2 儀器
ZHWY-211F 恒溫搖床:上海智誠分析儀器制造有限公司;PCR 基因擴增儀:德國Eppendorf 公司;UVmini-1240 紫外可見分光光度計:日本島津公司;DYY-6C 電泳儀:北京市六一儀器廠;Agilent1260 型高效液相色譜儀(HPLC):美國安捷倫科技有限公司。
1.3 方法
1.3.1 重組菌株的構建方法 首先根據已報道的ksddR2(GenBank:KU257604)、ksddM(GenBank:GQ228843.1)及KsdDA(GenBank:BAA07186.1)的基因序列設計引物(表1),采用細菌基因組DNA 提取試劑盒分別提取R.rhodochrousDSM43269、M.neoaurumTCCC 11028 MNR 及A.simplexCPCC 140451 基因組DNA,并以獲得的基因組序列為模板,通過表1 中的引物對目的基因ksdd序列進行擴增。將獲得的基因片段與大腸桿菌表達載體pET28a 經限制性內切酶NcoI 和Hind III 雙酶切后,按插入片段:載體片段=3:1 的比例進行連接,分別獲得重組表達質粒pET28a-KsdDR2、pET28a-KsdDM及pET28a-KsdDA。然后將成功構建的重組質粒經化學轉化法分別轉入大腸桿菌BL21(DE3)感受態細胞中,37 ℃培養過夜,挑取陽性克隆子,經金唯智公司測序驗證后,獲得分別含有目的基因KsdDR2、KsdDM及KsdDA的重組大腸桿菌表達菌株。
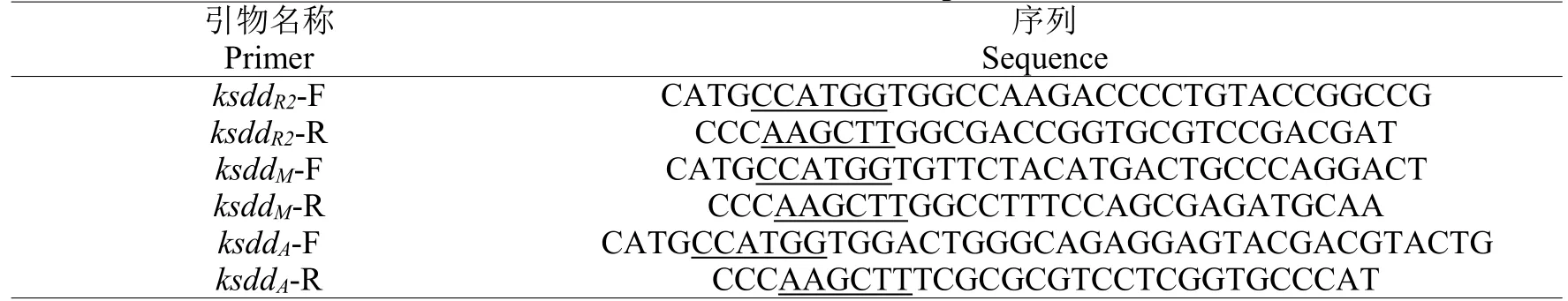
表1 本實驗所使用的引物Table 1 Primers used in this experiment
1.3.2 培養及轉化方法 將重組大腸桿菌以1%的接種量接種于5 mL 含卡那霉素的LB 液體培養基中,37 ℃,200 r/min,過夜培養。再以1%的接種量接種于含50 mL 新鮮LB 培養基的250 mL 搖瓶中,培養至OD600 約為0.6 左右,加入IPTG 至終濃度0.2 mM,16 ℃,200 r/min,誘導培養16~18 h,取樣進行SDS-PAGE 分析。
向誘導后的發酵液中投加2%甲醇(或2%乙醇、2%吐溫80、與AD 摩爾比為1:1 的HP-β-CD)助溶的1.2 g/L 底物AD,30 ℃(或20 ℃、25 ℃、35 ℃),200 r/min 轉化3 d,每24 h 取樣1 mL,以等體積乙酸乙酯萃取后,進行TLC 及HPLC 分析。
1.3.3KsdD酶活測定方法 本研究參考Van der Geize 等測定KsdD酶活的方法(DCPIP 法)[10],對過表達菌株中KsdD酶活進行測定。將50 mM 的Tris-HCl(pH 7.0)、40 μM 的2,6-二氯酚靛酚(DCPIP)、1.5 mM 的吩嗪硫酸甲酯(PMS)、500 μM AD(溶于2%的甲醇)及適量的粗酶液在同一體系中混合均勻,采用分光光度計于600 nm,30 ℃下測定底物DCPIP 每分鐘的還原量nmol(?600nm=18.7×103cm-1M-1)。定義每分鐘還原1 nmol DCPIP 所需的酶量為1 個酶活單位,用mU 來表示。根據酶活定義得到酶活計算公式:。其中Vt為反應液總體積;Vs為待測樣品體積;e為摩爾吸光系數;L為比色杯光徑(cm)。其比酶活單位為mU/mg。
1.3.4 甾體化合物的測定方法 通過TLC 法對甾體轉化情況進行分析,取經乙酸乙酯萃取后的有機相,點板后在(乙酸乙酯:石油醚=3:2)的展開劑中展開,254 nm 下觀察硅膠板。
采用HPLC 法對甾體轉化率進行分析,取100 μL 經乙酸乙酯萃取后的有機相揮干后,以1 mL流動相復溶,用0.22 μm 濾膜對復溶樣品進行過濾,然后通過HPLC 檢測,色譜柱為Phenomenex C18(5 μm,250 mm×4.6 mm),流動相為甲醇:水(80:20,v/v),流動相流速為1 mL/min,柱溫為30 ℃,檢測波長為254 nm。
2 結果與分析
2.1 KsdD 蛋白序列的篩選
KsdD是催化底物AD 合成ADD 的關鍵酶,目前只有來自于R.erythropolisSQ1 的KsdDSQ蛋白晶體結構得到解析,其蛋白活性中心有四個關鍵氨基酸殘基Tyr119,Tyr318,Tyr487 和Gly491 對酶的催化活性至關重要[11];且實驗室前期研究發現,分枝桿菌中的KsdDM蛋白分別與其對應的Tyr125、Tyr365、Tyr541 及Gly545 位點同樣對酶的催化活性必不可少,且位點Tyr122 及Ser138 對酶的催化活性也同樣重要[12,13]。于是,我們通過氨基酸序列比對,自GenBank 數據庫中篩選出11種不同來源的KsdD蛋白,并對這些蛋白與已報道的KsdDSQ進行了序列比對,對其作用的關鍵氨基酸位點進行了分析。

圖1 不同來源KsdD 氨基酸序列比對Fig.1 Comparison of KsdD amino acids sequences from different sources
由圖1 中可以看出,除KsdD1外,其余11 種KsdD中均存在Tyr125、Tyr365、Tyr541 及Gly545四個關鍵氨基酸位點;而在這些KsdD中,僅有KsdDM,KsdDR2,KsdDR3三種KsdD同時存在Tyr122及Ser138 關鍵氨基酸位點,其余KsdD中相應位點均由不同的氨基酸殘基所取代。而由實驗室前期研究發現,KsdDR2的C1,2 位脫氫能力要強于KsdDR3,且由RT-qPCR 驗證發現,KsdDR3不能被AD所誘導[14];此外,由于簡單節桿菌是工業上已廣泛使用的脫氫菌株[15],因此本研究從KsdDR2、KsdDM及KsdDA三種蛋白中進一步篩選具有較高脫氫活性的KsdD蛋白。
2.2 含KsdD 基因重組大腸桿菌的構建
為了進一步篩選出具有較高脫氫活性的KsdD蛋白,本研究采用1.3.1 中的方法分別構建了含有目的基因KsdDR2、KsdDM及KsdDA的重組大腸桿菌表達菌株。將菌株通過1.3.2 中所述的方法進行IPTG 誘導表達,結果如圖2 所示。可以看出,與對照組相比,三株重組大腸桿菌均在60 kDa 左右位置有明顯差異條帶,這表明三株重組大腸桿菌中的目的基因均獲得成功表達。
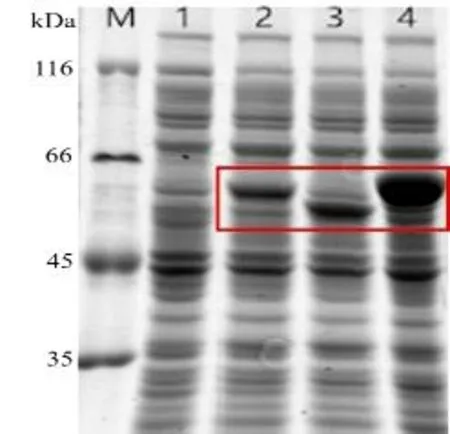
圖2 重組大腸桿菌的SDS-PAGE 分析Fig.2 SDS-PAGE analyses of recombinant E.coli BL21
2.3 重組大腸桿菌KsdD 酶活比較及轉化性能分析
為了進一步比較含有目的基因KsdD的重組大腸桿菌的C1,2位脫氫活性差異,本研究采用DCPIP法對重組大腸桿菌中KsdD的酶活進行了測定。結果如表2 所示,三種重組大腸桿菌中均檢測到KsdD酶活,且過表達KsdDR2的重組大腸桿菌的酶活明顯高于KsdDM,而KsdDA的重組大腸桿菌酶活最低,僅為KsdDR2的64.2%,這表明過表達KsdDR2的重組大腸桿菌具有更高的C1,2 位脫氫能力。由此可見,Ser138 及Tyr122 氨基酸殘基對KsdD酶的催化活性至關重要,這與實驗室前期研究結果相符[12,13]。

表2 過表達KsdD的重組大腸桿菌酶活分析Table 2 The specific activity of different recombinant E.coli BL21 strains

圖3 重組大腸桿菌對AD 轉化水平的分析Fig.3 Analysis of AD transformation level by recombinant E.coli BL21
對三種重組大腸桿菌對底物AD 的轉化能力進行了分析,結果如圖3。由TLC 分析結果可以看出,過表達KsdDR2的重組大腸桿菌對底物AD 的轉化能力,明顯高于過表達KsdDM或KsdDA的重組大腸桿菌。進一步經HPLC 分析發現,底物AD 經過表達KsdDR2的重組大腸桿菌轉化后,其轉化率達到85%,分別比過表達KsdDM或KsdDA重組大腸桿菌的轉化率高出16%及59%(圖4);且初始轉化速率較過表達KsdDM或KsdDA重組大腸桿菌分別提高了0.56 倍和4 倍。而李玉[16]和張成剛[17]等的研究也指出,KsdDM或KsdDA在大腸桿菌中表達多會形成包涵體,這也是嚴重影響其脫氫酶活性的關鍵因素之一。因此我們認為,脫氫酶KsdDR2在重組大腸桿菌中具有更高的催化活性,更有利于產物ADD 的積累。
2.4 含KsdDR2蛋白的重組大腸桿菌轉化條件優化
2.4.1 重組大腸桿菌轉化溫度對ADD 產率的影響 轉化體系的溫度會影響酶的活性,進而影響轉化的進行。為了探究本研究中過表達KsdDR2的重組大腸桿菌在轉化底物AD 時的最適轉化條件,我們首先探究了不同轉化溫度對AD 轉化的影響,結果如圖5 所示。ADD 的產率隨轉化體系溫度的升高而增加,當轉化體系中溫度達到30 ℃時,ADD 的產率達到85%;而當體系中溫度進一步增加時,ADD的產率反而有所下降。任堯等[18]在利用重組大腸桿菌進行黃體酮的催化研究中,也發現類似的現象因此在本研究中,轉化溫度為30℃時最有利于轉化的進行。
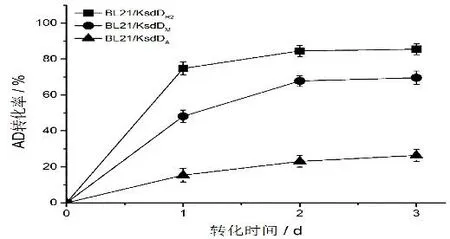
圖4 重組大腸桿菌對AD 轉化過程的分析Fig.4 Analyses of AD transformation process by recombinant E.coli BL21
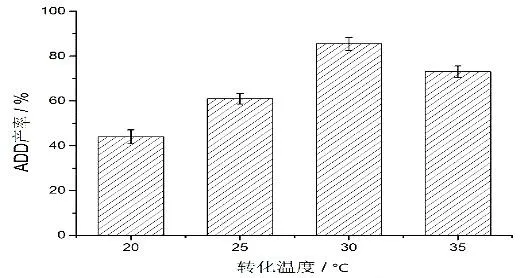
圖5 轉化溫度對ADD 產率的影響Fig.5 Effects of temperatures on the productivity of ADD
2.4.2 轉化體系中助溶劑種類對ADD 產率的影響 甾體化合物在水中的溶解度很低,這嚴重阻礙了菌體對底物的有效利用。而甲醇、乙醇等親水性有機溶劑,及吐溫80 等表面活性劑,對甾體化合物具有較好的溶解性,常被用作甾體轉化中的助溶劑[19-21];環糊精作為一種水溶性較高的促溶劑,以其特殊的結構特點,能夠在水溶液中選擇性地包結有機分子,形成不同穩定程度的包結物,由于其對菌體的毒副作用較小,已被廣泛地應用于甾體藥物的轉化中[22]。因此,本研究通過分析甲醇、乙醇、吐溫80 及HP-β-CD 等助溶劑對底物作用,以進一步提高菌體對底物的催化效率。由圖6 可以看出,在不同助溶劑的作用下,重組菌株對AD 的轉化能力不同;當在HP-β-CD 的作用下時,AD 的轉化率最高可達92%,相較于甲醇、乙醇和吐溫80 分別高出7%、21%和36%。這可能是由于有機試劑對菌體有不同程度的毒害作用,不利于菌體的生長及轉化的進行;而環糊精對甾體底物具有較強的增溶作用,且作用較溫和,對菌體毒害作用小,因此更有利于轉化的進行[23]。
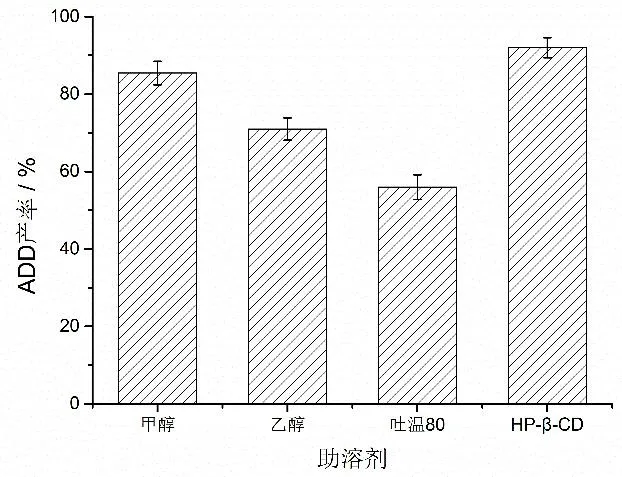
圖6 不同助溶劑對ADD 產率的影響Fig.6 Effects of different cosolvents on the productivity of ADD
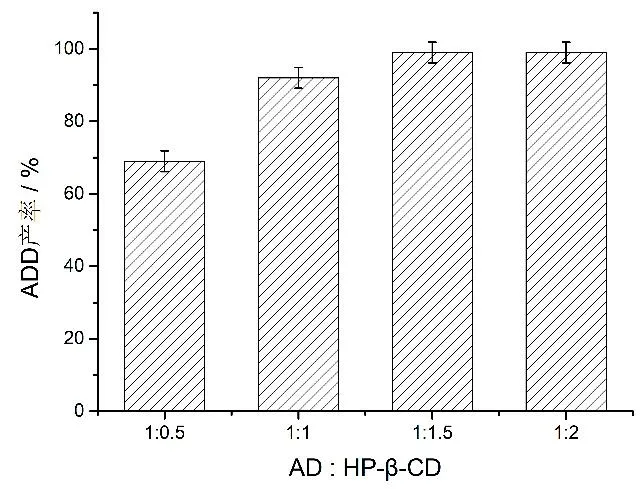
圖7 HP-β-CD 與AD 的摩爾比對ADD 產率的影響Fig.7 Effects of HP-β-CD and AD molar ratios on the productivity of ADD
2.4.3 HP-β-CD 添加量對ADD 產率的影響 此外,HP-β-CD 的添加量同樣會影響底物轉化率,為了進一步提高產物ADD 生成率,本研究還分析了不同底物AD 與HP-β-CD 的添加比例對ADD 產率的影響。結果如圖7 所示,隨著HP-β-CD 含量的增加,產物ADD 的生成率有所提升。當底物AD 與HP-β-CD的摩爾比達到1:1.5 時,產物ADD 的生成率達到99%;當HP-β-CD 含量繼續增加時,產物ADD 的生成率基本未變。因此,綜合考慮轉化成本和產物的獲得,我們認為底物AD 與HP-β-CD 的摩爾比為1:1.5 時更適合轉化的進行。
3 結論
C1,2 位脫氫反應是甾體化合物生物轉化中的一步重要反應,雖然催化該反應的關鍵酶KsdD蛋白廣泛存在于微生物細胞內,但因其序列的多樣性,多數KsdD蛋白在大腸桿菌中表達并不具有較高的催化活性。本研究結合相關報道,經蛋白序列的比對及關鍵氨基酸位點的分析,并結合酶活性分析及底物催化性能比較,篩選出于大腸桿菌中表達具有較高C1,2 位脫氫能力的KsdDR2蛋白。此外,由于甾體化合物較低的水溶性限制了轉化率的提高,因此本研究探究了不同助溶劑對甾體化合物的作用效果,最終確定HP-β-CD 對底物的增溶作用較好,更有利于轉化的進行。通過對過表達KsdDR2蛋白重組大腸桿菌的底物轉化條件進一步研究,確定底物AD 在30 ℃轉化條件下,經與摩爾比1:1.5 的HP-β-CD 的共同作用,可使AD 的轉化率達到99%,該研究為利用工程菌株高效生產C1,2位脫氫甾體化合物的研究奠定了理論基礎。

