兩種封管液預防大鼠中心靜脈導管置入后血栓形成效果比較
蔣慶娟,文萃,應燕萍,甘曉,韋艷,趙慧函
中心靜脈導管(Central Venous Catheter,CVC)已在長期靜脈輸液、腫瘤化療、腸外營養支持等領域廣泛應用[1]。盡管CVC具有諸多優點,但若維護不當,仍然會產生相關并發癥,其中,導管相關性血栓(Catheter-related thrombosis,CRT)是最常見、最嚴重的并發癥之一[2]。CRT可以引起肺栓塞、深靜脈血栓(Deep Vein Thrombosis,DVT)、血栓后綜合征和敗血癥等,嚴重時還會危及患者生命[3]。沖封管是導管日常管理的重要環節,是延長導管使用壽命及減少導管相關并發癥發生的關鍵措施。現臨床上多采用生理鹽水和肝素鹽水封管,許多學者對這兩種封管液的維護效果評價不一,臨床研究和Meta分析結果均存在較大爭議,尚缺乏動物實驗報道。鑒此,本研究通過建立CVC大鼠模型,模擬臨床輸液,比較生理鹽水和肝素鹽水兩種封管液預防CRT的效果,以期為臨床封管液的選擇提供動物實驗依據。
1 材料與方法
1.1材料 ①實驗動物:40只健康雄性SD大鼠,SPF級(Specific Pathogen Free,無特定病原體),體質量200~250 g,購于廣西醫科大學動物實驗中心(許可證號:SCXK桂2014-0002)。飼養于廣西醫科大學動物實驗中心SPF動物房,室溫20~25℃,濕度50%~60%,12 h光/暗周期循環,光線、通風良好,自由飲水、進食。所有動物實驗過程符合廣西醫科大學實驗動物倫理委員會要求。40只SD大鼠適應性喂養1周后,采用動物隨機分組軟件將其分為生理鹽水組(n=20)和肝素鹽水組(n=20),再將這兩組隨機分為維護后第1、4、7、10、14天組,共5個時間點,每組4只。②主要試劑與儀器:戊巴比妥鈉(上海容創生物技術有限公司)、頸靜脈導管及堵頭(2#,聚氨酯PU,思科諾思生物科技北京有限公司)、0.9%氯化鈉注射液(中國大冢制藥有限公司)、肝素鈉注射液(12 500 U/2 mL,上海上藥第一生化藥業有限公司)、10%中性甲醛固定液(北京索萊寶科技有限公司)、切片機(RM2245,德國Leica公司)、正置熒光顯微鏡(BX53,日本Olympus公司)。
1.2方法
1.2.1實驗方法 ①CVC置管手術方法:根據頸靜脈插管動物模型[4]及本課題組前期研究[5-6],進行CVC置管造模。用3%戊巴比妥鈉溶液,按1.5 mL/kg予腹腔注射麻醉[7]。麻醉滿意后,將大鼠以仰臥位固定于手術操作臺上,常規備皮、消毒、鋪巾。沿頸前正中線偏右側約0.5 cm處做一長約1.5 cm的縱行切口,逐層鈍性分離,充分暴露并游離出右頸外靜脈1.0~1.5 cm。在血管下穿2根4-0縫線,1根線臨時結扎頸外靜脈遠心端(待中心靜脈置管成功后松開),另1根線放置于近心端備用。在緊鄰遠心端結扎處的靜脈上剪一“V”形切口,從切口處向向心方向送入提前準備好的中心靜脈導管(導管內充滿生理鹽水且末端連接含生理鹽水的1 mL注射器)。在導管進入血管約3 cm時(已達上腔靜脈),回抽與導管末端連接的1 mL注射器,見回血并推注生理鹽水順暢后,將近心端的備用縫線結扎在導管的膨大節點處,以固定導管、防止導管脫出,逐層縫合頸部傷口。導管外露部分長約10 cm,用不銹鋼堵頭封閉導管末端后[8],將大鼠體位改為側臥位,于大鼠后頸皮膚剪開一長2 mm小口,用穿引針自頭部皮下向頸部切口穿出,造出皮下隧道[10],導管經皮下隧道穿出于后頸部,縫合固定。②導管維護方法:封管液現配現用。置管成功后,生理鹽水組立即予0.5 mL生理鹽水沖管再予0.5 mL生理鹽水封管。導管維護時,將大鼠置于固定器內,每次沖管前抽回血,確定導管在血管內之后,采用脈沖式沖管和正壓封管的方法。肝素鹽水組予0.5 mL生理鹽水沖管后,采用配制好的肝素鹽水(從12 500 U的2 mL肝素鈉中抽取0.1 mL加入10 mL生理鹽水,可得62.5 U/mL的肝素鹽水)0.5 mL封管(以人用肝素鹽水封管液劑量10 U/mL為參照,根據人與大鼠用藥劑量的折算系數為6.25[9],計算出大鼠用肝素鹽水封管液劑量為62.5 U/mL)。沖封管手法同生理鹽水組,每日維護1次,直至取材。
1.2.2標本采集與評價方法 于實驗第1、4、7、10、14天對不同組別大鼠取材,方法相同。即麻醉滿意后,將大鼠仰臥位固定于手術操作臺上,剪開其置管側皮膚,逐層鈍性分離,取下自穿刺點至上腔靜脈的血管組織約3 mL,共40個標本,浸泡于10%甲醛固定液48 h后,拔出導管。經脫水、石蠟包埋、切片,蘇木精-伊紅染色,在顯微鏡下觀察靜脈組織的血栓形成情況,比較各組大鼠成栓率(成栓率=形成鏡下血栓的大鼠只數/該組大鼠總只數×100%)。
1.2.3統計學方法 采用SPSS24.0軟件進行統計分析,兩樣本率的比較采用Fisher精確概率法。檢驗水準α=0.05。
2 結果
2.1造模及導管留置情況 兩組大鼠造模存活率100%,置管成功率100%,導管留置期間,生理鹽水組和肝素鹽水組各有1例導管脫出。生理鹽水組未發生堵管,肝素鹽水組2例堵管,均發生于置管后第4天,兩組堵管率比較,差異無統計學意義(P>0.05)。生理鹽水組14只(73.68%)大鼠形成CRT,肝素鹽水組15只(78.95%)大鼠形成CRT,兩組比較,差異無統計學意義(P>0.05)。兩組脫管、堵管及血栓形成情況比較詳見表1。
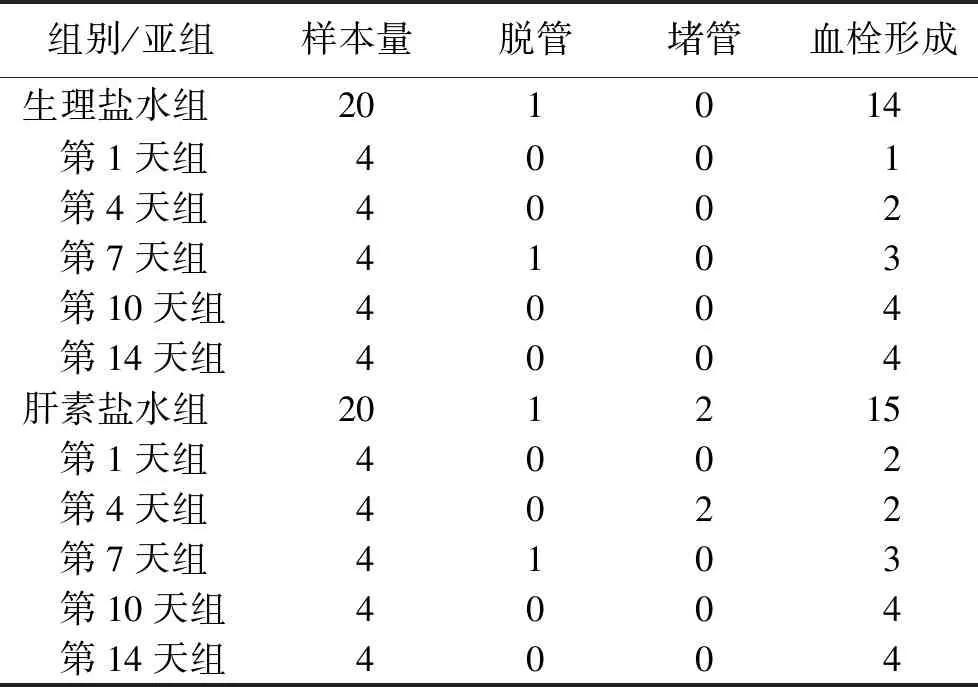
表1 不同組別脫管、堵管及血栓形成情況比較 只
注:兩組堵管和血栓形成率比較,均P=1.000。
2.2兩組不同時間CRT形態情況 正常靜脈由內膜、中膜、外膜組成,為中空管腔(圖1A)。導管置入后靜脈瓣膜內血流形成漩渦,血小板沉積,形成血小板梁,小梁周圍黏附白細胞。顯微鏡下主要由血小板和少量纖維蛋白構成。兩組比較,均為白色血栓,但生理鹽水組第1天的血小板聚集面積(圖1B)大于肝素鹽水組(圖1C)。置管后第4天大鼠開始形成混合血栓,在白色血栓的基礎上,小梁之間形成纖維蛋白網,網內充滿大量紅細胞。混合血栓鏡下主要由淡紅色無結構的呈分支狀或不規則珊瑚狀的血小板梁和充滿小梁間纖維蛋白網的紅細胞構成,血小板小梁邊緣可見有中性粒細胞附著。第4天兩組大鼠鏡下血栓形態基本相同(圖1D)。導管置入第7天可見血栓機化,堵塞部分血管腔,鏡下可見內皮細胞、成纖維細胞從血管壁長入血栓病逐漸取代血栓;第7天兩組形態無明顯區別(圖1E)。第10天機化的血栓繼續堵塞管腔,與肝素鹽水組(圖1F)相比,生理鹽水組(圖1G)堵塞面積相對較少。直至第14天,可見血栓完全機化,肉芽組織替代血栓,幾乎堵塞整個血管腔(圖1H),這一時期兩組血栓形態基本相同。
3 討論
3.1動物實驗可提供更直觀、全面的證據 美國靜脈輸液護理學會(Infusion Nurse Society,INS)在2016年修訂的《輸液治療實踐標準》中指出[10],中心靜脈導管封管液的選擇目前暫無臨床研究證據推薦。我國衛生與計劃生育委員會于2013年頒布的《靜脈治療護理技術操作規范》規定[11],對CVC可用生理鹽水或0~10 U/mL肝素鹽水進行封管。可見,尚無明確指南規定這兩種封管液的選擇。以往臨床研究報道評價指標多為靜脈炎和堵管,并未關注封管液對CRT的影響。血管造影雖是檢查血管疾病的金標準,但由于其侵入性,不能完全普及,而彩色多普勒超聲檢查依賴檢查者水平,若不熟練則易漏診,解剖變異及局部骨質阻擋聲波可能影響診斷,存在7.69%~8.00%的誤診和漏診[12-13]。因此,本研究通過建立CVC動物模型,對血管標本進行病理切片,動態觀察血栓的發生與演變過程,比較生理鹽水和肝素鹽水兩種封管液預防CRT的效果,以期對導管相關性血栓有更直觀的認識,為臨床封管液的選擇,提供動物實驗依據。

注:a血小板梁;b纖維蛋白網;c紅細胞;d肉芽
3.2置管后早期可形成CRT,應警惕無癥狀血栓的發生 血栓根據是否存在肢體腫脹、發紅、觸痛、皮溫升高、活動受限、感覺異常等臨床表現分為有癥狀血栓和無癥狀血栓[14]。無癥狀血栓由于體積小,未完全堵塞血管,故無明顯癥狀,在臨床上較為隱匿,難以發現。大部分患者都是出現血栓相關癥狀后才進行多普勒超聲檢查,所以臨床上發現的大多數是有癥狀血栓,使得占很大比重的無癥狀血栓發生率得不到有效篩查和統計。本研究通過病理切片,能全面、直觀地觀察到無癥狀血栓的發生情況,如圖1C所示,置管后第1天形成的白色血栓體積小,所占管腔面積小,此時并未完全堵塞血管。與國內發現的CRT最早形成的中位時間2~3 d相似[15]。血管內皮損傷、血流淤滯和血液高凝狀態是血栓形成的三大因素。中心靜脈導管可通過血管損傷和血流淤滯影響三要素。導管置入過程勢必會破壞血管內皮,另外,在留置期間導管在血管腔占據的位置會使局部血流下降40%~60%[16]。且導管本身的存在可提供血栓形成表面,進一步促使細胞粘附在導管和靜脈壁,創造有利于血栓形成的環境,因而在置管后第1天便可觀察到有微小的血栓形成。本研究結果顯示,生理鹽水組CRT發生率為73.68%,肝素鹽水組為78.95%,均比臨床研究報道的有癥狀CRT發生率(10.30%~30.77%)[17-18]高,與Hegerova等[19]報道的無癥狀血栓發生率為68.0%接近。置管后早期即可形成CRT,且缺乏明顯的臨床表現和體征,故容易延誤診斷和治療。因此,在護理中心靜脈導管患者時,要特別注意置管后早期對血栓的診斷與預防,警惕無癥狀血栓的發生,防止其進一步堵塞管腔,加重患者痛苦。
3.3生理鹽水和肝素鹽水預防CRT的優勢和不足 肝素為一種帶負電荷的強酸性黏多糖硫酸脂,可增強抗凝血酶3與凝血酶的親和力,加速凝血酶失活,抑制血小板黏附聚集,刺激血管內皮細胞釋放抗凝物質和纖溶物質。相比之下,生理鹽水價格經濟,使用方便,同時能減少使用肝素可能出現的出血、血小板減少、凝血障礙等不良反應。意大利一項回顧性觀察隊列研究未顯示二者在維持導管通暢方面有任何顯著差異[20]。國內外多項系統評價[21-23]結果表明,肝素鹽水在減少CRT,預防導管堵塞方面并不比生理鹽水更有效。相關研究指出,沒有確鑿的證據表明使用肝素和生理鹽水在功效和安全性方面存在不同[24-25]。INS《輸液治療實踐標準》將“肝素和氯化鈉用于中心血管通路裝置的封管效果是相同的,尚無充分的證據提示某個封管液優于其他”列為最高等級Ⅰ級證據[10]。本動物實驗表明,從總體來看,兩組堵管率和成栓率差異無統計學意義(均P>0.05),支持并驗證了上述證據。但從早期CRT形態和嚴重程度分析,置管后第1天肝素鹽水組白色血栓形成面積小于生理鹽水組,堵塞血管程度較輕,這可能與肝素能抑制血小板的黏附聚集,進而減少血小板梁的形成有關。此結果在一定程度上佐證了肝素鹽水能較好地預防靜脈血栓形成,有效預防血栓性堵管的觀點[26-27]。然而,第10天生理鹽水組機化的血栓比肝素鹽水組堵塞面積相對較少。因此,從長遠看,生理鹽水似乎比肝素鹽水更能減輕后期CRT的嚴重程度。
3.4本研究的局限性和今后的研究方向 本研究中外露的導管部分容易被大鼠撕咬或拉拽,導致脫管發生(兩組各發生1起),在今后的研究中可探索更科學有效的動物導管固定方法,以保障實驗的順利進行。本研究的局限性在于樣本量還不夠大,觀察周期較短,未來還需要更多大樣本、長時間的隨機對照實驗,為靜脈輸液治療的護理實踐提供更多循證支持。

