地西他濱對小鼠腎缺血再灌注損傷作用的實驗研究*
趙艷龍,田普訓,程小紅,丁晨光,田 耘,于小勇,史 健,徐 薇,張 鵬,宋阿苗
1.陜西省中醫醫院腎病醫院血液透析室(西安710003);2.西安交通大學第一附屬醫院腎臟病醫院腎移植科(西安710061);3.陜西省中醫醫院腎病醫院腎病科(西安710003)
腎缺血再灌注損傷 (Ischemia reperfusion injury,IRI)與急性腎損傷、慢性腎臟病及腎纖維化、移植腎急慢性排斥、移植腎功能延遲恢復等疾病的發病密切相關,有較高的發病率和病死率,目前仍缺乏有效的干預措施。DNA甲基化是一種表觀修飾方式,參與基因表達調整,與IgA腎病、慢性腎臟病的纖維化進展、糖尿病腎病等密切相關[1-4]。抑制DNA甲基化可能減低或阻止IRI導致的急性腎損傷(Acute kidney injury,AKI)向慢性腎臟病(Chronic kidney disease,CKD)進展的纖維化過程,但抑制DNA甲基化對早期腎IRI的影響未見報道。DNA甲基化參與氧化應激、炎癥反應等病理過程[5-7],而氧化應激、炎癥反應是腎IRI發病的重要病因,因此,我們推測干預DNA甲基化可能成為防治腎IRI的新策略或新方法。
地西他濱(Decitabine,DCA),即5-脫氧雜氮胞苷(5-aza-2deoxycytidine),是臨床上治療骨髓增生異常綜合征、慢性粒細胞白血病和急性髓性白血病等疾病的常用藥物[8],屬于DNA甲基轉移酶抑制劑(DNA methyltransferases,Dnmts),主要作用于增殖期(S期)細胞,使高甲基化的抑癌基因恢復正常的去甲基狀態,從而重新激活這些抑癌基因,發揮抑癌功能,恢復細胞正常終末分化[9-10]、肺炎[11-12]。有報道 DCA 可以增強腦對IRI的抵抗[13],因此,我們將DCA用于腎IRI,探索其治療腎IRI的可能。
材料和方法
1 實驗動物 雄性C57BL/6小鼠(8~10周,20~25g)購買并飼養于西安交通大學實驗動物中心SPF動物房,溫度20~26℃;相對濕度50%~80%,白天、夜晚時間均為12h,自由接觸水和飼料。
2 主要試劑 胎牛血清(Gibco公司);DMEM/F12培養基(Hyclone公司);地西他濱DCA(Pharmachemie B.V.);蘇木素伊紅(HE)染色試劑盒(博士德公司);細胞凋亡檢測試劑盒(南京凱基生物);羊抗鼠PCNA一抗(abcam公司);大鼠抗小鼠Ly6B一抗(AbD Serotec);調整性 T淋巴細胞(Treg)檢測試劑盒(ebioscience公司);流式抗體:PE標記抗鼠F4/80、PerCP標記抗鼠CD206(ebioscience公司);Tunel細胞凋亡檢測試劑盒(Roche公司);膠原酶Ⅳ、DNA酶Ⅰ(Worthington公司);小鼠淋巴細胞分離液(Cedarlane公司)。
3 體外HK-2培養及MTT檢測 用含100ml/L胎牛血清的完全培養基懸浮HK-2細胞,接種到培養皿中,輕輕吹打混勻,37℃50ml/L CO2飽和濕度條件下培養。取處于對數生長期、生長狀態良好的HK-2細胞,以2.0×103cells/孔接種于96孔板,每孔100μl細胞懸液,同時設空白組,37℃培養過夜,每孔再加入10μl MTT,37℃孵育4h,酶標儀測定各孔吸光值A568,判斷不同劑量DCA對腎小管上皮細胞增殖的影響。
4 HK-2凋亡檢測及缺氧-復氧模型建立 HK-2細胞以每孔5×105個接種于細胞培養6孔板,37℃、50ml/L CO2培養箱中培養過夜,更換含不同DCA濃度的培養基處理72h,流式細胞儀檢測不同濃度DCA對HK-2凋亡的影響;上述條件培養的細胞再予缺氧培養(20ml/L O2,930ml/L N2,50ml/L CO2)24h及復氧培養6h后,建立缺氧-復氧(A/R)或A/R+DCA模型。
5 小鼠腎IRI建立及DCA干預 20g/L水合氯醛按小鼠體重(0.02ml/g)腹腔注射麻醉,肋下脊柱兩側備皮1.5cm2,切口采用脊柱旁0.5cm、肋下0.5cm、平行脊柱的雙側切口,長1cm。先行左側切口,提取腎臟,鈍性分離腎蒂,暴露血管,無損傷血管夾夾閉左側腎動脈30min,使腎臟缺血。同法暴露右腎及血管,0號線結扎血管,切除右腎,間斷縫合皮下及皮膚。左腎血管夾閉到30min后,去掉血管夾,使腎臟再灌注,見腎臟變紅后回納腹腔,縫合(IRI組)。假手術組(Sham)除夾閉血管步驟外,執行相同的手術過程。DCA組為建立IRI手術前4d應用DCA[溶于PBS中,0.1mol/L,按 DCA0.5mg/(kg·d)腹腔注射]預處理C57BL/6小鼠,行腎IRI,術后DCA繼續干預2d。
6 樣本收集及檢測 每組6~8只小鼠,腎IRI后2d處死小鼠,抗凝全血400g,室溫,離心10min,取上層血清,全自動生化分析儀測定腎功血肌酐(Scr)、尿素氮(BUN)。1/3腎組織40g/L多聚甲醛固定后石蠟包埋。4μm切片用于 HE染色和凋亡細胞(Tunel染色)、增殖細胞核抗原(PCNA)的免疫熒光染色及嗜中性粒細胞(Ly6B)的免疫組化染色。其余腎組織膠原酶Ⅳ消化后,淋巴細胞分離液分離單個核細胞,流式細胞儀檢測Treg、M2型巨噬細胞表達。
7 病理觀察及判定 每只小鼠4張切片,每張切片隨機于400×視野下選擇10個非重復視野。HE染色結果的病理學評分:根據皮髓交界以及外髓質部位的損傷腎小管細胞壞死、小管腔膨脹、微絨毛脫落及管型形成等病理改變的比例進行小管損傷程度評分:0分,未見;1分,<10%;2分,10%~25%;3分,25%~50%;4分,50%~75%;5分,75%~100%。免疫熒光染色:計數每個400×視野下陽性的細胞數。
8 統計學方法 選用 Graph Pad Prism 6統計學軟件分析,數據以均數±標準差(±s)表示。多個樣本均數比較采用方差分析,三個樣本間兩兩比較采用Newman-keuls法(q檢驗),多個樣本間兩兩比較涉及重復測量時用Bonferroni校正。P<0.05認為差異具有統計學意義。
結 果
1 低劑量的DCA體外抑制HK-2細胞凋亡 不同劑量DCA干預體外培養的人腎小管上皮細胞系HK-2細胞,發現隨著劑量增加HK-2細胞增殖明顯受到抑制,其凋亡也逐步增加(P<0.05或0.01)(圖1A、B、C)。低劑量的DCA對 A/R(模擬體內IRI過程)誘導的HK-2細胞凋亡具有明顯的抑制作用(F=338.30,P<0.01)(圖1D、E)。見表1、2。
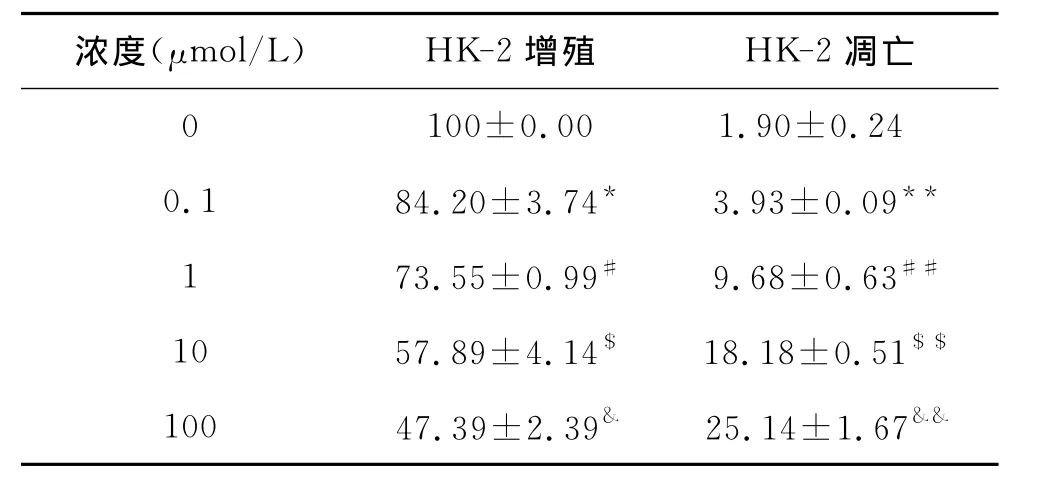
表1 不同濃度DCA對HK-2細胞增殖及凋亡影響
2 DCA減輕腎IRI 與假手術組比較(sham組),模型組(IRI組)SCr、BUN 明顯升高(P<0.01);而DCA干預組腎功較IRI組明顯下降(P<0.01)(圖2A、B)。病理學檢查亦提示DCA的腎臟保護作用,IRI導致嚴重的腎小管上皮細胞的凋亡、壞死、擴張及刷狀緣脫落,但DCA組上皮細胞損傷程度輕于IRI組(P<0.05)(圖2C、D)。見表3。

表2 DCA對缺氧-復氧(A/R)誘導的HK-2細胞凋亡影響

表3 各組腎功能及腎小管損傷評分
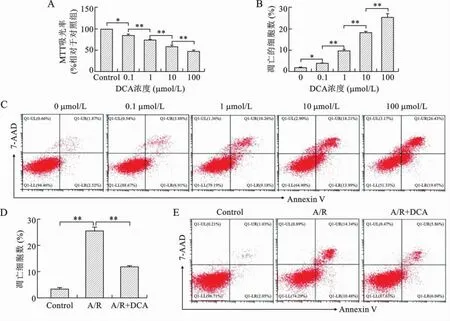
圖1 DCA對HK-2細胞增殖及凋亡的影響

圖2 DCA改善腎IRI小鼠腎功及病理損傷
3 DCA減低腎IRI小鼠腎小管上皮細胞凋亡體內研究結果發現,與IRI組比較,DCA同樣減低了腎小管上皮細胞凋亡(P<0.01)(圖3A、B)。應用PCNA為標記反映腎小管細胞的增殖狀態,發現與IRI組比較,DCA并未促進腎小管上皮細胞增殖(P=0.15)(圖3C、D)。見表4。
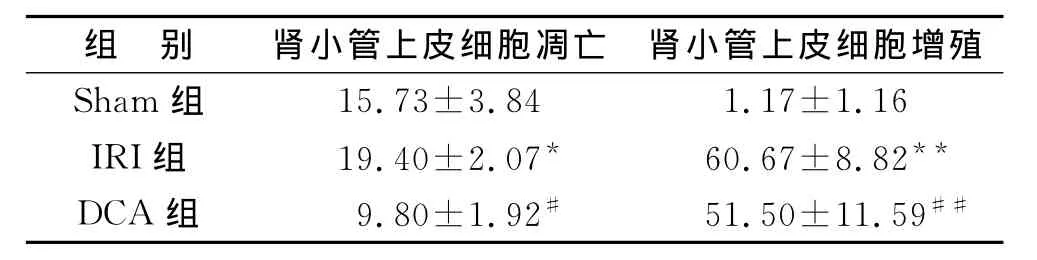
表4 各組腎小管上皮細胞凋亡及增殖情況
4 DCA減低腎IRI小鼠腎組織嗜中性粒細胞浸潤,增加Treg、M2型巨噬細胞表達 各組腎組織嗜中性粒細胞染色提示,DCA減低IRI腎組織嗜中性粒細胞浸潤(P<0.05或0.01)(圖4A、B)。同時發現,腎IRI環境下,DCA可以促進腎組織Treg擴增及M2型巨噬細胞表達(P<0.01)(圖4C、D、E、F)。見表5。

表5 各組腎組織中嗜性粒細胞、Treg及M2型巨噬細胞表達
討 論
DNA甲基化是基因表達的重要調控機制,與IgA腎病、慢性腎臟病的纖維化進展、糖尿病腎病等密切相關。有研究報道,腎IRI過程中亦有DNA甲基化參與[14-15]。地西他濱(Decitabine,DCA)為 DNA 甲基轉移酶抑制劑,使高甲基化的抑癌基因恢復正常的去甲基狀態,從而重新激活這些抑癌基因,發揮抑癌功能,恢復細胞的正常分化。DCA除臨床上用于腫瘤治療外,基礎研究提示DNA甲基化轉移酶抑制劑能影響炎癥反應過 程[5-7,10-12,16]。而 細胞凋亡、再生及炎癥反應是腎IRI的重要特征。因此,DCA可能對腎IRI過程存在影響,但未見文獻報道。本研究把抗腫瘤藥物DCA應用于腎IRI過程,旨在探索其對腎IRI的影響,為開辟新的治療策略提供依據。
DCA摻入DNA,抑制DNA甲基轉移酶,引起DNA低甲基化和細胞分化或凋亡來發揮抗腫瘤作用。我們實驗中,DCA針對腎小管上皮細胞的體外研究提示隨著劑量的增加腎小管上皮細胞的增殖明顯受到抑制,且隨劑量增加其誘導腎小管上皮細胞凋亡作用也逐步增加。但是,能導致腎小管上皮細胞HK-2凋亡的DCA對缺氧-復氧誘導的HK-2細胞凋亡反而起到保護作用。這提示DCA可能對腎IRI存在保護作用。
DCA具有骨髓抑制(導致中性粒細胞、血小板減低)及致房顫,咳嗽、腹瀉、便秘等副作用[9]。我們實驗過程中,所有小鼠均未發現明顯的腹瀉、便秘、出血等副作用,結合臨床上低劑量DCA應用劑量為10~30mg/m2、正常劑量為40~50mg/m2及相關文獻在小鼠上的應用[8,10],我們給腎IRI小鼠腹腔注射劑量為0.5mg/kg,屬于低劑量應用。在低劑量DCA干預腎IRI小鼠模型的研究中,我們觀察到小鼠腎功較模型組明顯改善,同時組織學檢查也發現低劑量的DCA減低了IRI小鼠腎小管上皮細胞的刷狀緣脫落、凋亡、壞死,結合體外研究結果,進一步確定DCA對腎IRI具有保護作用。
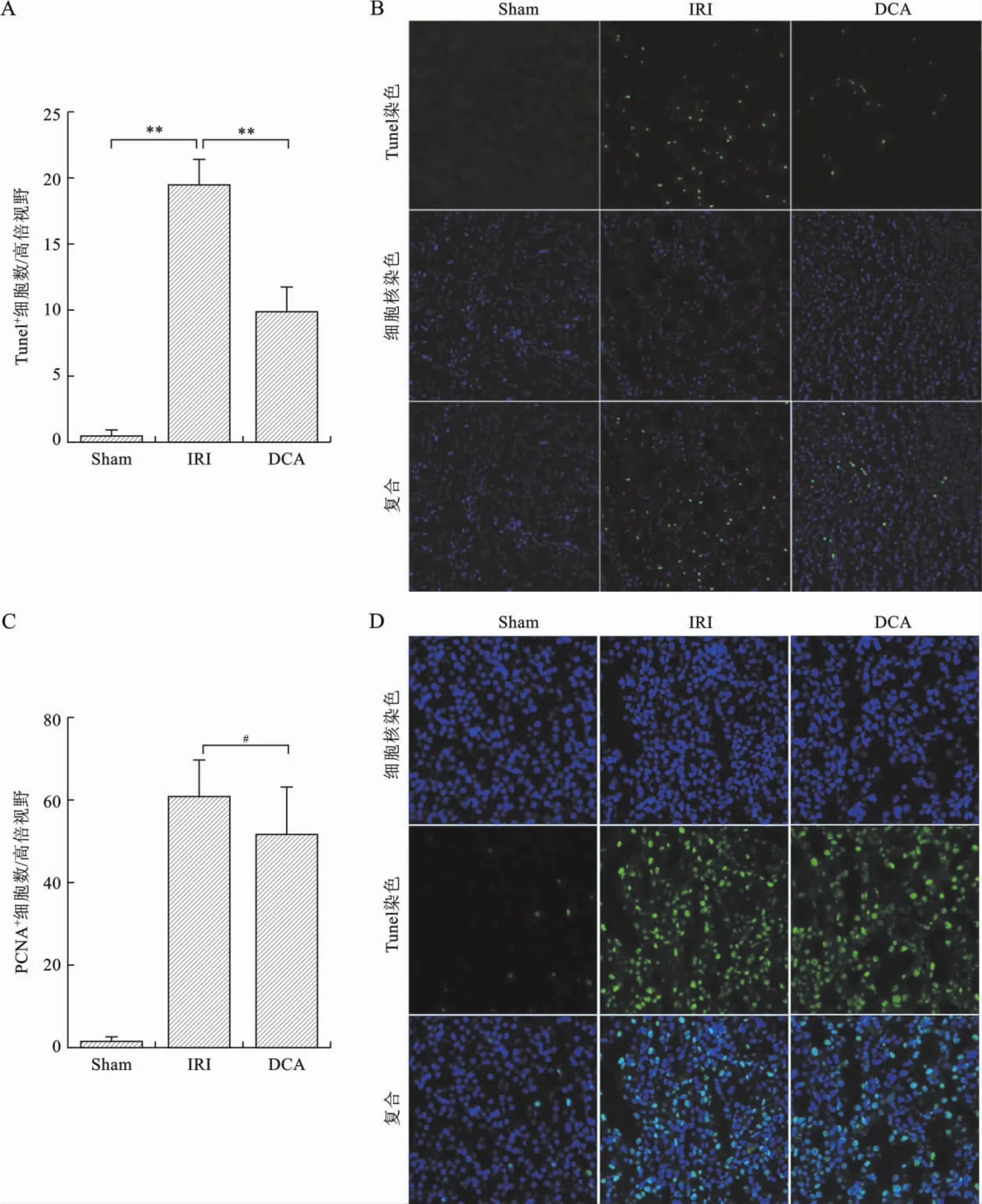
圖3 DCA減低腎IRI小鼠腎小管細胞凋亡

圖4 DCA減低腎IRI小鼠腎組織嗜中性粒細胞浸潤,增加Treg、M2型巨噬細胞表達
腎臟IRI因為氧化應激、內質網功能障礙、鈣超載等導致組織、細胞代謝障礙、結構破壞、細胞凋亡、壞死等,而其恢復過程表現為細胞的增殖,組織損傷修復。因此,我們體內探討了DCA對腎小管上皮細胞的凋亡與增殖影響。細胞凋亡、壞死,染色體DNA斷裂,產生3’-OH末端,應用Tunel標記3’-OH端,標示細胞凋亡、壞死,觀察到低劑量DCA干預的IRI模型的腎小管上皮細胞凋亡明顯減少(與體外研究一致)。但對細胞增殖未發現統計學差異,可能與IRI后2d的檢測評估時間距發病時間較短有關,也可能由于DCA的保護作用,DCA組本來凋亡的細胞少有關。而DCA減低腎小管上皮細胞凋亡的機制是什么呢?既可能與DCA通過調整基因甲基化、調整了小管細胞中某種基因、蛋白表達有關,也可能有其他機制,如控制炎癥反應。已有文獻報道,小管細胞表達的KLF4與DNA甲基化明顯相關[17-18],Klotho的甲基化也與腎IRI明顯相關[19-20],DCA可能通過調整上述基因表達,而達到保護腎IRI作用。本研究更關注炎癥反應狀態。免疫炎癥反應既是腎IRI后的重要臨床表現,也是導致腎組織損傷的重要原因。天然免疫反應與適應性免疫反應相互影響,促進免疫炎癥反應不斷增強,最終導致組織損傷進一步加重,因此抑制炎細胞聚集及細胞因子釋放可以減輕腎IRI損傷。本研究除觀察到小管細胞的變化外,也發現DCA組整體炎細胞浸潤較IRI組明顯減少,接下來的嗜中性粒細胞染色同樣觀察到DCA減低了腎組織嗜中性粒細胞浸潤。表明DCA可以減低腎組織炎性反應。
多篇文獻報道DCA可以促進Treg表達而抑制炎癥反應[5,16,21]。我們研究證明了在IRI條件 下,DCA確實抑制了腎組織炎癥細胞表達,同時也促進了腎組織Treg表達。所以我們推測DCA可能通過促進Treg表達而抑制炎癥反應,減低小管細胞凋亡,保護腎功能。巨噬細胞在IRI發病及組織修復過程中也發揮重要作用[22-23]。如M1型巨噬細胞加重腎臟損傷,清除M1型巨噬細胞或抑制M1型巨噬細胞可以保護腎IRI[24];而M2型巨噬細胞可通過抑制細胞凋亡、促進細胞增殖發揮保護腎IRI作用[25],也可通過調整免疫炎癥反應保護腎臟IRI。有文獻報道DCA也可能促進巨噬細胞向M2型轉移,因此,我們實驗中同樣檢測了腎IRI后2d腎組織M2型巨噬細胞表達情況,發現DCA同樣促進了IRI后腎組織巨噬細胞的表型轉移,這也可能與DCA的腎臟保護作用相關。
綜上所述,DCA對腎臟IRI確實存在保護作用,其機制可能與抑制腎小管上皮細胞凋亡、抑制炎癥反應有關。雖然我們研究沒有對DCA對腎IRI的遠期療效做進一步評價,DCA對腎IRI的保護機制探索也只停留在抑制細胞凋亡、抑制綜合免疫炎癥反應方面,沒有做進一步深入研究。但是我們證明了其對腎IRI損傷的保護作用,可能成為干預腎IRI的新方法,接下來我們將對其遠期效果、機制及用藥劑量、持續時間方面進行深入探索。

