肺移植后閉塞性細支氣管炎中運用微小RNA的價值
吳維棟 黃 麟 吳煒焊 朱 勇
福建醫科大學附屬協和醫院胸外科,福建福州 350001
真核生物的細胞漿粗面內質網周圍存在的長約20~25kb的一類內源性的非編碼RNA,我們稱之為微RNA(microRNA,miRNA),并且微RNA對其生物具有一定的調節控制作用,基本上有較多的miRNA基因都存在于基因組的基因間隔區、外顯子區或者基因的內含子之間。經過成熟的單鏈miRNA分子和靶mRNA序列相互組合,對mRNA進行調節。并且以后發展過程中針對OB得的研究方法,主要是從基因組學入手,下面我們將會起到更多作用的TRPC1蛋白和指定的miRNA相互結合,進行分析研究,得出一定結論。
1 資料與方法
1.1 實驗材料
購買華中科技大學動物中心的清潔級SD大鼠24只,圴為雄性,重量250~350g,隨機分為模型組、對照組。SPF級近交系Brown Norway(BN)大鼠6只和Lewis大鼠18只,供體為BN大鼠,受體為Lewis大鼠;對照組中的供體和受體都采用的是Lewis大鼠。
1.2 方法
分別選用SPF級近交系Brown Norway(BN)大鼠6只和Lewis大鼠18只建立肺移植動物模型。模型建立分為兩組,模型組的供體為BN大鼠,受體為Lewis大鼠,而對照組中供體和受體都使用的是Lewis大鼠,首先將作為供體的BN大鼠腹腔部位用10%水合氯醛(青島宇龍海藻有限公司,H37022673)4mL/kg進行麻醉,頸胸部位經過消毒后,中間部位劃出小口看到氣管,再將整段氣管取出來,并去掉氣管外的隔膜組織,修整好氣管兩段,供體則使用5環1段,用4℃生理鹽水沖洗干凈之后浸泡留用[2]。然后對作為受體的Lewis大鼠使用同樣方法讓氣管暴露在外,在不傷害喉部神經的情況下,以環狀軟骨下第4、5環間為中心上下對兩環氣管分開,完全分離后對氣管取出,在第4、5環之間劃開氣管,膜部保留1/5的完整。對氣管內存在的分泌物經過清理后植入供體氣管。植入過程中注意尾側重合,膜部對膜部,軟骨部對軟骨部,用7-0尼龍線在正上方先縫合一針固定,之后在左右兩側中間再進行一針縫合,最后一針則對正下方位置進行縫合,要先將膜部縫合好之后才能對頭側進行合成,最后一針在中間上方進行縫合從而完成氣管移植。手術2個月后OB模型建組建成功[3]。
通過在模型組和對照組各取6例大鼠,篩選出大鼠移植氣管組織在miRNA方面的的差異,具體方法為:對手術將個月后組建模型成功的大鼠進行研究,將移植的氣管完整取出,并分為相同的三段,一段用于進行病理學試驗,提取另一段提取完整RNA,最后放置一段用于之后的研究討論,最后通過送往上海具有先進技術的基因化學技術單位對miRNA基因芯片進行檢測,對兩組大鼠miRNA表達差異進行對比。通過RT-qPCR方法對miRNA進行驗證。
1.3 觀察指標
(1)檢測移植氣管組織病理反應。(2)討論miRNA芯片的治療成效。(3)使用RT-qPCR驗證芯片得到結果。
1.4 統計學方法
應用SPSS22.0統計學軟件對數據進行處理和分析,計量資料以(±s)表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 移植氣管組織病理學檢測成果
對1個月后因閉塞性細支氣管炎組建成功的移植氣管,和同時間內對照組移植的大鼠氣管進行實驗對比,發現兩組大鼠氣管傷口均恢復較好,氣管周圍頸部肌肉也逐漸長出,軟骨特征明顯,未出現其他問題,另外移植的氣管病理狀況經過蘇木精-伊紅染色檢查,模型組的移植氣管恢復情況較好,未出現明顯的病變反應,或僅僅是出現輕微的炎癥;而因模型組閉塞性細支氣管炎的移植氣管,其氣管壁出現不同程度病理反應,主要是內部上皮發生異常或者出現黏膜腺體消失的狀況。見圖1。
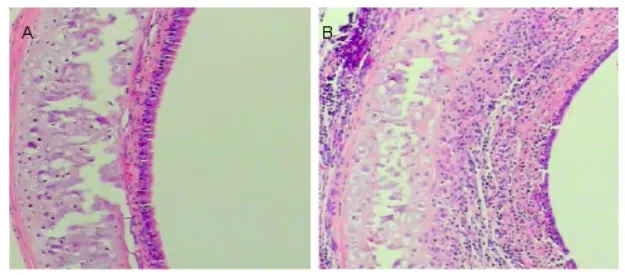
圖1 大鼠移植氣管的病理變化圖
2.2 miRNA芯片研究檢測結論
通過使用600個miRNA芯片對模型組的移植氣管和對照組miRNA表達差異進行分析研究,經過對比分析檢測結果發現差異表達miRNA較為顯著的有70個,模型組的移植氣管和對照組差異表達值控制在0.6~2.1的有40個,總差異表達miRNA的占比為57.15%,其檢測結果無明顯差異。差異表達miRNA明顯的有30個,總差異表達miRNA的占比為42.85%,中間有16個差異表達明顯下調,差異表達明顯miRNA的占比為53.33%;表達明顯上調的有14個,差異表達明顯miRNA的占比為46.67%。
2.3 芯片采用RT-qPCR驗證得出結論
對同等數量的表達明顯上升的miR-146a、miR-155和表達明顯降低的miR-451,以miRNA微陣列芯片檢驗的最終結論為基礎進行檢測,從而使得RT-qPCR驗證得出的結果更為精確,經過分析研究發現模型組miR-146a和miR-155基因與對照組的表達量結果無明顯區別;模型組miR-451基因表達量明顯高于對照組,其對比結果有明顯差異,對之后研究的準確性提供了理論依據。
利用預測miRNA靶基因常用的TargetScan數據庫預測兩組差異表達顯著的miRNA靶基因。作為本研究模型組miRNA靶基因的代表,其中miR-146a靶基因是IRAK1和TRAF6,前者與白細胞介素1引起的核因子KB上調有關,后者參與炎癥細胞反應;miR-155靶基因為TSHZ3,其參與轉錄調控;而miR-451的靶基因則是Tollip,與炎癥調節有關。
3 討論
經研究發現,經過肺移植后出現死亡主要是因為出現閉塞性細支氣管炎(obliterative bronchiolitis,OB),發生的原因是因為小氣道周圍炎性淋巴細胞浸潤,造成出現的纖維增生和瘢痕阻塞細支氣管,導致肺功能出現病變。大約有一半的OB都是出現在肺移植五年后,10年出現OB的概率高達80%。嚴重的發生OB五年后死亡率高達60%。所以要保證肺移植遠期的治療效果更穩定,需要有效的控制患者出現OB。目前研究表明OB主要通過纖維化、淋巴細胞及抗體介導途徑等機制致病,至OB的終末階段,呼吸道上皮的損傷使炎癥細胞浸潤、上皮細胞脫落、基底祖細胞銳減,其中可能發生小氣道上皮-間質轉化(epithelial tomesenchymal transition,EMT),使纖維母細胞過度累積和纖維增生[6]。以單一的全方位存在細胞膜上的陽離子通道作為經典瞬時受體電位通道(transient receptor potential channel,TRPC),哺乳動物TRPC又被分為TRPC1~7七個亞型參與各種細胞的鈣離子內流,調節Ca2+濃度從而影響細胞的功能[7]。哺乳動物TRP通道一開始指的就是TRPC1,我們認為其作用主要是將細胞膜受體激活磷脂酶C(phospholipase C,PLC)中的鈣離子進入,參與鈣依賴的平滑肌及腺體的分泌和收縮功能[8]。微RNA(microRNA,miRNA)是在真核生物中發現的一類內源性的具有調控功能的非編碼RNA,其長約20~25kb,主要存在于細胞漿粗面內質網附近[9]。基因組的基因間隔區或者基因的內含子中含有大量的miRNA基因。通過將完整的的單鏈miRNA分子與靶mRNA序列互補配對,調節mRNA的翻譯。
有部分學者認為主要是因為免疫系統出現排斥反應,才造成出現肺移植閉塞性細支氣管炎[10],還有就是其他非免疫因素也會出現這種情況,為降低肺移植排斥問題一直著重于分析研究怎樣做好適應性免疫,根據眾多的實驗檢測證明,出現閉塞性細支氣管炎的主要原因是體液免疫、自體免疫、固有免疫等這些方面出現問題,并且出現免疫排斥反應的主要位置是氣道上皮(airwaye Pithehalcen,AEC),miRNA對眾多的重要生命過程都有著很大影響[11]。經過檢測證明,miRN作為免疫調控因子,包括了對固有性免疫應答與炎性反應進行調節控制,較為明顯的是,要想做好免疫細胞信號轉導的調節,離不開miRNA的重要調節控制[12]。要進一步認識了解移植后閉塞性細支氣管炎發病原因,需要通過分析檢查出miRNA的差異性表達和功能機制。當下我們使用最頻繁的篩查miRNA差異表達的方法是miRNA全基因譜芯片法,這種方法在使用過程中存在一定的局限性,因此需要進一步利用RT-qPCR等方法進行檢測,進而保證結果的準確性[13]。
現在在關于miRNA的作用和質量方面僅僅是發現了一小部分,還有更大的空間供我們去研究探索,不斷的發現miRNA可以讓我們更好對不同的生理病理機制進行分析,同時可以采用新的治療方法和理論依據對疾病進行診治。經過研究證明,miRNA表達經過精準控制可以調節出一種節能而又有效的調節通路。在不斷的發現miRNA作用的過程中,分析出轉錄因子和剪接因子這兩種基因表達的重要調節因子與miRNA之間可以進行直接或間接的相互調節控制。現在是主要在miRNA功能中發現探索并分析確定miRNA直接作用的靶基因同時了解其調控機制。miRNA在轉錄后是以水平調節基因的小分子RNA形式表達出來的,通過轉錄因子相結合,將共同作用的靶基因在出現免疫和炎癥反應下進行調節,在免疫系統中有著重要的作用。經研究證實,通過使用miR-451對癌基因C-myc及細胞周期正向調節因子的表達水平,可以阻止細胞周期的發展,也避免細胞過快的增加繁殖。
經過全面分析討論,微小RNA可以更好的調節控制在肺移植后出現閉塞性細支氣管炎的病情發展狀況。

