小檗堿聯合人參皂苷Rb1對脂肪細胞炎癥信號通路作用*
蔡之幸,陳 越
上海交通大學醫學院附屬同仁醫院中醫科(上海200336)
慢性低度炎癥狀態是代謝綜合征(Metabolic syndrome,MS)存在的重要發病機制之一[1]。在肥胖的代謝綜合征患者血清中,多種脂肪細胞炎癥因子和血清炎癥標志物如IL-6、TNF 等呈現明顯地高表達狀態。脂肪組織作為一個內分泌器官[2]已經成為學術界的共識。對抗脂肪組織的慢性炎性狀態,有利于對胰島素抵抗的調控,最終將預防代謝綜合征患者的心腦血管等重要靶器官損傷事件的發生發展。
傳統中藥飲片中,具有清熱燥濕作用的黃連和具有益氣作用的人參是中醫臨床治療2型糖尿病的常用藥對。已有多方研究發現[3-4]黃連的主要有效成分小檗堿具有降低3T3-L1脂肪細胞TNF-α、IL-6等表達的作用,而人參的主要有效成分,人參皂苷[5]可通過多種分子機制發揮調節糖、脂代謝的作用。目前,該藥對合用,對MS患者的干預,在分子生物學層面,是否有確切的增效作用,鮮有報道,人參的主要有效化學成分人參皂苷Rb1和黃連的主要有效成分小檗堿合用對脂肪細胞信號通路的作用并不十分清楚。本研究,主要從細胞生物學層面,觀察兩種主要有效成分的合用對改善脂肪細胞的慢性炎性狀態下的胰島素抵抗是否有增效作用。
材料和方法
1 材 料
1.1 實驗藥物與試劑:人參皂苷Rb1(簡稱Rb1)、小檗堿(簡稱Ber)、地塞米松(DXMS)、3-異丁基-1-甲基-黃嘌呤(IBMX);重組人胰島素(常規型,優泌林R);牛血清白蛋白質(BSA);胎牛血清(FCS)、高糖培養基(DMEM);抗β-actin單克隆抗體,抗IKK-β單克隆抗體,抗IKK-α/IKK-β多克隆抗體,羊抗兔辣根過氧化物酶(HRP)連接的二抗;ECL 化學發光檢測試劑盒、BCA 蛋白質檢測試劑盒;3T3-L1前脂肪細胞株,購買于中國科學院上海細胞庫。
1.2 主要儀器:通用電泳儀(E-1101)、伯樂半干轉膜儀(125-0143)、BioPhotometer D30核酸蛋白質測定儀、高速離心機(E2720)。
2 實驗方法
2.1 細胞培養與誘導分化:將3T3-L1前脂肪細胞生長至70%融合度,消化細胞種植于6 孔板中,用前體細胞培養液(90%DMEM+10%FCS)繼續培養48 h。更換前體細胞培養液,繼續培養48 h至細胞完全融合。待細胞完全融合后,更換為分化培養液(90%DMEM+10%FCS+IBMX+1.0μg/ml INS),繼續培養48 h。48 h后,更換分化培養基為脂肪細胞維持培養基(90%DMEM+10%FCS+1.0μg/ml INS)。將細胞培養于脂肪細胞維持培養基中7-15 d,每2-3 d更換維持培養液1 次。誘導分化成熟3T3-L 脂肪細胞>70%呈脂肪細胞表型,可用于實驗(圖1)。
圖1 分化成熟的脂肪細胞
2.2 建立3T3-L1 脂肪細胞胰島素抵抗模型:3T3-L1前脂肪細胞經誘導分化成熟為3T3-L1 脂肪細胞后,置于0.2%BSA 的DMEM 無血清培養液中,分別加入10μmol/L 小 檗 堿、10μmol/L 人 參 皂 甙Rb1、10μmol/L小檗堿加人參皂甙Rb1干預24 h,吸棄上清液后,收集經藥物干預的各組脂肪細胞待用。
3T3-L1前脂肪細胞經誘導分化后,成為成熟的3T3-L1脂肪細胞,先置于0.2%BSA 的DMEM 無血清培養液,培養12 h后,換成含10μmol/L,TNF-α的0.2%BSA 的DMEM 無血清培養液,培養形成胰島素抵抗狀態,再培養12 h后,分別予10μmol/L 小檗堿、10μmol/L人參皂甙Rb1、10μmol/L 小檗堿+人參皂甙Rb1干預,12 h后,再次吸棄上清液,收集經藥物處理的各組胰島素抵抗模型脂肪細胞待用。
2.3 實時熒光定量法檢測mRNA 的表達量:使用Trizol法抽提RNA,逆轉錄提取總m RNA,實時熒光定量法測定TNF-α、IL-6 的表達量。引物(TNF-α上游引物:ACGGCATCCATCTCAAAGAC 下游引物:CGGCAGAGAGGAGGTTGACT;IL-6 上 游 引物:AGTTGCCTTCTTTGGGACTGA 下 游 引 物:CAGAATTGCCATTGCACAAC),PCR 經DNA 變性、退火、延伸三步法后,測定其熒光信號表達,擴增至40個循環;根據熔解度曲線分析擴增后的特異性表達情況,持續檢測其信號強度。
2.4 蛋白免疫印跡法(Western-blotting)檢測IKK-β表達:于上述各組備用的脂肪細胞中,加入細胞裂解液,充分裂解各組脂肪細胞。于4℃下,離心機設置13000轉/min,離心30 min 后,提取蛋白質,運用BCA 法,測定蛋白質濃度。在蛋白質樣品中,加入上樣緩沖液,經95℃蛋白變性5 min,分離轉膜,室溫下封閉2 h,使用一抗,4℃度環境下,孵育過夜,使用二抗室溫環境下,蛋白質雜交2 h,經曝光、顯影后,采用蛋白免疫印跡(Western-blotting)法檢測IKK-β表達。
3 統計學方法 采用SPSS 15.0統計學軟件,進行統計學分析。所有計數資料用均數±標準差(ˉx±s)表示,符合方差齊性檢驗者,應用單因素方差分析進行各組組間比較,若差異顯著者,應用LSD 法進行兩兩比較;不符合方差齊性檢驗者,若差異顯著,則應用Tamhane's T2法進行兩兩比較。當P<0.05時,認為兩組之間差異存在統計學意義。
結 果
1 Ber、Rb1及Rb1+Ber干預對基礎狀態下的脂肪細胞炎癥因子的作用 與空白對照組相比,Ber組脂肪細胞的TNF-α和IL-6的mRNA 表達量降低更明顯(P<0.01),Rb1組脂肪細胞的TNF-α和IL-6的mRNA表達量無明顯變化,Rb1+Ber聯合組的TNF-α和IL-6的mRNA 表達量亦無顯著變化。見表1。
2 Ber+Rb1干預對胰島素抵抗狀態下的(TNFα刺激)脂肪細胞炎癥因子的作用 與空白對照組比較,Ber組能顯著地抑制TNF-α刺激下上調的TNFα、IL-6的表達(P<0.01),而Rb1僅抑制TNF-α的表達(P<0.01),Ber+Rb1兩藥合用,與Rb1單用作用類似,僅抑制了TNF-α的表達(P<0.01)。見表2。
表1 Ber、Rb1及Rb1+Ber基礎狀態下脂肪細胞炎癥因子表達比較
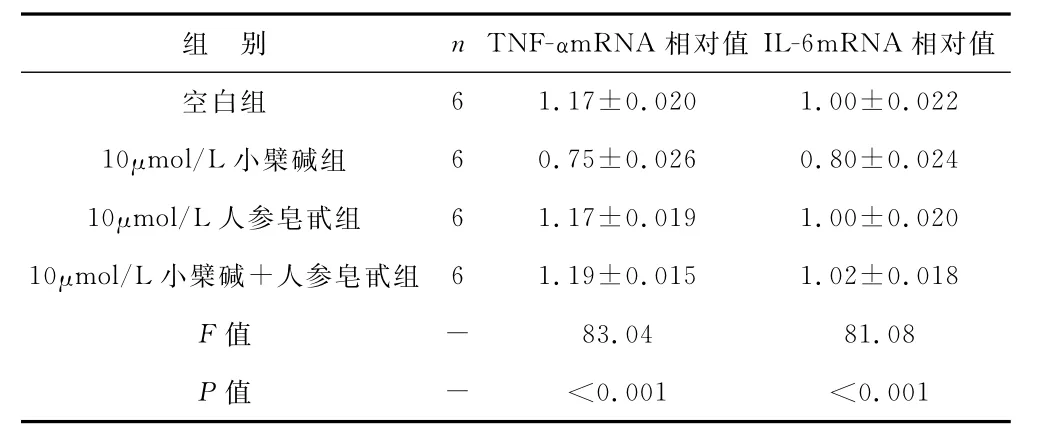
表1 Ber、Rb1及Rb1+Ber基礎狀態下脂肪細胞炎癥因子表達比較
組 別 n TNF-αm RNA 相對值IL-6m RNA相對值空白組6 1.17±0.020 1.00±0.022 10μmol/L小檗堿組 6 0.75±0.026 0.80±0.024 10μmol/L人參皂甙組 6 1.17±0.019 1.00±0.020 10μmol/L小檗堿+人參皂甙組 6 1.19±0.015 1.02±0.018 F 值 - 83.04 81.08 P 值 - <0.001 <0.001
表2 Ber、Rb1及Rb1+Ber在TNF-α刺激下脂肪細胞炎癥因子表達比較
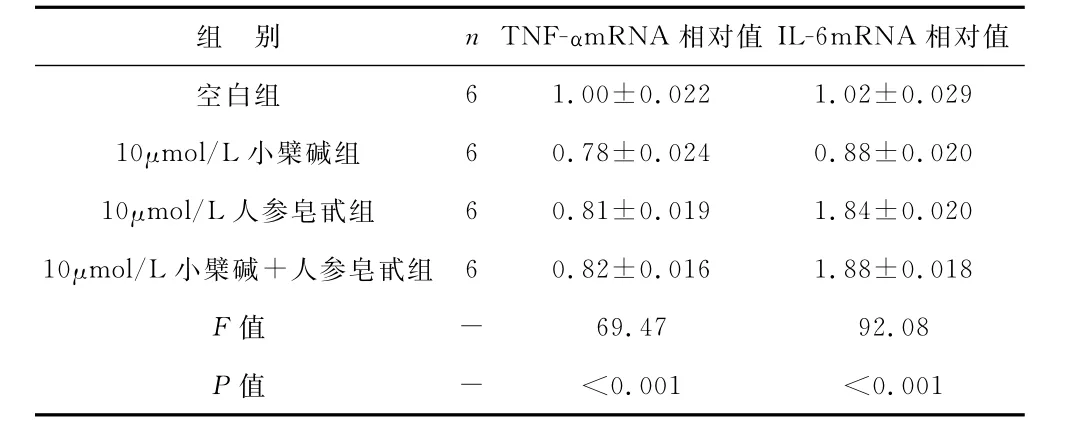
表2 Ber、Rb1及Rb1+Ber在TNF-α刺激下脂肪細胞炎癥因子表達比較
組 別 n TNF-αmRNA 相對值IL-6mRNA相對值空白組6 1.00±0.022 1.02±0.029 10μmol/L小檗堿組 6 0.78±0.024 0.88±0.020 10μmol/L人參皂甙組 6 0.81±0.019 1.84±0.020 10μmol/L小檗堿+人參皂甙組 6 0.82±0.016 1.88±0.018 F 值 - 69.47 92.08 P 值 - <0.001 <0.001
3 Ber、Rb1及Rb1+Ber對脂肪細胞主要炎癥信號通路的影響 經TNF-α誘導后,加入Ber處理24 h的脂肪細胞,NF-κB 和IKK-β 表達水平下調,而RB1處 理 的 脂 肪 細 胞(無 論 是 否+Ber),NF-κB 和IKK-β表達水平上調。加入TNF-α誘導24 h 后,無論Ber、Rb1處理組或Ber+Rb1聯合處理組,其磷酸化的IKK-β表達水平都呈上調趨勢(圖2)。
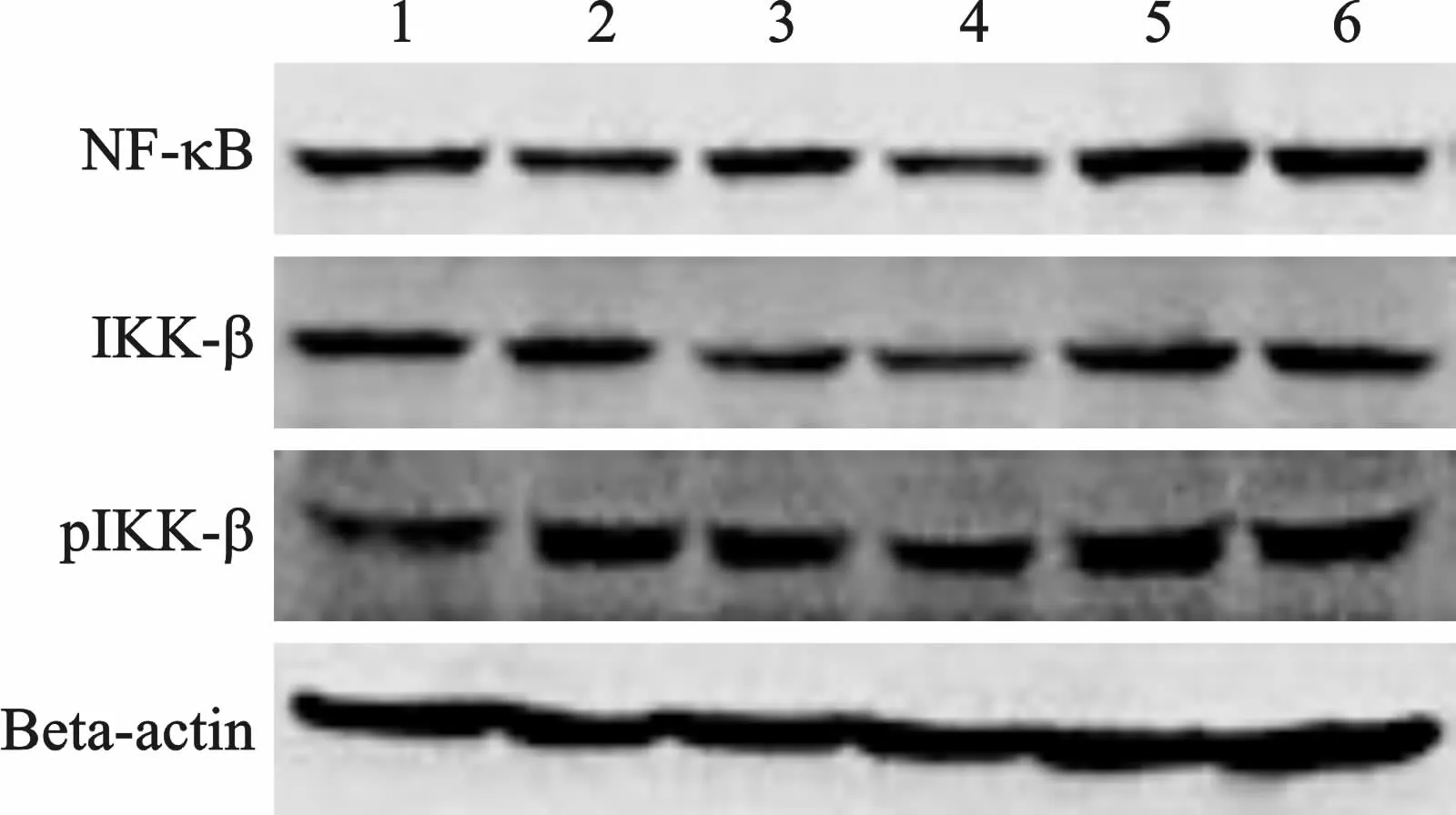
圖2 小檗堿和人參皂苷Rb1合用對脂肪細胞主要炎癥信號通路的影響
討 論
代謝綜合征(Metabolic syndromes,MS)是一類以中心性肥胖為核心,聚集了糖耐量異常、高血壓、高血脂、高尿酸等多種心腦血管疾患危險因素的復雜代謝紊亂癥候群[6]。胰島素抵抗[7],是MS公認的核心。目前認為,脂肪細胞的堆積[8]使得脂肪組織中的單核細胞趨化蛋白1(MCP-1)及單核細胞轉移抑制因子(MIF)被釋放,導致脂肪組織直接被巨噬細胞浸潤,在局部脂肪組織產生了大量的活性氧物質[9],減少了抗氧化物質的產生。局部脂肪組織的氧化應激反應被激活,核轉錄因子κB(NF-κB)被激活,諸多脂肪因子,如腫瘤壞死因子(TNF-α)、白介素-6(IL-6)、瘦素、脂聯素的分泌異常,這些脂肪因子同時也是炎性因子,長期慢性釋 放 入 血[10-11],TNF-α 可 通 過 激 活 核 因 子-κB(NF-κB)抑制因子激酶(IKK),使κB 抑制因子(IKB)磷酸化而激活NF-κB,而NF-κB 又可促進TNF-α轉錄,從而形成低度炎癥信號的正反饋環,導致或加重胰島素抵抗。在長期慢性低度炎性反應刺激下,最終能導致MS的產生。
盡管MS 的診斷標準早已提出,MS 的心腦血管危害性也一再受到重視,現代醫學對代謝綜合征的治療,近20年仍停留在針對某一癥候的各組治療,如單純控制體重、控制血糖、控制血壓、調脂固斑等,因代謝綜合征患者存在心腦血管事件的高危風險,許多患者不得不選擇上述藥物的疊加給藥,且終身給藥。基于“整體觀念”的中醫藥,在“代謝綜合征”的管理上,具有獨到優勢。中醫認為,黃連,苦寒之品,歸心肝胃經,既能清熱燥濕,又善清心胃之火。人參,性甘,微溫,有大補元氣,補脾益肺的功效,助運化,輸精微,使氣旺津生,以達到生津止渴的目的,能夠針對MS患者肺脾之虛,補肺平喘又健脾調中,鼓舞脾氣。黃連、人參相須為用,此藥對主導的清熱益氣法對代謝綜合征積極作用被許多學者認可[12]。
本實驗中,我們利用現代細胞生物學技術,再次驗證了Ber對脂肪細胞主要的炎性通路NF-κB 的下調作用。在臨床實踐中取得良好降糖療效的人參,其主要成分人參皂苷Rb1,卻能明顯上調TNF-α誘導的脂肪細胞炎性通路NF-κB和IKK-β的表達水平,并且其磷酸化的IKK-β表達水平都呈上調趨勢。當Ber聯合Rb1時,這種上調趨勢仍然沒有改變。這與臨床實踐中觀察到的黃連、人參藥對有降低胰島素抵抗的作用不符[13-14]。可見,人參的主要有效成分Rb1,并非從脂肪細胞炎性通路NF-κB的調節角度,實現其改善胰島素抵抗的作用。最新研究發現,人參皂甙Rb1主要作用于PI3K/Akt信號通路,促進GLUT1、GLUT4蛋白表達和Akt磷酸化實現其胰島素抵抗作用[15-16],同時,人參皂苷Rb1及代謝物還可通過降低IRS1絲氨酸磷酸化、增加PI3K 活性、促使Akt活化來提高葡萄糖攝取;同時抑制炎性反應,達到改善IR 的目的。
NF-κB是機體的主要炎性通路之一。本研究未顯示出人參皂甙Rb1對NF-κB通路的下調作用,恰恰相反,我們觀察到人參皂甙Rb1有上調脂肪細胞炎性通路NF-κB 和IKK-β 的表達水平及上調磷酸化的IKK-β表達水平的趨勢,這能否否認人參皂甙Rb1的降糖作用?能否可因人參皂甙Rb1無論是否聯合小檗堿均有上調脂肪細胞炎性通路NF-κB 和IKK-β的表達水平及上調磷酸化的IKK-β表達水平的趨勢,認為相互疊加的中藥有效成分,有助增長脂肪細胞炎性反應,增加胰島素抵抗的風險。
結合前述人參皂甙Rb1 在PI3K/Akt胰島素信號傳導上的研究[15-16],我們認為中藥的有效成分對脂肪細胞炎性反應及胰島素抵抗的調控是多方面的;本研究中人參皂甙Rb1的胰島素抵抗作用并不是通過對脂肪細胞NF-κB 通路的“抗炎”這條途徑完成的。由此我們想到:中藥的有效成分對單一信號通路的調節作用與臨床所見的療效可能不盡相同。同一中藥的有效成分,可以作用于多條信號通路,發揮不同的調節作用[17]。中藥有效成分對信號通路的影響,并非“1對1”的線性關系,也非“1+1”的增效關系,而是復雜的、相互作用的“非線性”關系。或許用“非線性”[18]方式來研究藥物作用于靶標及信號通路中的困惑,可能為中藥有效成分對疾病的積極作用研究提供途徑。

