揉面過程中面團面筋蛋白結構的變化
孟 蓮 周惠明,2 朱科學 郭曉娜
(1. 江南大學食品學院,江蘇 無錫 214122;2. 江蘇省現代糧食流通與安全協同創新中心,江蘇 南京 210000)
揉面是手搟面制作工藝中至關重要的環節之一,也是手搟面口感爽滑筋道,深受人們喜愛的原因之一。目前,國內外對面條工藝的研究主要集中于和面、熟化。楊玉玲等[1]研究了和面方式對面團流變學特性及面條品質的影響;Don等[2]發現面團中麥谷蛋白大聚體含量隨熟化時間的延長而升高;陳潔等[3]研究了熟化溫度,以期通過調整醒面溫度獲得不同用途的面團。而關于傳統工藝中揉面這一環節的研究很少。Scepanovic等[4]通過Tanner多模損傷模型,模擬理想揉面機幾何形狀,數值化研究了面團揉捏過程的微觀結構損傷及流動行為。該研究是從力學角度探索理想化的揉面條件,未涉及揉捏對面團這一黏彈體系產生的作用和貢獻。邵麗芳等[5]研究發現,揉面可使冷凍熟面質構品質顯著提升,手工揉面比機器揉面效果更為顯著。但仍缺乏關于面團揉捏過程中面筋蛋白結構變化和交聯機制的研究。
面筋形成過程主要是蛋白質分子通過氫鍵發生水合作用,蛋白質分子自身通過二硫鍵發生聚集[6]。由于水合作用,面筋蛋白產生一定的內聚性和黏附性[7]。通過SH-SS交換或在分子水平上發生非共價相互作用(氫鍵或疏水),誘導大分子聚集,并改變面筋的二級結構,使面團的物理和流變特性發生變化[8]。麥醇溶蛋白使面團具有黏性和延展性,而麥谷蛋白通過聚合物網絡的形成在面團的彈性中起關鍵作用,故面團的麥醇溶蛋白與麥谷蛋白的比例(Gli/Glu)影響面團的形成[9]。此外,二硫鍵或疏水性相互作用可能會加速麥谷蛋白的聚集[10-11]。
試驗擬對手工揉面過程中面團面筋蛋白的結構變化規律及交聯作用進行深入研究,為面條的品質改良和傳統工藝發展提供理論依據。
1 材料與方法
1.1 原料與試劑
小麥粉:金龍魚麥芯粉,含水量14.43%,蛋白質含量9.95%,益海嘉里糧油有限公司;
十二烷基硫酸鈉、尿素、乙二胺四乙酸、三羥甲基氨基甲烷、甘氨酸、異丙醇等:分析純,國藥集團化學試劑有限公司;
二硫蘇糖醇、Ellman試劑、β-巰基乙醇:分析純,美國Sigma公司;
乙腈:色譜純,美國Sigma公司。
1.2 儀器與設備
和面機:JHMZ-200型,北京東孚久恒儀器技術有限公司;
生化培養箱:LRH-250型,上海一恒科學儀器有限公司;
物性分析儀:TA-XT plus型,英國SMS公司;
傅里葉變換紅外光譜儀:NEXUS型,美國尼高力儀器公司;
高效液相色譜儀:LC-20AT型,日本島津公司。
1.3 方法
1.3.1 面團的制備 稱取200 g小麥粉,96 g去離子水與2 g鹽于針式和面機中,混合5 min,分別揉面2,4,6,8,10,15 min后,放置于30 ℃,濕度80%的恒溫箱中靜置20 min,冷凍干燥,研磨成粉,過80目篩備用,每組試驗至少重復3次。
1.3.2 面團質構特性的測定
(1) 硬度和彈性:用A/DP裝置制備測試面團,采用P/1S型號探頭,測試前、中、后速度分別為2,1,5 mm/s,形變35%,接觸時間1 s,觸發力5 g。
(2) 黏性:用A/DSC裝置制備測試面團,采用P/25型號探頭,測試前、中、后速度分別為0.5,0.5,10.0 mm/s,應力40 g,接觸時間0.1 s,觸發力5 g。
1.3.3 面團中游離巰基與二硫鍵含量的測定 根據Beveridge等[12-13]的方法稍作修改。將冷凍面團(0.4 g)分散于10.0 mL 0.2 mol/L Tris-Gly緩沖液(pH 8.0,含8 mol/L尿素,3 mmol/L EDTA,1% SDS)中,攪拌提取1 h。懸浮液13 600 r/min離心10 min,收集上清液。測定游離巰基時,在4 mL上清液中加入0.1 mL 10 mmol/L DTNB,室溫反應20 min,412 nm處讀取吸光度。測定總巰基時,將0.1 mLβ-巰基乙醇和4 mL 0.2 mol/L Tris-Gly緩沖液加入1 mL上層清液,室溫下振蕩混合1 h,加入10 mL 12%的三氯乙酸,再振蕩混合1 h,5 000 r/min離心10 min,取上清,重復3次,收集最終沉淀物,于10 mL 0.2 mol/L Tris-Gly緩沖液中溶解,加入0.1 mL 10 mmol/L DTNB混合,測定吸光度。
標準曲線的制備:將L-半胱氨酸溶解在0.2 mol/L Tris-Gly緩沖液中,制備巰基標準溶液(0.00,0.02,0.03,0.04,0.05,0.06 μmol/mL)。將4 mLL-半胱氨酸溶液與0.1 mL 10 mmol/L DTNB溶液混合,測定溶液吸光度。建立巰基濃度與吸光度的關系標準曲線,按式(1)、(2)分別計算巰基、二硫鍵含量。
(1)
(2)
式中:
m——巰基含量,μmol/g;
C——冷凍面團濃度,g/mL;
S——巰基濃度,μmol/mL;
n——上層清液稀釋系數。
m2——二硫鍵含量,μmol/g;
m1——總巰基含量,μmol/g;
m3——游離巰基含量,μmol/g。
1.3.4 面團蛋白質分子間作用力的測定 參考Gómez-Guillén等[14]的方法并修改,取A、B、C 3組樣品各0.1 g,A樣品加入5 mL 0.6 mol/L NaCl(SA)溶液,B樣品加入5 mL 0.6 mol/L NaCl和1.5 mol/L尿素(SB)溶液,C樣品加入5 mL 0.6 mol/L NaCl和8 mol/L尿素(SC)溶液,混合均勻。4 ℃靜止1 h,3 000 r/min離心15 min,取上清液,采用考馬斯亮藍法測定上清液蛋白質含量。溶解在SB與SA溶液的蛋白含量差表示氫鍵;溶解在SC與SB溶液的蛋白質含量差表示疏水相互作用。
1.3.5 面團蛋白質二級結構的測定 參照Chompoorat等[15-16]的方法并加以修改,將樣品與KBr按比例(1∶50,質量比)混合,研磨均勻,使用配套壓片機制得透明薄片,進行全波長掃描(400~4 000 cm-1),掃描次數16,分辨率4 cm-1。利用Omnic和Peak Fit v4.12軟件分析數據,進行二階導數擬合,根據各結構對應的區間范圍計算其所占百分比含量。
1.3.6 面團蛋白質交聯程度的測定 參照Lagrain等[17]的方法并修改,準確稱取一定量的面團凍干樣品(含1.00 mg干基蛋白質),溶解于1.0 mL的樣品緩沖液(含有2.0% SDS的0.05 mol/L,pH 6.8磷酸鹽緩沖液)中,室溫振蕩30 min,8 000 r/min離心10 min,取上清液過0.45 μm濾膜備用。采用美國Biosep-SEC-S4000色譜柱(300 mm×7.8 mm,15~500 kDa),流動相為50%乙腈(含有0.05%的三氟乙酸),流速0.9 mL/min,柱溫30 ℃,進樣量60 μL,紫外檢測波長214 nm。總面筋蛋白的提取用含有2.0 mol/L尿素和1.0%二硫蘇糖醇的樣品緩沖液溶解樣品,其余操作步驟一致。
1.3.7 面團蛋白質亞基占比的測定 參考Bruneel等[18]的方法并稍作修改,準確稱取含有50.00 mg干基蛋白質的面團凍干樣品,先用含有0.4 mol/L氯化鈉的1.5 mL磷酸鹽緩沖液(0.05 mol/L,pH 7.6)提取兩次,棄上清液,再用1.5 mL的去離子水提取一次,棄上清液;將沉淀物用1.5 mL 60%乙醇提取3次,室溫離心(15 000 r/min)后收集上清液,即為麥醇溶蛋白的提取液;沉淀物用1.5 mL含有50%異丙醇,2.0 mol/L尿素,1.0%二硫蘇糖醇的Tris-HCl 緩沖液(0.05 mol/L,pH 7.5)于60 ℃下提取3次,室溫離心(15 000 r/min)后收集上清液,即為麥谷蛋白的提取液,過0.45 μm濾膜后備用。選用德國Nucleosil 300-5 C8色譜柱,流動相分別為含有0.1%的三氟乙酸的超純水(A液)和含有0.1%的三氟乙酸的乙腈(B液),洗脫條件為二元高壓梯度洗脫,洗脫液中B的濃度為24.0%~56.0%。流動相總流速1 mL/min,柱溫50 ℃,進樣量100 μL,紫外檢測波長214 nm。參考Wieser等[19-20]的方法將各峰區分,并計算各亞基所對應洗脫曲線的峰面積。
1.3.8 數據統計與分析 采用SPSS 23.0在P<0.05檢驗水平上進行顯著性分析,數據表示為(平均值±標準差);采用Origin 2016制圖。
2 結果與分析
2.1 揉面過程中面團質構特性的變化
由圖1可知,揉面可使面團硬度、彈性和黏性增加,當揉面時間為10~15 min時,硬度大幅增加,黏性和彈性發生輕微下降。這可能是由于揉面初期,在力的作用下,面團中蛋白質大分子相互纏結,形成部分應力,使得面團變得堅韌和致密;揉面后期因外力作用時間過長,在內部產生的應力經熟化靜置后并未完全消去,存在殘余應力使得面團吸水能力和彈性性能輕微下降。
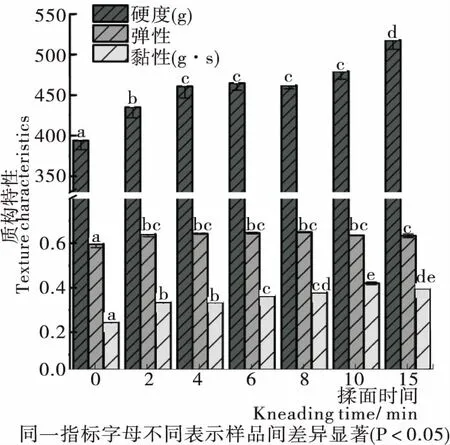
圖1 揉面過程中面團質構特性的變化
Figure 1 Changes in dough texture characteristics during kneading
2.2 揉面過程中面團巰基與二硫鍵含量的變化
由表1可知,隨著揉面時間的延長,巰基—二硫鍵互換增多,二硫鍵逐漸增加,表明此階段,面筋蛋白內部發生了二硫鍵交聯,且交聯程度不斷增強。當揉面時間為2 min時,游離巰基的減少率與二硫鍵的增長率分別為10.69%,4.48%,隨后緩慢互為轉換;當揉面時間為6~10 min時,二者轉換速率幾乎為零;當揉面時間為15 min時,互換速率增大,游離巰基的減少率與二硫鍵的增長率分別為17.19%,5.09%。這可能是由于揉面初期,在力的作用下蛋白質分子與水分子深度接觸,水合作用增強,水溶的氧分子促進了游離巰基氧化為二硫鍵;隨著揉面時間的延長,水合作用進一步增強,直至飽和;揉面后期由于面團長時間被360°揉捏暴露于空氣中,蛋白質分子與氧氣接觸增多,一定程度上促進了氧化作用。
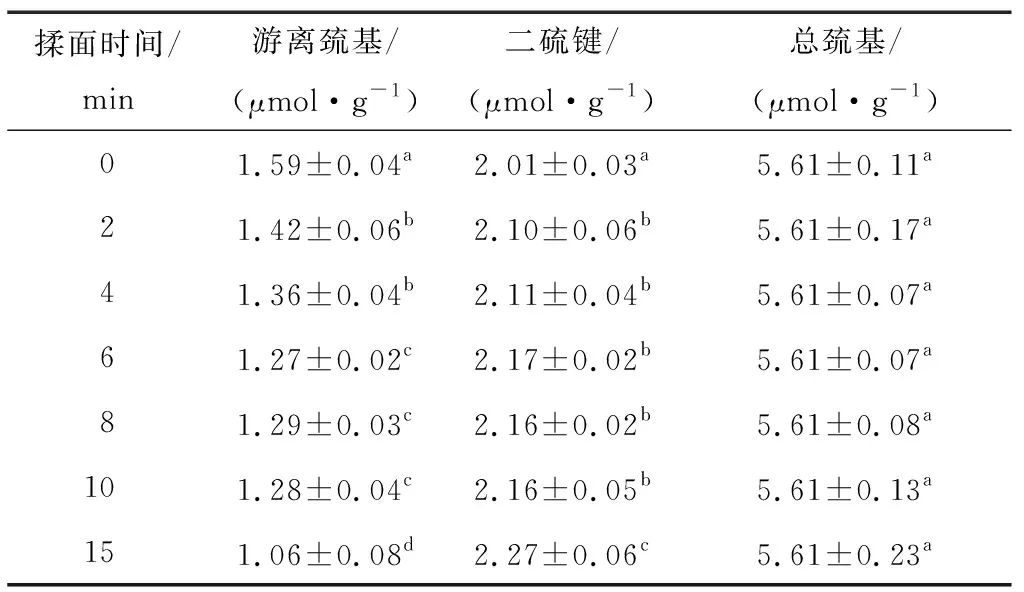
表1 揉面過程中面團巰基與二硫鍵的變化?
? 同列字母不同表示有顯著性差異(P<0.05)。
2.3 揉面過程中面團蛋白質分子間作用力的變化
由圖2可知,揉面初期,氫鍵大量形成,隨后含量趨于穩定;疏水相互作用先大幅下降后趨于平緩。當揉面時間為0 min時,疏水相互作用相對處于較高水平,氫鍵處于較低水平,是由于揉捏使面團中水分子與蛋白質分子進一步接觸,蛋白質分子與水分子間的氫鍵結構取代了水—水氫鍵結構,蛋白質與水相互作用增強直至趨于飽和狀態,此外,疏水相互作用與自由巰基的氧化有關,游離巰基氧化形成二硫鍵使蛋白質疏水相互作用降低[21]。面團蛋白質分子與水分子的進一步結合,疏水相互作用下降,面筋蛋白分子聚集和締合形成緊密的網絡,提高了蛋白質的彈性,使其結構更加穩定,增強了面團的彈性,與上述質構特性結果一致。
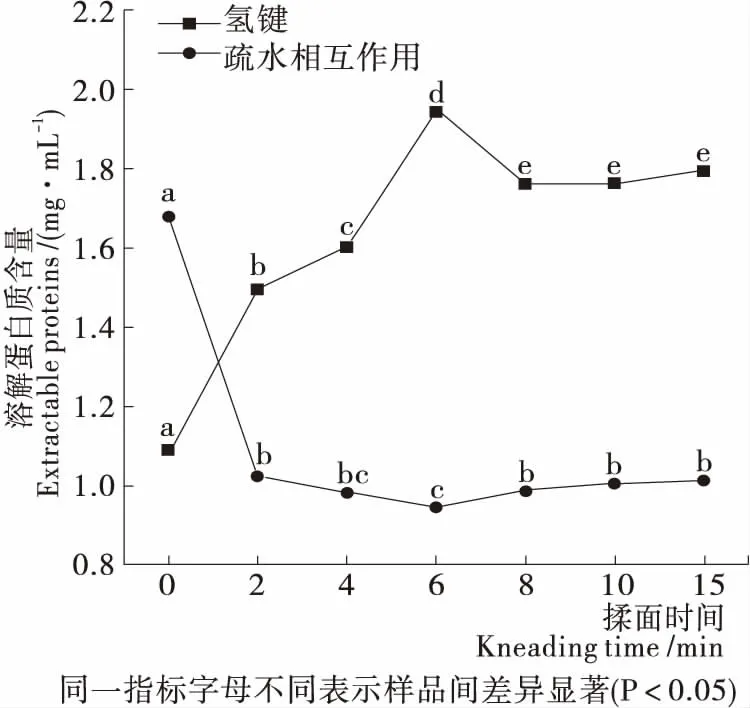
圖2 揉面過程中面團蛋白質分子間作用力的變化
Figure 2 Changes of protein intermolecular forces in dough during kneading
2.4 揉面過程中面團蛋白質二級結構的變化
酰胺I帶對應的拉曼光譜可用于表征蛋白質二級結構變化,1 614~1 640 cm-1對應的譜峰可歸于β-折疊,1 640~1 650 cm-1對應的譜峰可歸于無規則卷曲,1 650~1 660 cm-1對應的譜峰可歸于α-螺旋,1 660~1 685 cm-1對應的譜峰可歸于β-轉角[22-24]。由圖3可知,揉面過程中面團的蛋白質二級結構:α-螺旋和β-轉角處于動態波動狀態,基本無變化;無規則卷曲揉面初期驟降56.52%,β-折疊揉面初期增加32.34%,隨后二者變化幅度較小。這表明揉面過程中面團蛋白質的構象變化主要取決于β-折疊和無規則卷曲,進而影響面筋網絡結構的形成。β-折疊一般被認為是所有二級結構中最為穩定的一種構象。Choi等[25]研究表明,相比β-轉角和無規卷曲,α-螺旋和β-折疊屬于比較有序化的構象,具有較高的穩定性。故揉面可大幅提升面筋蛋白結構的穩定性和有序性。隨著揉面的進行,β-折疊有小幅度的增加和降低變化,與二硫鍵含量變化趨勢一致,可能是由于二硫鍵有促進蛋白結構更易于形成β-折疊的作用[26]。
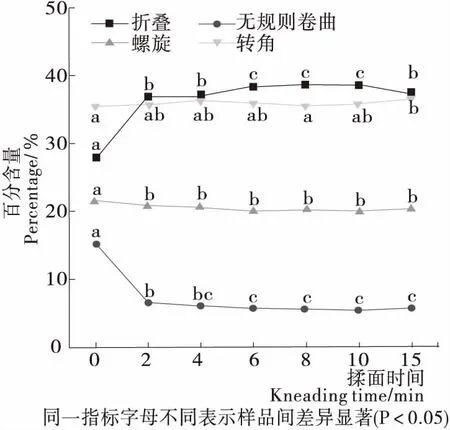
圖3 揉面過程中面團蛋白質二級結構的變化
Figure 3 Changes of dough protein secondary structure during kneading
2.5 揉面過程中面團面筋蛋白可萃取率的變化
Pareyt等[27]研究表明,SDS可萃取麥谷蛋白的保留時間為5.00~7.25 min,SDS可萃取麥醇溶蛋白的保留時間為7.25~10.50 min。由圖4可知,隨著揉面的進行,麥谷蛋白的峰面積下降趨勢不明顯,麥醇溶蛋白的峰面積有不同程度的下降,揉面后期,麥醇溶蛋白峰面積有一定程度增加,但仍然低于0 min的。這表明在揉面階段,麥醇溶蛋白發生聚合,而麥谷蛋白僅有輕微下降,結果不明顯,有待進一步研究認證。
由圖5可知,隨著聚集過程的進行,SDS可提取部分減少,SDS不可提取部分增加[28]。揉面過程中,麥谷蛋白萃取率下降幅度雖然較小,但不同樣品間具有顯著性差異(P<0.05),麥醇溶蛋白萃取率揉面初期下降,揉面后期(8~15 min)有所提升,但仍然低于0 min的,與圖4結果一致。揉面后期麥醇溶蛋白和麥谷蛋白的萃取率發生不同程度提升,可能是因為揉面后期面團已充分水合,且施加作用力時間過長,產生的機械可導致蛋白發生輕微解聚,或是使蛋白構象發生一定變化。
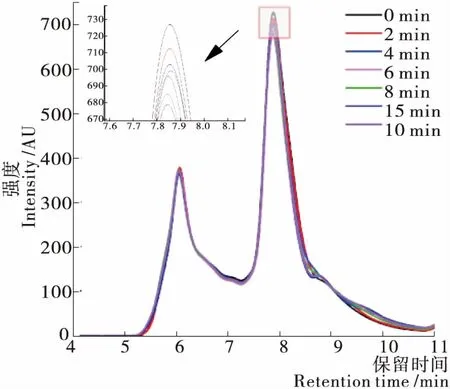
圖4 揉面過程中SDS可萃取面筋蛋白的SE-HPLC圖譜
Figure 4 SE-HPLC chromatogram of SDS extractable gluten protein during kneading
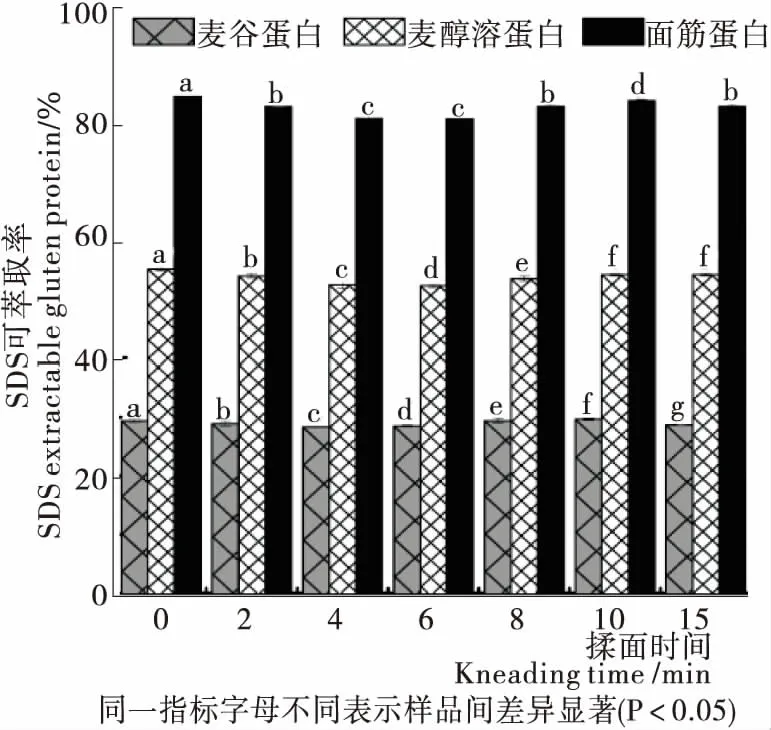
圖5 揉面過程中面團面筋蛋白SDS可萃取率的變化
Figure 5 Changes in SDS extractable rate of dough gluten protein during kneading
2.6 揉面過程中面團蛋白質亞基占比的變化
面筋提取物可分為兩大類,分別是麥醇溶蛋白亞基(ω-、α-、γ-麥醇溶蛋白)和麥谷蛋白亞基(HMW-GS和LMW-GS),其中LMW-GS又可分為B/C-LMW-GS和D-LMW-GS[29-30]。由圖6可知,揉面過程中,ω-麥醇溶蛋白亞基峰面積無明顯變化,γ-麥醇溶蛋白亞基峰面積僅在揉面初期(2 min)發生下降,隨后與初始值差異不大,α-麥醇溶蛋白亞基峰面積明顯下降,尤其是揉面初期最為顯著,與麥醇溶蛋白的SDS可萃取率下降趨勢一致。
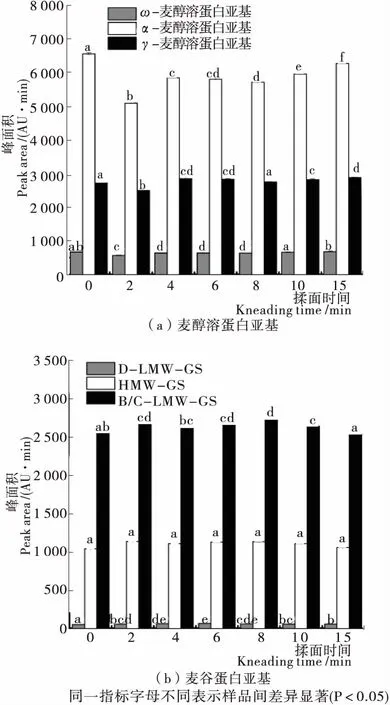
圖6 揉面過程中面團蛋白亞基的變化
Figure 6 Changes in dough protein subunits during kneading
揉面過程中α-麥醇溶蛋白亞基峰面積分別降低了22.42%,10.87%,11.59%,12.87%,9.22%,4.35%,表明隨著揉面的進行,面團黏性和延展性得到加強。麥谷蛋白的B/C-LMW-GS峰面積顯著增加,HMW-GS峰面積無明顯變化,說明揉面過程中麥谷蛋白交聯程度增強主要是以低分子量麥谷蛋白為主。LMW-GS是小麥面筋蛋白的主要成分之一,決定著面團的面筋強度和彈性[31]。揉面過程中B/C-LMW-GS峰面積分別增加了4.56%,2.61%,4.11%,6.73%,3.18%,0.81%,表明隨著揉面的進行,面團彈性得到增強。
3 結論
隨著揉面的進行,面團黏彈性增強,揉面初、中期(0~8 min)面團的游離巰基下降,二硫鍵增多,氫鍵增多,疏水作用力下降;二級結構中的β-折疊增多,無規則卷曲下降,α-螺旋和β-轉角無明顯變化;面筋蛋白、麥醇溶蛋白、麥谷蛋白的SDS可萃取率均有不同程度下降;麥谷蛋白主要是以低分子量蛋白發生交聯聚合,麥醇溶蛋白的α-、γ-麥醇溶蛋白亞基參與了面筋蛋白的交聯聚合反應。揉面后期(10~15 min),各指標或是趨勢變得平緩或是發生不同程度反彈,但依然區別于初始值(0 min)。因此,在實際生產應用中,可增加揉面工藝,選取適當時間,可一定程度上改善面團的黏彈性,進而改善面條品質。試驗僅從面團面筋蛋白結構構象或成分含量的變化解釋面團黏彈性變化,后續可從非線性力學角度(如流變學特性等)定量或定性表征揉面過程中面團面筋蛋白黏彈性變化,使研究更加完善。

