實時熒光定量RT-PCR方法在登革熱小鼠模型中的評估及應用
陳 倩,李 丹,佟 巍,蔡方舟,郭 智,鮑琳琳,王 衛
(北京協和醫學院比較醫學中心,中國醫學科學院醫學實驗動物研究所,新發再發傳染病動物模型研究北京市重點實驗室,衛健委人類疾病比較醫學重點實驗室,北京 100021)
目前國內尚未建立理想的重癥登革熱動物模型,缺乏指導性強、可靠穩定的病原學指標。文獻報告指出病毒的定量檢測可針對病毒顆粒、病毒抗原、病毒核酸等[1]。傳統方法有病毒分離方法,常用細胞培養分離和乳鼠顱內接種分離等,該方法比較可靠,但操作繁瑣,實驗周期長,不利于登革病毒的快速診斷。其次是抗原檢測方法,酶聯免疫吸附法(ELISA)、膠體金免疫層析法(GICA)和免疫熒光法(IFA)等。但抗原檢測方法操作繁瑣,檢測靈敏度較低,易與其他黃病毒發生交叉反應,產生假陽性[2-3]。在過去的幾十年,分子診斷技術不斷進步,使得檢測和鑒定各種病原體更加可靠。其中實時熒光定量PCR方法逐漸成為病毒快速診斷的新的金標準。本研究對現有登革病毒RT-PCR檢測方法進行優化,創建一步法實時熒光定量RT-PCR方法,并用于登革病毒感染小鼠模型的評估。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物
2日齡SPF級BALB/c雄性乳鼠20只,體重2~3 g,購自北京華阜康生物科技股份有限公司[SCXK(京)2019-0008],用于登革病毒的擴增。4~6周清潔級C57BL/6背景的I型干擾素受體敲除小鼠(Ifnar1-/-)[SCXK(京)2014-0011],雌雄各半,共計40只,體重18~22 g,由中國醫學科學院醫學實驗動物研究所北方中心提供,用于登革熱小鼠模型制備。動物實驗方案得到中國醫學科學院醫學實驗動物研究所實驗動物使用和管里委員會的批準(WW18002)。動物飼養與實驗均在中國醫學科學院醫學實驗動物研究所生物安全二級動物實驗室(ABSL-2),遵照3R原則進行。
1.1.2 病毒株
登革病毒(DENV):I型(TH-Sman株)、II型(New Guinea株/NGC適應株/TH-36株)、III型(TH87株)、IV型(H241株)均購自ATCC,本課題組保存。特異性分析所用病毒株包括:腸道病毒71型EV71(MP10株)、柯薩奇病毒10型CA10(SJZK12-0046T株)、柯薩奇病毒16型CA16(Shzh05-1株)、鼠肺炎病毒PVM(15株)、鼠肝炎病毒MHV(A59株)、呼腸孤病毒REO(Abney株)、鼠諾如病毒MNV(CW1株)、及狂犬病毒RV(CVS株)分別由中國醫學科學院醫學實驗動物研究所腸道病毒課題組、檢測中心及本課題組提供。
1.2 主要試劑與儀器
RNA提取試劑盒(RNeasy Mini Kit: 52904)和實時熒光定量PCR試劑盒(Probe RT-PCR Kit: 204443)均購自德國Qiagen公司;Applied Biosystems 7500實時熒光定量PCR儀購自美國Thermo Fisher公司。
1.3 實驗方法
1.3.1 引物和探針
根據文獻[4],選擇特異引物和TaqMan探針,上下游引物及探針序列分別為:5’-GAR AGA CCA GAG ATC CTG CTG TCT-3’; 5’-ACC ATT CCA TTT TCT GGC GTT-3’; 5’-FAM-AGC ATC ATT CCA GGC AC-MGB-3’,委托中美泰和公司合成。
1.3.2 標準品的制備
選擇II型登革病毒(New Guinea株) 3’ UTR的目的片段制備標準品。使用上述特異性引物進行PCR擴增,將目的基因克隆于TOPO載體,構建質粒作為標準品,以上操作委托中美泰和公司完成。質粒合成后,用紫外分光光度計測定原倍標準品,質粒濃度為1035 ng/μL。
1.3.3 動物感染和取材
為擴增登革病毒,使用1 mL胰島注射器(BD: 328421)吸取20 μL New Guinea病毒液,顱內接種2日齡BALB/c乳鼠(病毒濃度:8×105Copies/μL)。觀察8~9 d,出現麻痹、抽搐癱瘓等中樞神經系統癥狀,則安樂處死動物。采取鼠腦,研磨;3500 r/min離心15 min,吸取上清凍存于-80℃冰箱。為建立小鼠模型,使用1 mL胰島注射器吸取100 μL New Guinea病毒液,尾靜脈接種Ifnar1-/-小鼠(病毒濃度:8×106Copies/μL)。在感染后第4天(4 Days Postinfection, Dpi.4)采取組織樣本,直接凍存于-80℃冰箱;Dpi.2、4、6、8采取血液樣本,3000 r/min離心10 min,吸取上清凍存于-80℃冰箱。
1.3.4 病毒核酸的提取
本實驗操作在生物安全二級實驗室(BSL-2)的生物安全柜內進行,操作步驟參見試劑盒說明書。簡單地,1.5 mL EP管內預置560 μL病毒裂解液,加入140 μL樣本;靜置10 min,充分裂解。再加560 μL無水乙醇,混勻;轉移至2 mL收集柱內,8000 r/min;加500 μL AW1,8000 r/min;加500 μL AW2,14000 r/min;空離14000 r/min;換新的1.5 mL EP管;加40 μL AVE,8000 r/min;重復上一步驟。4℃保存繼續下一步實驗,或凍存于-80℃冰箱。
1.3.5 一步法實時熒光定量PCR反應
根據表1,配制實時熒光定量PCR反應體系;根據表2,設定反應程序,共40個循環。
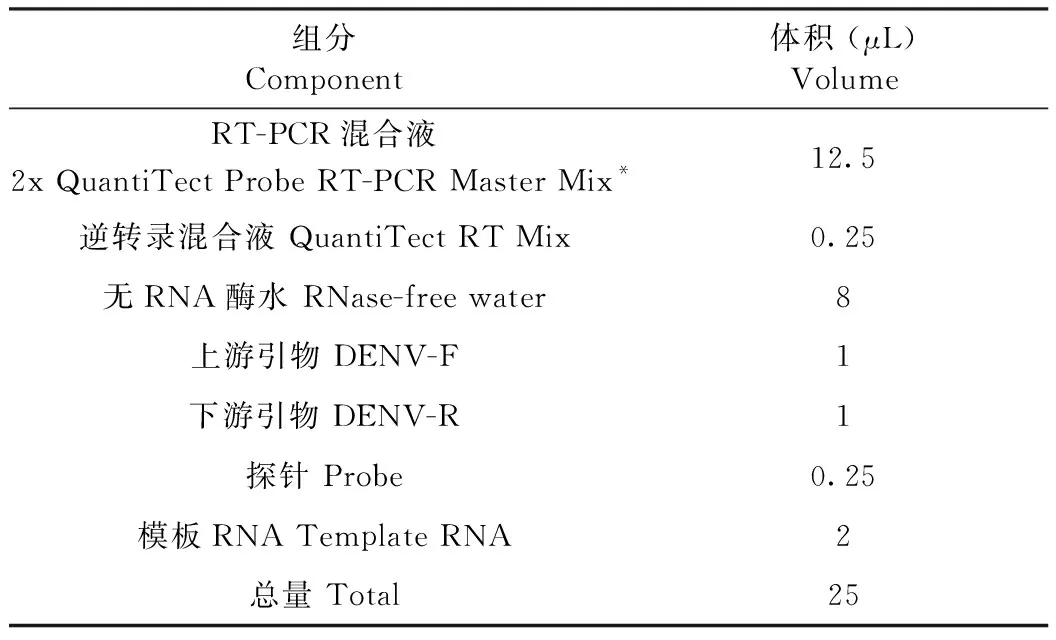
表1 PCR反應體系
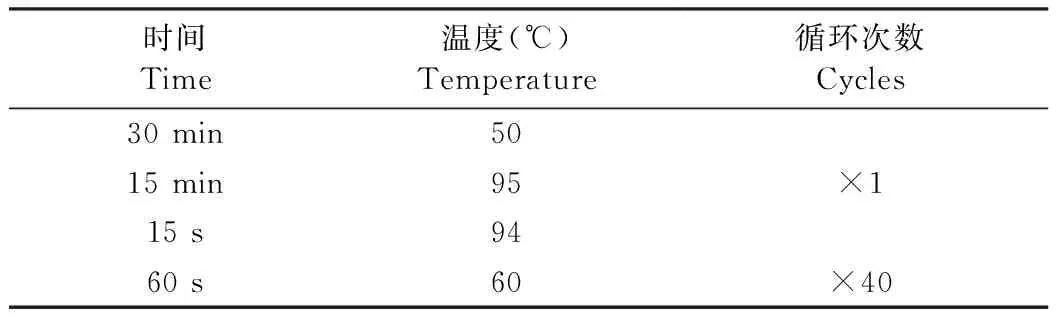
表2 PCR反應程序
1.4 統計學方法
實驗中得到的數據使用SPSS統計軟件進行統計分析,NGC株與NGC適應株感染的小鼠樣本重復三次檢測,計算各組數據Ct值的標準差(Standard deviation, SD)和變異系數(Coefficient of Variation, CV)[5]。
2 結果
2.1 一步法實時熒光定量PCR方法的確定
在獲得質粒標準品之后,使用分光光度計測定,測得質粒原液DNA濃度為1035 ng/μL。根據計算公式:質粒拷貝數(Copies/μL)=6.02×1023(Copies/mol)×質粒濃度(g/μL)/質粒分子量(g/mol)[6];原倍質粒拷貝數為4.96×1011Copies/μL,連續十倍稀釋,做6個稀釋度,分別使用102~107倍稀釋的標準品作為模板進行qRT-PCR,建立擴增曲線(圖1)和標準曲線(圖2)。圖1中1~6為不同的稀釋度,分別為4.96×104~ 4.96×109Copies/μL,可見各梯度間隔得臨界循環數(threshold cycle, Ct)基本相等,約3個循環左右;以II型登革病毒標準品稀釋拷貝數的對數值為橫坐標,以Ct值為縱坐標建立實時熒光定量PCR的標準曲線。由標準曲線得出擴增效率為95.8%,相關系數R2=0.999,表明該PCR方法擴增效率較高,線性關系良好。
2.2 熒光定量PCR方法的評估
2.2.1 靈敏性分析
為了解該PCR方法的靈敏性,將II型登革病毒標準品進行十倍連續稀釋(4.96~49.6×1010Copies/μL),分別進行PCR檢測。結果表明:濃度為4.96×101~4.96×1010Copies/μL的標準品都能產生擴增曲線,而4.96 Copies/μL的標準品未能檢測到熒光信號(見圖3)。由此可知4.96×101~4.96×1010Copies/μL為該方法可以檢測到的線性范圍,最低檢測線為49.6 Copies/μL,靈敏性較好。
2.2.2 特異性分析
為了解該PCR檢測方法的特異性,使用該PCR方法分別檢測多種實驗小鼠或小鼠模型常見病毒,包括四種血清型的登革病毒(I型TH-Sman株;II型New Guinea株/TH-36株;III型TH87株;IV型H241株)、腸道病毒(EV71、CA10、CA16)、PVM、PHV、REO、MNV及RV。結果顯示:只有Ⅰ~Ⅲ型登革病毒(TH-Sman株、New Guinea株/TH-36株、TH87株)產生了擴增曲線,其余病毒均未檢測到熒光信號(見圖4),說明無交叉反應,與預想一致,表明該PCR方法特異性良好。
2.2.3 穩定性分析
為了解該PCR方法的穩定性,本研究使用登革熱小鼠模型常用的Ⅱ型登革病毒(New Guinea株及NGC適應株)來進行測試。分別將兩株登革病毒十倍連續稀釋,共6個梯度,經PCR檢測,實驗重復三次,結果見表3。結果顯示:每個稀釋度樣本Ct值的標準差均小于0.5,且CV值均小于5%,表明該方法重復性好,穩定可靠。

圖1 標準品的擴增曲線Figure 1 Amplification curve of the standard
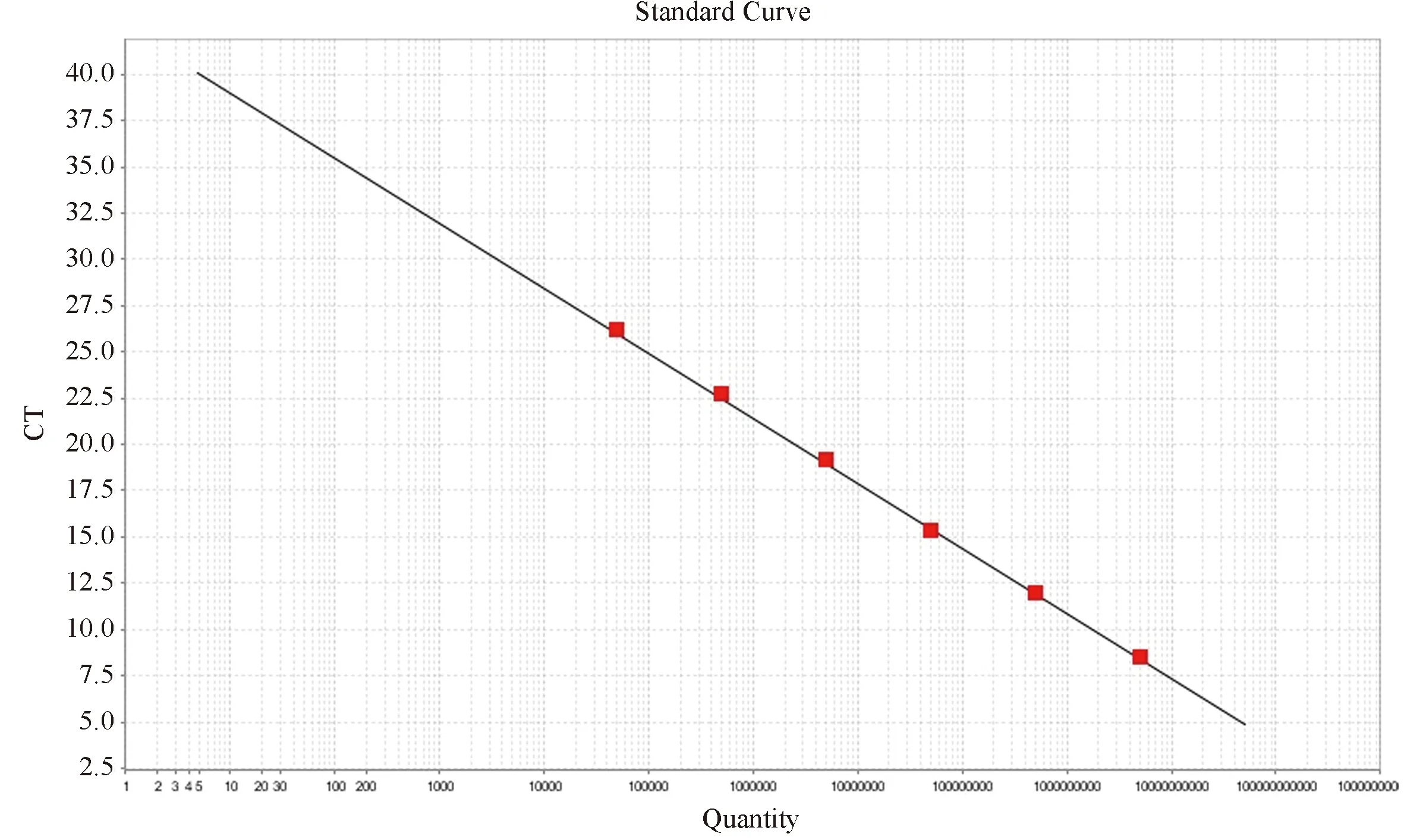
圖2 標準曲線Figure 2 Standard curve
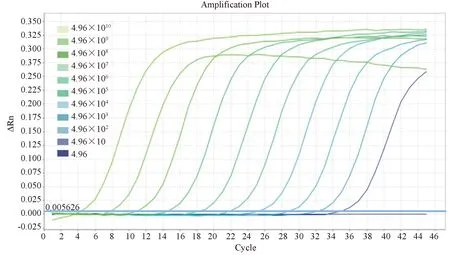
圖3 熒光定量PCR方法的靈敏性Figure 3 Sensitivity of the fluorescence quantitative PCR method
2.3 DENV RT-PCR方法的初步應用
為確定該PCR方法在登革熱動物模型研究中的實際使用效果,使用Ⅱ型登革病毒New Guinea株和N10株分別感染I型干擾素受體敲除小鼠 (Ifnar1-/-),獲得感染后不同天數的血清樣本及感染后第4天的組織樣本。經實時熒光定量PCR檢測,測得小鼠體內病毒載量的水平與分布。由圖5可知:New Guinea株感染Ifnar1-/-小鼠,血清樣本中病毒載量水平在感染后第2天達到高峰,在感染后第8天消失。由圖6可知:登革病毒感染小鼠后,病毒主要分布在小腸、脾、肝、腎和腦。在感染后第4天,不同組織中病毒載量水平具有差異。New Guinea株感染小鼠在腸、腎、肝組織中未見明顯病毒載量,NGC適應株感染小鼠在腸、脾、腎組織中可檢測到高水平的病毒核酸,表明了兩株登革病毒在小鼠體內的播散和分布情況。本方法使用于登革熱小鼠模型的不同組織樣本,多數可檢測到熒光信號,Ct值主要介于26~31之間,檢出率良好,表明本檢測方法可應用于登革熱小鼠模型的病毒定量檢測。
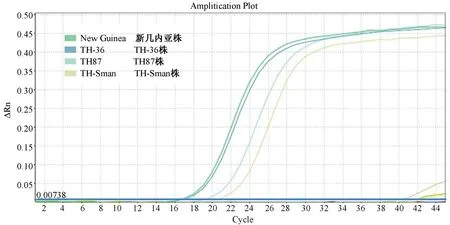
圖4 熒光定量PCR方法的特異性Figure 4 Specificity of fluorescence quantitative PCR method
表3熒光定量PCR方法的穩定性
Table3Repeatability of the fluorescence quantitative PCR method
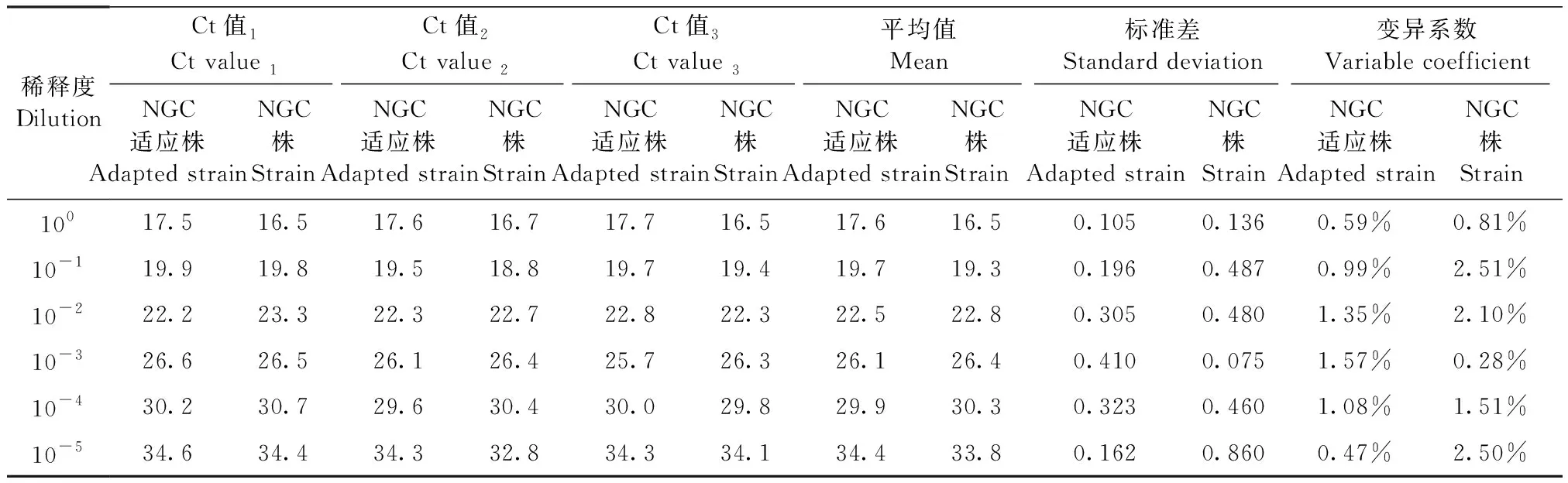
稀釋度DilutionCt值1Ct value 1Ct值2Ct value 2Ct值3Ct value 3平均值Mean標準差Standard deviation變異系數Variable coefficientNGC適應株Adapted strainNGC株StrainNGC適應株Adapted strainNGC株StrainNGC適應株Adapted strainNGC株StrainNGC適應株Adapted strainNGC株StrainNGC適應株Adapted strainNGC株StrainNGC適應株Adapted strainNGC株Strain10017.516.517.616.717.716.517.616.50.1050.1360.59%0.81%10-119.919.819.518.819.719.419.719.30.1960.4870.99%2.51%10-222.223.322.322.722.822.322.522.80.3050.4801.35%2.10%10-326.626.526.126.425.726.326.126.40.4100.0751.57%0.28%10-430.230.729.630.430.029.829.930.30.3230.4601.08%1.51%10-534.634.434.332.834.334.134.433.80.1620.8600.47%2.50%
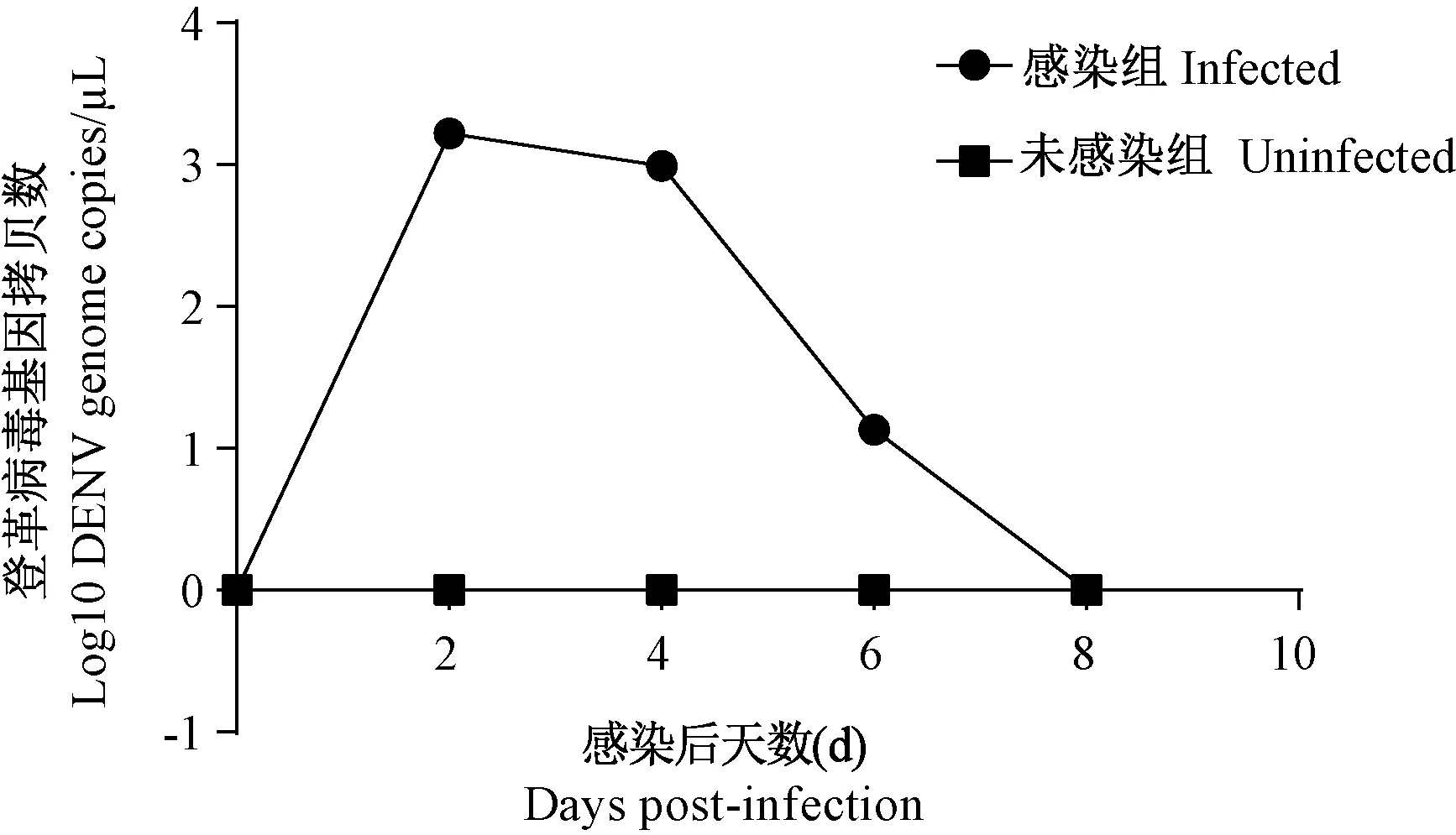
圖5 II型登革病毒感染I型干擾素受體敲除小鼠血清樣本中病毒載量Figure 5 Viral load in serum samples from Ifnar1-/-mice infected with dengue virus type II
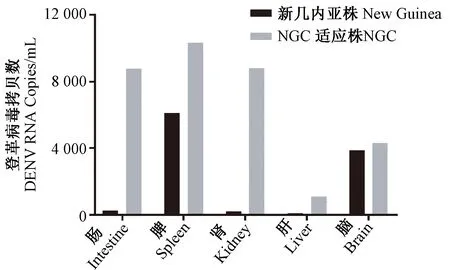
圖6 II型登革病毒感染I型干擾素受體敲除小鼠組織樣本中病毒載量Figure 6 Viral load in tissue samples from Ifnar1-/-mice infected with type II dengue virus
3 討論
登革熱和嚴重登革熱是由登革病毒感染引起的傳染性疾病,已成為全球性的嚴重公共衛生問題,目前仍缺少針對該疾病安全有效的藥物和疫苗[7-8]。合適的動物模型是登革熱防治產品和策略研究的重要工具[9]。熒光定量PCR方法是感染性模型檢測常用的實驗方法。本研究旨在評估可應用于登革病毒感染動物模型檢測的一步法實時熒光定量PCR方法,從而為登革熱小鼠模型的建立提供基礎方法,推動疫苗和藥物的研發進程。
登革熱的分子診斷逐漸取代傳統的病毒分離方法,成為病毒檢測的金標準[10-11]。在過去十幾年中,已經報道了多種基于RT-PCR的方法,主要針對NS1、NS5、3’UTR等基因序列[12-14]。Lanciotti等人[15]最初報道了兩步嵌套式逆轉錄PCR,后經Harris等[16]改進為一步多重逆轉錄PCR用于登革病毒的檢測和分型。但使用瓊脂糖凝膠電泳分析擴增子大小區分四種血清型的登革病毒,靈敏度較低。Shu等[17]建立的血清型特異的一步法SYBR Green I實時熒光定量PCR方法,可以用于登革病毒感染急性期的檢測與分型。但由于該染料可非特異性的結合DNA雙鏈,因而假陽性信號產生的機率增加[4, 17-18]。Klungthong等[19]使用泰國收集的16454例登革熱患者陽性血清,提高登革病毒檢測的巢式PCR的靈敏度,但該方法需兩次擴增步驟,操作相對繁瑣。Sasmono等[10, 20]新建立了Simplexa Dengue 檢測方法,提高了檢測的靈敏度。但是,目前登革病毒的分子檢測方法主要應用于臨床樣本,針對登革熱動物模型的檢測方法較少。
本研究改進并評估檢測登革病毒的一步法實時熒光定量PCR方法,應用于登革熱小鼠模型中。相對于普通的熒光定量PCR方法,本檢測方法具有以下幾個特點。一是使用了新型MGB探針,該探針與一般的TaqMan探針相比具有多種優勢。首先,MGB探針在3’端采用非熒光淬滅基團,本身不產生熒光,取代了常規可發光的熒光標記,大大降低反應的本底信號強度,提高反應的靈敏度。其次,MGB探針比一般探針的Tm值高,約10℃左右,增強反應的特異性[12]。二是簡化了操作步驟,縮短了檢測時間。常規實時熒光定量PCR檢測需要進行逆轉錄及熒光定量兩個步驟,所需4~6 h不等;而本檢測方法通過使用一步法,只需約2 h便可得出結果。三是針對特定的病毒基因型。根據病毒包膜蛋白E的抗原性不同,登革病毒分為Ⅰ~Ⅳ個血清型。其中Ⅳ型登革病毒的遺傳偏差較大,與Ⅰ~Ⅲ型存在較大的遺傳差異性(33%)[21]。而我們建立的動物模型主要針對Ⅰ~Ⅲ型登革病毒,因此,本方法選擇的引物和探針也是針對Ⅰ~Ⅲ型登革病毒。
本研究使用的登革病毒檢測方法具有靈敏度高、特異性強、穩定性高等優點。通過對Ⅱ型登革病毒不同稀釋度的標準品進行檢測,最低限度達49.6 Copies/μL,靈敏度較好。同時,對4種血清型的登革病毒和多種實驗小鼠、小鼠模型常見病毒進行檢驗,僅登革病毒產生擴增曲線,而EV71、CA10、CA16等其他9株RNA病毒檢測結果均呈陰性,表明特異性好。使用12份乳鼠腦組織樣品重復測定3次,標準差均小于0.5,變異系數小于5%,表明本方法可重復性高。
登革熱小鼠模型的建立及登革病毒檢測對于登革熱發病機理、藥物和疫苗研究具有重要意義[22]。第一代登革熱小鼠模型使用高劑量登革病毒,以顱內注射的方式感染免疫健全小鼠,出現了在登革熱患者身上并未觀察到的神經癥狀,如四肢癱瘓、麻痹等。第二代模型使用登革病毒感染缺乏干擾素受體的免疫缺陷小鼠,如AG129小鼠等,該模型可模擬部分人類登革熱癥狀,但不適于研究宿主的免疫應答[23]。在最近的工作中,研究者期望建立登革病毒的小鼠適應株,以低劑量病毒感染小鼠,使其不產生神經癥狀,更好的模擬人類登革熱的臨床表現,從而為后續研究奠定基礎。本研究將檢測登革熱患者臨床樣本的實時熒光定量PCR方法改善、評估后,應用于登革熱小鼠模型的病毒載量檢測中。通過對40份不同的小鼠組織樣本,如小腸、肝臟、脾臟等和40份血清樣本進行定量檢測,結果顯示 Ifnar1-/-小鼠樣品中登革病毒均呈陽性,且病毒載量水平具有差異。表明本檢測方法適用于小鼠模型,登革病毒感染后不同時期及不同樣本中的檢驗,檢出率良好。值得注意的是,本檢測方法用于登革熱動物模型,需要明確具體檢測時間及待檢組織,現有模型樣品在病毒感染8 d之后,無法檢測到陽性結果;還需明確動物種類及用途等,本研究使用一型干擾素受體敲除小鼠(Ifnar1-/-),如本方法應用于其他物種模型還需要進行預試,避免假陽性和假陰性的出現。
總之,本研究確認并評估了一種針對登革病毒的qRT-PCR方法,該方法可特異、靈敏、穩定地檢測登革病毒,適用于登革病毒感染動物模型的建立和應用工作中,從而促進登革熱發病機制研究及支撐藥物疫苗研發。

