利拉魯肽聯合骨髓間充質干細胞移植對急性肺損傷的保護作用
周 航 李同林 宮 帥
(中航工業三六三醫院,成都 610000)
急性肺損傷是由感染、創傷、中毒等原因引發的呼吸系統急癥,發病急,以嚴重的炎癥反應、肺泡毛細血管屏障受損引起的肺水腫為病理特征,如未給予及時有效治療,可發展為急性呼吸窘迫綜合征,死亡率較高[1-3]。對于急性肺損傷主要是藥物治療和機械通氣,臨床常用藥物有烏司他丁、氨溴索、吸入性一氧化氮或肺表面活性物質等[4-7],均可在短期內改善患者臨床癥狀,但無法改善患者生存率,而糖皮質激素的遠期應用不良反應較大[8],也不能改善患者生存率,目前尚缺乏有效的治療方法,因此學者們一直致力于尋找更有效的治療方案。
利拉魯肽是一種人胰高糖素樣肽1類似物,與人胰高糖素樣肽1具有97%的序列同源性,可結合并激活人胰高糖素樣肽1受體,而人胰高糖素樣肽1受體廣泛分布于胰腺、大腦、肺、腎臟、胃、心臟等組織。以往研究已證實[9-11],人胰高糖素樣肽1可促進胰島素的分泌和生物合成,促進胰腺β細胞增殖,增加生長抑素釋放,抑制胰高血糖素分泌;可誘導神經細胞分化,保護海馬神經元;改善心肌功能,抑制心肌細胞凋亡。王杰等[12]通過脂多糖誘導的小鼠肺泡上皮MLE-12細胞損傷模型發現,人胰高糖素樣肽1類似物利拉魯肽對損傷Ⅱ型肺泡上皮細胞具有保護作用。谷萍姣等[13]通過脂多糖誘導的動物急性肺損傷模型發現,利拉魯肽可通過改善小鼠生理功能、肺組織病理損傷程度、減輕肺水腫、減少肺組織中性粒細胞聚集來發揮肺保護作用。間充質干細胞可調節機體免疫反應,促進受損組織修復,為治療急性肺損傷提供了新的思路。動物實驗顯示,間充質干細胞可減輕細菌性肺炎和缺血再灌注誘導的肺損傷,促進呼吸機相關肺損傷的修復。基于以上研究,實驗假設利拉魯肽聯合間充質干細胞移植治療急性肺損傷可獲得更佳的治療效果,現將結果報道如下。
1 材料與方法
1.1材料
1.1.1試劑與儀器 利拉魯肽(204656-20-2)購自,蘇州天馬醫藥集團天吉生物制藥有限公司;胎牛血清(SV30087)、DMEM/F12培養液(SH30021.01B)購自北京美同達科技有限公司;Percoll 細胞分離液購自南京森貝伽生物科技有限公司;成軟骨誘導分化培養基(M026)、成骨誘導分化培養基(M025)購自武漢維諾賽生物技術有限公司;戊巴比妥鈉(57-33-0)購自北京嵐泰化工科技有限公司;脂多糖購自上海昂一生物科技有限公司;ELISA檢測試劑盒(MM-0240O1,MM-0163M1,MM-0047R1)購自武漢益普生物科技有限公司;Tunel試劑盒(C1088)購自碧云天;熒光顯微鏡(VMF400I)購自蘇州景通儀器有限公司;兔抗鼠單克隆抗體甲狀腺轉錄因子1(SPT24)購自廣州歐邊生物制品有限公司。
1.1.2實驗動物 10周齡雄性BALB/c小鼠55只,由西南醫科大學動物實驗中心提供,生產許可證號:SCXK(川)2018-17,使用許可證號:SCXK(川)2018-065。SPF級,體重(25±3)g,其中5只用于分離培養骨髓間充質干細胞,其余50只用于動物實驗。實驗動物處理符合倫理審查指南 GB/T35892-201。實驗中對動物的處理遵循動物倫理學要求,最大程度地減輕其疼痛。
1.2方法
1.2.1骨髓間充質干細胞的分離培養與鑒定 細胞的培養:取BALB/c小鼠,稱質量,以戊巴比妥鈉30 mg/kg 腹腔注射麻醉后處死,將其置于乙醇中浸泡5 min,無菌條件下取四肢骨,放入含有PBS的培養皿中,小心剔除肌肉、脂肪與結締組織,置于含10%胎牛血清、100 U/ml青霉素與0.1 g/L鏈霉素的DMEM/F12培養液中,去除兩端骨,以培養液反復沖洗骨髓腔至骨發白;將收集的骨髓液制成單細胞懸液,加入1.073 g/L的Percoll 細胞分離液,2 000 r/min 離心30 min,吸取中間云霧狀細胞層,以PBS洗滌2 次,調整細胞濃度為5×108L-1。3 d 后首次換液,以后每2 d或3 d換液1 次,8~12 d 時細胞生長融合達80%以上,此時以胰蛋白酶消化貼壁細胞,按1∶2 比例傳代培養,每2 d或3 d換液1 次。選擇第3代細胞進行實驗。
細胞的鑒定:①取第3代細胞,加入成骨誘導分化培養基,誘導21 d后進行茜素紅染色,觀察向成骨細胞的分化;②取第3代細胞,加入成軟骨誘導分化培養基,誘導14 d后進行甲苯胺藍染色,觀察向軟骨細胞的分化。③取第3代細胞,應用流式細胞儀檢測細胞表面標志物CD29、CD34、CD45、CD90、CD147的表達。
1.2.2實驗動物分組與干預 將50只BALB/c小鼠隨機分為5組,分別為正常組、模型組、細胞組、藥物組與實驗組,每組10只。正常組不進行任何處理,其余4組均建立急性肺損傷模型,造模前禁食12 h、禁水4 h。
建立急性肺損傷模型:取模型組、細胞組、藥物組與實驗組小鼠,腹腔注射30 mg/kg戊巴比妥鈉進行麻醉。麻醉成功后,將小鼠四肢及上顎固定于傾斜臺面上,使頭部處于較高位置,去除頸部毛發,消毒、鋪巾,在頸部皮膚作一0.3 cm的切口,逐層剝離組織,顯露氣管,行氣管穿刺,按5 mg/kg緩慢注射脂多糖溶液,推注后短暫封閉氣管插管5~10 s,使脂多糖均勻分布于全肺中。以肺組織病理:肺泡塌陷出血,肺泡間隔增厚,大量炎性細胞浸潤判定造模成功。造模后,細胞組尾靜脈注射骨髓間充質干細胞懸液1 ml(約含細胞數4×106);藥物組腹腔注射100 μg/kg利拉魯肽[13];實驗組尾靜脈注射骨髓間充質干細胞懸液1 ml(約含細胞數4×106),腹腔注射100 μg/kg利拉魯肽。正常組尾靜脈注射1 ml生理鹽水。
1.2.3檢測指標 脂多糖注射24 h后,麻醉后處死小鼠,取出雙側肺組織,進行以下觀察。
炎性細胞因子檢測:剪開小鼠胸腔,結扎右肺,利用預冷的PBS灌洗左肺,反復灌洗3次,收集支氣管肺泡灌洗液。將支氣管肺泡灌洗液于4℃下500 g離心5 min,取上清,-80℃保存,采用ELISA法檢測炎癥因子腫瘤壞死因子α、IL-1β和IL-6的濃度。嚴格按照試劑盒說明書操作。
肺組織細胞凋亡:采用Tunel法檢測肺組織細胞凋亡。取左肺組織,10%中性甲醛固定24 h,石蠟包埋、切片,切片厚度約5 μm,脫蠟入水,滴加蛋白酶K,37℃反應15 min,PBS清洗3次,每次5 min;滴加100 μl ddH2O稀釋的1×Equilibration Buffer,室溫孵育10~30 min,添加Tunel標記反應混合液,37℃孵育1 h后滴加轉化液50 μl,37℃孵育30 min后PBS清洗,DAB顯色,HE復染,每個切片隨機取5個視野,熒光顯微鏡下計數凋亡細胞數,取平均值。
肺組織濕干質量比:取右上葉肺組織,稱重量,記為W0,為肺組織濕質量;隨后將肺組織置于80℃烤箱中24 h,取出后稱重量,記為W1,計算二者比值。
肺組織病理觀察:取右下葉肺組織,置于4%甲醛溶液中固定24 h→乙醇梯度脫水→放入石蠟溶液中浸泡2 h中進行包埋固定→切片→37℃烤箱內烘烤24 h→65℃烤箱中烤片1 h→脫蠟→HE染色→蒸餾水沖洗,乙醇分色→中性樹膠封固,鏡下觀察。由兩位對實驗不知情的病理科醫師對每張肺組織切片進行病理評分,見表1,最后取平均值。
RT-PCR檢測甲狀腺轉錄因子1基因表達:取右中葉肺組織2 mg,提取總RNA,進行逆轉錄反應,獲取得到cDNA;在無菌EP管中加入1 μl cDNA、10 μl SYBR?Green PCR Master Mix、1 μl甲狀腺轉錄因子1引物、8 μl離子水,總反應體系為20 μl,置于實時定量PCR儀中完成Real time PCR:預變性95℃10 min、變性95℃15 s、復性60℃15 s、延伸72℃ 20 s,共進行40個循環,記錄ΔCT值。甲狀腺轉錄因子1基因引物,正義鏈:5′-GTGCCGGTCCTA-GTCAAAGA-3′,反義鏈:5′-CAGATGGGATAGGCTG-GAGA-3′;β-actin引物,正義鏈:5′-CGAGCGGG-CTACAGCTTC-3′,反義鏈:5′-GTCACGCACGATTCC-CTCT-3′。
表1 肺組織病理評分
Tab.1 Lung Histopathological Score
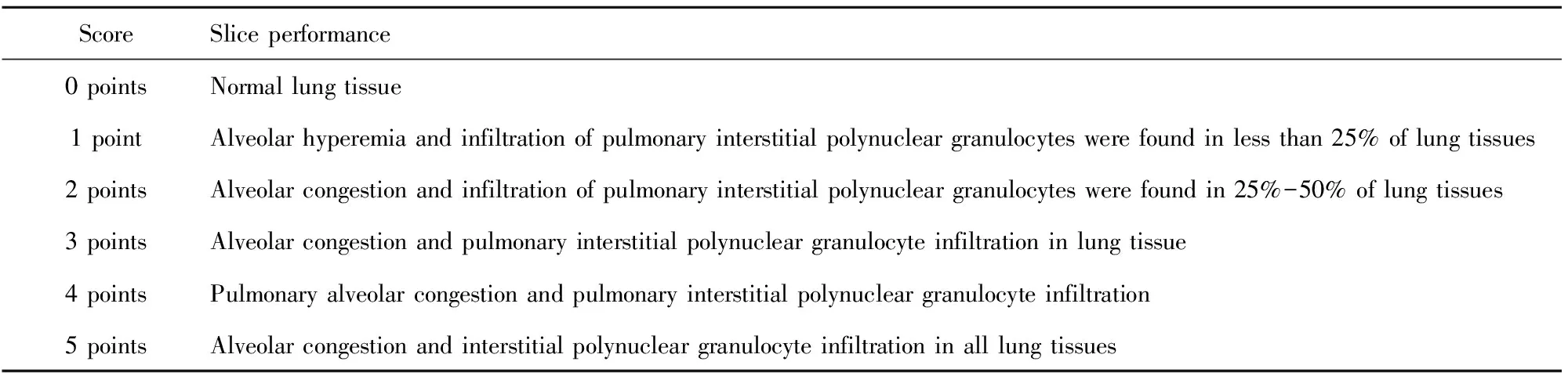
ScoreSlice performance0 pointsNormal lung tissue1 pointAlveolar hyperemia and infiltration of pulmonary interstitial polynuclear granulocytes were found in less than 25% of lung tissues2 pointsAlveolar congestion and infiltration of pulmonary interstitial polynuclear granulocytes were found in 25%-50% of lung tissues3 pointsAlveolar congestion and pulmonary interstitial polynuclear granulocyte infiltration in lung tissue4 pointsPulmonary alveolar congestion and pulmonary interstitial polynuclear granulocyte infiltration5 pointsAlveolar congestion and interstitial polynuclear granulocyte infiltration in all lung tissues
Western blot檢測甲狀腺轉錄因子1蛋白表達:取右中葉肺組織2 mg,PBS清洗后過篩研磨,提取總蛋白,配制電泳凝膠→配制buffer與蛋白混合樣,加樣→電泳→根據目的條帶的大小及marker所指示的具體位置問合適大小的PVDF膜,轉膜→放入含有封閉液的孵育盆中搖床孵育2 h→孵育一抗(兔抗鼠單克隆抗體甲狀腺轉錄因子1、β-actin)與二抗→發光顯影。
1.3統計學處理 采用SPSS22.0軟件進行單因素方差分析或雙因素方差分析,兩組間數據之間比較則使用Dunnett′t或Sidak′st檢驗完成。P<0.05時認為數據差異具有顯著性和統計學意義。
2 結果
2.1骨髓間充質干細胞的培養與鑒定 小鼠骨髓間充質干細胞接種24 h后開始貼壁,單個散在分布,細胞呈圓形;48 h后細胞伸出突起,呈梭形或三角形,4~6 d可見細胞集落;約14 d細胞生長融合達80%,胰酶消化后傳代培養,傳代后的細胞呈梭形,分布均勻,增殖較快(圖1A);成軟骨誘導分化14 d,甲苯胺藍染色可見大量藍色基質,提示細胞向軟骨細胞分化(圖1B);成骨誘導分化誘導21d后,茜素紅染色可見紅色的鈣化結節,提示細胞向成骨細胞分化(圖1C)。流式細胞儀檢測結果顯示,第3代骨髓間充質干細胞高表達CD90(94.2%)、CD29(93.1%)、CD147(86.3%)表面標志物,未表達CD34、CD45表面標志物,見圖2。
2.2肺組織病理觀察結果 HE染色顯示:正常組肺泡形態正常,肺泡間隔正常,無炎性水腫與滲出;模型組肺泡塌陷出血,肺泡間隔增厚,大量炎性細胞浸潤;細胞組、藥物組肺部結構破壞程度相較模型組明顯減輕,而細胞組與藥物組的病理變化差異不明顯;實驗組肺泡結構較藥物組、細胞組進一步改善,僅見少量炎性細胞浸潤(圖3)。
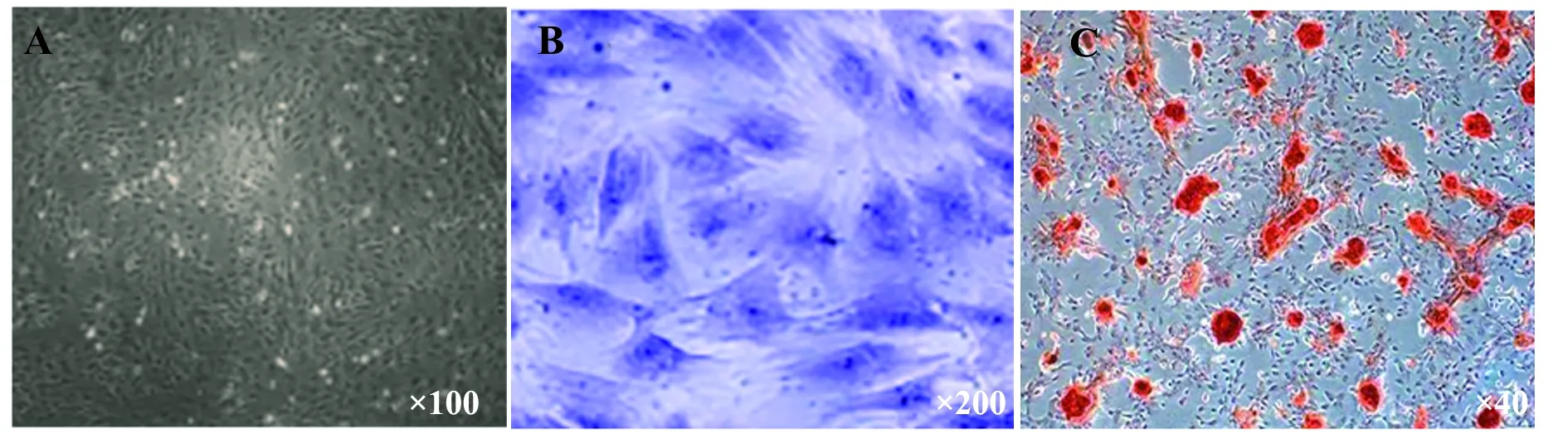
圖1 骨髓間充質干細胞的培養和成骨、成軟骨誘導分化Fig.1 Culture and differentiation of bone marrow mesenchymal stem cells into osteoblasts and cartilagesNote:A.B3rd generation bone marrow mesenchymal stem cells;B.Chondrogenesis induced differentiation,toluidine blue staining positive; C.Osteoinduction and differentiation,positive for Alizarin red staining.The 3rd generation bone marrow mesenchymal stem cells are spindle-shaped,uniformly distributed and proliferate rapidly,and can be induced to differentiate into chondrocytes and osteoblasts.

圖2 骨髓間充質干細胞的表面標志物檢測結果Fig.2 Detection results of surface markers of bone marrow mesenchymal stem cells
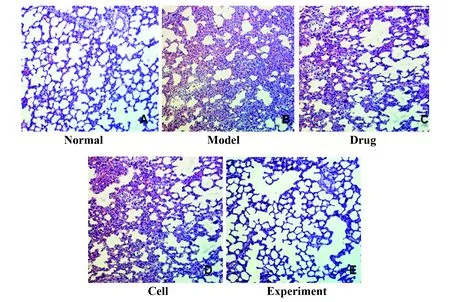
圖3 肺組織病理改變(HE,×200)Fig.3 Pathological changes of lung tissue(HE,×200)
表2 肺組織細胞凋亡率與濕干質量比
Tab.2 Apoptotic rate and wet-dry mass ratio of lung tissue

GroupsApoptotic rate(%)Wet-dry mass ratioNormal4.32±0.123.62±0.18 Model46.37±3.261)4.52±0.131)Cell31.08±3.172)4.21±0.142)Drug33.55±2.782)4.19±0.162)Experiment10.87±2.152)3) 3.98±0.232)3)
Note:Statistical data were obtained from 10 mice in each group.Compared with normal group,1)P<0.05;compared with model group,2)P<0.05;compared with cell group and drug group,3)P<0.05.
正常組、模型組、藥物組、細胞組與實驗組的病理組織評分分別為0.18±0.08、4.79±0.15、3.46±0.16、3.49±0.12、2.26±0.15,模型組評分高于正常組,藥物組、細胞組與實驗組評分低于模型組,實驗組評分低于藥物組、細胞組,差異均有統計學意義;細胞組與藥物組之間無差異。
2.3肺組織濕干質量比結果 正常組、模型組、細胞組、藥物組、實驗組肺組織濕干質量比分別為3.62±0.18、4.52±0.13、4.21±0.14、4.19±0.16、3.98±0.23。模型組與正常組比較差異顯著,細胞組、藥物組、實驗組與模型組比較差異顯著,實驗組與細胞組、藥物組比較差異顯著(表2)。
2.4肺組織細胞凋亡結果 Tunel染色顯示,正常組僅見極少量凋亡細胞,模型組可見大量凋亡細胞,藥物組與細胞組凋亡細胞數較模型組明顯減少,細胞組與藥物組凋亡細胞差異不明顯,實驗組凋亡細胞較細胞組、藥物組進一步減少,見圖4和表2。
2.5炎性細胞因子檢測結果 同正常組對比,模型組TNF-α、IL-1β、IL-6濃度顯著升高(P<0.05);經過骨髓間充質干細胞或利拉魯肽治療后,細胞組、藥物組、實驗組TNF-α、IL-1β、IL-6濃度均較模型組顯著降低(P<0.05),并且實驗組TNF-α、IL-1β、IL-6濃度低于細胞組、藥物組(P<0.05),具體數據見表3。
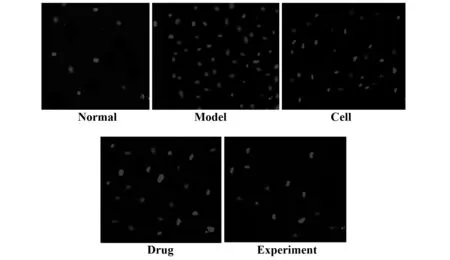
圖4 肺組織細胞凋亡情況(Tunel染色,×200)Fig.4 Apoptosis of lung tissue(Tunel staining,×200)
表3 各組小鼠肺組織支氣管肺泡灌洗液中炎性因子的比較(ng/L)
Tab.3 Comparison of inflammatory factors in broncho-alveolar lavage fluid of lung tissue in mice of each group(ng/L)

GroupsTNF-αIL-1βIL-6Normal17.21±3.1616.23±3.6327.63±6.48Model548.17±41.381)43.28±4.111)466.94±25.781)Cell214.15±36.882)32.09±3.662)325.31±45.252)Drug223.29±40.152)31.21±2.992)338.17±42.192)Experiment152.94±26.552)3)23.09±3.452)3)159.38±36.872)3)
Note:Statistical data were obtained from 10 mice in each group.Compared with normal group,1)P<0.05;compared with model group,2)P<0.05;compared with cell group and drug group,3)P<0.05.
2.6甲狀腺轉錄因子1基因與蛋白表達結果 RT-PCR檢測顯示:模型組甲狀腺轉錄因子1基因表達低于正常組(P<0.05),細胞組、藥物組、實驗組甲狀腺轉錄因子1基因表達高于模型組,同時實驗組甲狀腺轉錄因子1基因表達高于細胞組與藥物組(P<0.05),見圖5;Western blot檢測顯示:模型組甲狀腺轉錄因子1蛋白表達低于正常組(P<0.05),細胞組、藥物組、實驗組甲狀腺轉錄因子1蛋白表達高于模型組,同時實驗組甲狀腺轉錄因子1蛋白表達高于細胞組與藥物組(P<0.05),見圖6。

圖5 肺組織甲狀腺轉錄因子1基因表達Fig.5 Thyroid transcription factor 1 gene expression in lung tissue

圖6 肺組織甲狀腺轉錄因子1蛋白表達Fig.6 Thyroid transcription factor 1 protein expression in lung tissueNote:Statistical data were obtained from 10 mice in each group.Compared with normal group,*.P PP
3 討論
胰高糖素樣肽1為主要由腸道內L細胞合成和分泌的腸肽類激素,具有調節糖脂代謝、細胞分化和調控炎癥反應等眾多生物活性,已被用于臨床治療2型糖尿病[14-16],并且動物實驗顯示其對急性肺損傷具有保護作用。因此,實驗通過脂多糖制作的經典動物急性肺損傷模型,觀察人胰高糖素樣肽1類似物利拉魯肽與間充質干細胞移植治療急性肺損傷的效果。實驗采用氣管滴注脂多糖建立急性肺損傷模型后,反映肺水腫的肺組織濕干質量比明顯高于正常組,提示肺毛細血管滲漏;肺泡灌洗液中TNF-α、IL-1β、IL-6等炎性因子濃度顯著升高;肺部組織病理切片顯示肺泡結構異常,肺泡間隔增厚,肺間質水腫,大量炎性細胞浸潤等表現,證實本研究造模成功。
脂多糖可誘導包括TNF-α、IL-1β和IL-6在內的多種促炎性因子的釋放,參與急性肺損傷的發生與發展[17-19]。研究證實[13,20-21],利拉魯肽與骨髓間充質干細胞均可有效抑制急性肺損傷炎性因子濃度,發揮肺保護作用。本研究結果顯示,經利拉魯肽或骨髓間充質干細胞治療后,急性肺損傷小鼠的TNF-α、IL-1β和IL-6濃度明顯下降,與以往研究結果一致;同時發現經利拉魯肽與骨髓間充質干細胞聯合治療后,各炎性因子濃度進一步降低,提示將二者聯合應用的抗炎作用更明顯。
肺泡毛細血管屏障功能障礙是急性肺損傷的重要特征性表現,可使用肺組織濕干質量比來評價肺泡毛細血管屏障功能[22,23]。本研究顯示造模后,小鼠肺組織濕干質量比發生了較大變化,但是經過利拉魯肽或骨髓間充質干細胞治療后,肺組織濕干質量比明顯降低,同時二者聯合治療的降低效果更顯著。同時實驗發現造模小鼠肺組織的凋亡細胞數量明顯增多,但是經過利拉魯肽或骨髓間充質干細胞治療可抑制肺組織細胞凋亡,二者聯合的抑制效果更明顯。進一步的病理觀察同樣證實利拉魯肽或骨髓間充質干細胞可用于治療急性肺損傷,而二者聯合應用的效果優于單一治療方案。
盡管研究已證實利拉魯肽或骨髓間充質干細胞對急性肺損傷具有保護作用,但其作用機制仍不是很明確。早在2005年,李海東等[24]利用免疫組化和RT-PCR檢測內毒素誘導急性肺損傷大鼠肺組織中甲狀腺轉錄因子1、肺表面活性物質相關蛋白A的表達變化,發現肺組織甲狀腺轉錄因子1表達明顯降低,可能與急性肺損傷發生、發展有關。甲狀腺轉錄因子1是一種屬于NKX2.1同源轉錄因子家族的細胞核蛋白,在肺組織中有表達,在肺的發育和成熟過程中具有重要作用[25,26]。實驗對肺組織的甲狀腺轉錄因子1表達進行了檢測,結果顯示急性肺損傷后,甲狀腺轉錄因子1表達發生變化,明顯降低,證實甲狀腺轉錄因子1參與了急性肺損傷的發生與發展;經過利拉魯肽或骨髓間充質干細胞治療后,肺組織甲狀腺轉錄因子1表達明顯回升,提示利拉魯肽與骨髓間充質干細胞可促進肺組織甲狀腺轉錄因子1的轉錄與合成。通過肺組織病理證實,利拉魯肽與骨髓間充質干細胞治療急性肺損傷均具有較好的效果,二者可通過抑制細胞凋亡、減輕炎癥反應、降低肺水腫程度來發揮肺保護作用,并且二者聯合應用具有協同作用,可更好的發揮肺保護作用。
綜上,利拉魯肽聯合骨髓間充質干細胞移植治療急性肺損傷的效果優于單一治療方式,并且其肺保護作用可能與甲狀腺轉錄因子1有關。后續研究將進一步觀察利拉魯肽與骨髓間充質干細胞調控甲狀腺轉錄因子1的分子機制。

