骨髓調節性T細胞在腦梗死患者的表達及與預后的相關性研究①
王 浩 張天宇 滕艷萍 鄭宵陽 許德超
(齊齊哈爾醫學院附屬第二醫院神經內科,齊齊哈爾 161000)
根據世界衛生組織報告腦梗死已經成為全世界死亡的第二位原因,且全世界至少有1/6患者遭受一次腦梗死[1]。近年來,隨著現代科技的不斷發展,雖然腦梗死死亡率得到下降,但是其發病率呈上升趨勢,成為人類功能障礙的主要原因[2]。臨床上,根據腦梗死發病機制分為腦血栓形成、腔隙性腦梗死與腦栓塞三種不同類型,且發病早期以腦實質損傷為主,而后期以肺部感染為主,不僅會增加蛀牙時間,亦可增加臨床死亡率[3]。因此,積極尋找、開發新的治療靶點對改善腦梗死患者預后具有重要意義。臨床研究表明:腦梗死能引起神經元死亡,導致小膠質細胞活化,造成機體免疫系統發生變化,并且上述變化又能影響腦實質及機體氣體細胞的變化[4]。對于正常人而言,免疫系統主要由骨髓、胸腺中樞免疫器官和脾臟、淋巴結等外周器官組成[5]。而脾臟是最大的免疫器官,當腦梗死發生后則能激活脾臟內淋巴細胞,促使其遷移到外周及梗死病灶周圍,分泌大量的炎癥介質,進一步擴大梗死體積,影響神經功能的發揮[6]。因此,切除脾臟有助于改善腦梗死患者神經缺損癥狀,最大限度保護腦功能,但是尚需進一步驗證[7]。
骨髓是所有免疫細胞分化、發育的重要場所,亦是造血干細胞、調節性T細胞、內皮祖細胞的“倉庫”[8]。腦梗死發生后,骨髓中CD4+、CD8+T細胞水平將會升高,但是腦梗死后72 h骨髓中B細胞數量則會下降。同時,骨髓能通過生成、釋放上述細胞成分參與腦梗死的發生、發展。調節性T細胞是骨髓細胞的重要組成部分,占骨髓CD4+細胞的1/3,其比例為所有淋巴器官最高者[9]。臨床研究表明[10]:調節性T細胞與其他T淋巴細胞相比其特異性蛋白為叉頭樣轉錄因子3(FoxP3),其表達水平決定了Treg的免疫能力,且骨髓中Treg細胞表達FoxP3水平為外周血Treg細胞的兩倍。由此看出骨髓調節性T細胞從數量、功能對機體免疫系統的維持均具有重要意義。但是,骨髓調節性T細胞在腦梗死患者中的表達與預后的相關性研究較少[11]。因此,本文采用隨機對照方法進行研究,探討骨髓調節性T細胞在腦梗死患者中的表達及與預后的相關性,報道如下。
1 資料與方法
1.1資料
1.1.1臨床資料 選擇2017年5月~2018年3月附屬神經內科治療的腦梗死患者78例作為對象,設為觀察組,男45例,女33例,年齡41~78歲,平均(61.25±4.27)歲;發病時間1~12 h,平均(5.25±0.61)h。疾病嚴重程度:輕度24例,中度30例,重度24例。合并癥:高血壓35例,高血脂20例,糖尿病19例。選擇同期治療的骨髓穿刺者61例,設為對照組,男41例,女20例,年齡40~79歲,平均(60.77±4.21)歲。本研究獲得醫院倫理委員會批準,對患者及家屬進行常規宣教、簽署知情同意書,兩組臨床資料均無統計學意義(P>0.05)。
1.1.2納入及排除標準 納入標準:①均符合第四屆腦血管病會議制定的腦梗死診斷標準[12],均經頸部血管超聲檢查最終確診;②觀察組均符合阿托伐他汀藥物治療適應證,且患者均能耐受;③能遵醫囑完成有關檢查、診斷。排除標準:①合并其他心血管系統疾病、惡性腫瘤或病歷資料不全者;②近3個月使用其他方法治療或對本研究結果產生影響者;③合并凝血功能異常、精神異常或伴有自身免疫系統疾病者。
1.1.3儀器與設備 FACS Calibur型流式細胞儀(美國BD公司)、Ficoll分離液(天津市灝洋生物制品有限公司)、鼠抗人CD4-異硫氰酸熒光素(FITC)單克隆抗體、高速冷凍離心機(德國賽多利斯公司)、IL-10、TGF-β1酶聯免疫吸附試驗(美國羅氏生物科技有限公司)、酶標儀(瑞士梅特勒-托利多公司)、全自動生物化學分析儀、全自動血液分析(日本奧林巴斯有限公司)。
1.2方法
1.2.1骨髓調節性T細胞表達 ①標本采集。觀察組與對照組入院后均抽取骨髓抗凝血4 ml,2 ml抗凝血采用Ficoll分離液分離,獲得外周血單個核細胞(PBMC),調整細胞密度為2×109L-1,用于Treg細胞測定;取2 ml抗凝血,10 min離心,離心力1 638 g,血清分離后放置在-80℃冰箱中,備用[13]。②骨髓調節T淋巴細胞水平測定。采用流式細胞術(FCM)檢測兩組骨髓中Treg所占CD+T細胞數的百分比。取上述分離的骨髓標本,10 min離心,離心力1 453 g,去除上層清液,加入磷酸鹽緩沖液200 μl重懸細胞。在試管中分別加入鼠抗人CD4-FITC單抗、CD25-APC單抗與CD127-PE單抗。在同型對照管中加入同型對照抗體,常溫下避光孵育15 min;加入PBS 2 ml洗滌后10 min離心,離心力1 835 g,去除上層清液,利用PBS 500 μl完成細胞重懸,上機檢測[14]。③IL-10、TGF-β1水平測定。采用酶聯免疫吸附試驗(ELISA)完成兩組IL-10、TGF-β1濃度測定。取96孔板,設置標準品孔與待測樣品孔,取獲得的骨髓標本2 ml,放置在待測標本孔中,加入樣本稀釋液40 μl到50 μl,在標準品孔中加入不同濃度標準品50 μl;加入辣根過氧化物標記的抗體100 μl,37℃恒溫進行60 min孵育,洗板,去除過多的洗滌液,濾紙上拍干,連續重復5次,然后向每孔中加入底物A、B各50 μl,37℃恒溫進行15 min 孵育,最后向每孔中加入終止液50 μl終止反應,在酶標儀492 nm處完成吸光度值測定,繪制標準曲線,計算IL-10、TGF-β1水平[15,16]。
1.2.2治療及與預后的相關性 觀察組患者均給予常規方法治療,包括:脫水、改善循環、抗血小板、清除自由基等基礎治療;根據阿托伐他汀劑量分為高劑量組與低劑量組。高劑量組每次取阿托伐他汀片(北京嘉林藥業股份有限公司,國藥準字H20093819)40 mg,每晚口服1次,低劑量組每次取阿托伐他汀片20 mg,每晚1次,治療1個月后評估療效,完成患者骨髓調節性T細胞測定(檢測方法同上)[17]。
2 結果
2.1觀察組與對照組Treg細胞、IL-10、TGF-β1水平比較 觀察組腦梗死患者骨髓中Treg所占CD+T細胞數的百分比、IL-10及TGF-β1水平,均低于對照組(P<0.05),見表1。
2.2觀察組不同疾病嚴重程度Treg細胞、IL-10、TGF-β1水平比較 觀察組腦梗死患者中輕度患者骨髓中Treg所占CD+T細胞數的百分比、IL-10及TGF-β1水平,均高于中度與重度患者(P<0.05);中度患者骨髓中Treg所占CD+T細胞數的百分比、IL-10及TGF-β1水平,均高于重度患者(P<0.05),見表2。
2.3高劑量組與低劑量組Treg細胞、IL-10、TGF-β1水平比較 觀察組中高劑量組45例,低劑量組33例,高劑量組Treg細胞、IL-10、TGF-β1水平,均高于低劑量組(P<0.05),見表3。
2.4骨髓調節性T細胞與腦梗死患者預后相關性分析 腦梗死患者治療后進行6個月隨訪,23例患者死亡,55例患者取得良好預后。SPSS Pearson相關性分析結果表明:腦梗死患者治療預后與Treg細胞、IL-10、TGF-β1水平均呈正相關性(P<0.05),見表4、圖1。
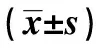

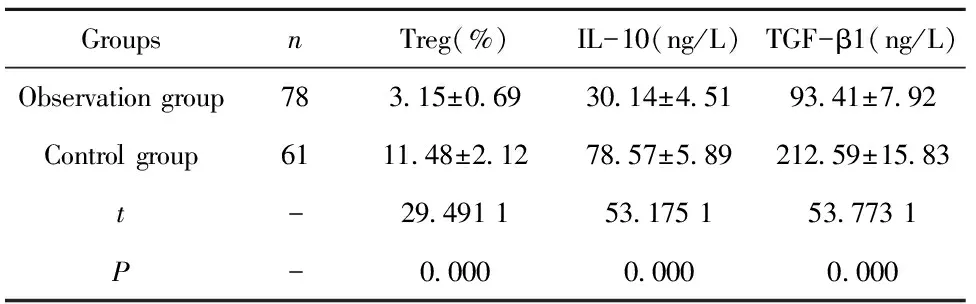
GroupsnTreg(%)IL-10(ng/L)TGF-β1(ng/L)Observation group783.15±0.6930.14±4.5193.41±7.92Control group6111.48±2.1278.57±5.89212.59±15.83t-29.491 153.175 153.773 1P-0.0000.0000.000
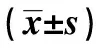
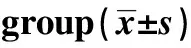
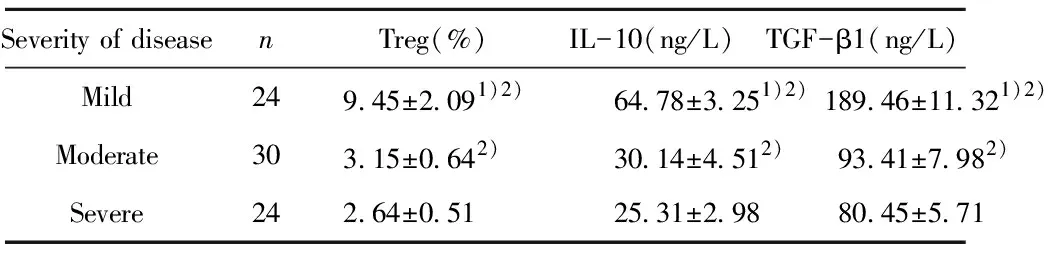
Severity of diseasenTreg(%)IL-10(ng/L)TGF-β1(ng/L)Mild249.45±2.091)2)64.78±3.251)2)189.46±11.321)2)Moderate303.15±0.642)30.14±4.512)93.41±7.982)Severe242.64±0.5125.31±2.9880.45±5.71
Note:Compared with severe patients,1)P<0.05;compared with moderate patients,2)P<0.05.

GroupsnTreg cells(%)IL-10(ng/L)TGF-β1(ng/L)High dose group4510.59±2.1569.42±3.51196.84±13.24Low dose group337.31±2.0145.63±2.16132.39±10.39t-6.912 636.922 024.074 7P-0.0000.0000.000
表4 骨髓調節性T細胞與腦梗死患者預后相關性分析(r,P)
Tab.4 Analysis of prognosis between bone marrow regulatory T cells and patients with cerebral infarction(r,P)
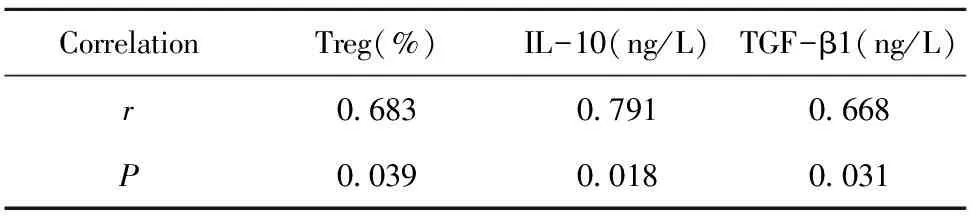
CorrelationTreg(%)IL-10(ng/L)TGF-β1(ng/L)r0.6830.7910.668P0.0390.0180.031

圖1 腦梗死治療預后與骨髓調節性T細胞相關性Fig.1 Correlation between prognosis of cerebral infarction and bone marrow regulatory T cells
3 討論
腦梗死是臨床上常見的心血管系統疾病,且根據其發病機制形成了多種學說:脂質浸潤學說、血管內血栓形成學說、慢性免疫炎癥反應損傷學說等[19]。目前,普遍認為腦梗死的發生、發展與炎癥介質、免疫水平等有關,能始終貫穿于腦梗死的全過程。臨床研究表明[20]:腦梗死能激活交感神經系統,促使支配骨髓的交感神經纖維增強,從而釋放大量的去鉀腎上腺素。同時,持續增加的去甲腎上腺素能直接作用于骨髓細胞表面,促進前列腺素2(PGE2)的表達與分泌;PGE2能刺激淋巴表面的EP4,可誘導淋巴細胞的分泌,造成樹突狀細胞表達水平升高,從而引起骨髓調節性T淋巴細胞水平下降[21]。本研究中,觀察組腦梗死患者骨髓中Treg所占CD+T細胞數的百分比、IL-10及TGF-β1水平,均低于對照組(P<0.05),說明骨髓調節性T淋巴細胞水平在腦梗死患者中呈低表達,能參與疾病的發生。對于正常人而言,骨髓位于骨骼腔內,占機體體重的4%~6%,屬于造血系統、免疫系統的重要組成部分,由造血干細胞、免疫細胞構成。當機體內環境發生變化(如發生腦梗死)時,骨髓可以通過調控造血干細胞分化直接參與外周免疫的調控,從而對外周免疫反應產生影響。同時,骨髓亦可以釋放骨髓內NK細胞、單核細胞及Treg等細胞直接參與外周免疫的調控,且上述免疫既可以是機體固有免疫,亦可以為適應性免疫反應。本研究中,觀察組腦梗死患者中輕度患者骨髓中Treg所占CD+T細胞數的百分比、IL-10及TGF-β1水平,均高于中度與重度患者(P<0.05);中度患者骨髓中Treg所占CD+T細胞數的百分比、IL-10及TGF-β1水平,均高于重度患者(P<0.05),說明骨髓調節性T細胞能反應患者的疾病嚴重程度,直接參與疾病發展。骨髓調節性T細胞是人體重要的免疫抑制細胞,能抑制免疫細胞的增殖與分泌功能,避免適應性免疫的過度分化。國外學者研究了腦梗死對于骨髓調節性T細胞數量的影響,結果表明腦梗死患者發病1 d后骨髓調節性T細胞數量明顯減少,與本研究結果相符,進一步明確了腦梗死對于免疫系統的影響。
急性腦梗死是由于各種原因引起腦部血液循環障礙,腦部血流急劇減少,腦組織發生缺血、缺氧性病變,從而產生相應的神經功能缺損。急性腦梗死病因復雜,而腦梗死后腦損傷是造成患者疾病加重的主要原因。本研究中,以阿托伐他汀作為治療藥物,分析不同劑量阿托伐他汀治療急性腦梗死患者預后,結果表明:觀察組中高劑量組45例,低劑量組33例,高劑量組Treg細胞、IL-10、TGF-β1水平,均高于低劑量組(P<0.05),說明阿托伐他汀用于急性腦梗死患者中能獲得良好的治療效果,且患者預后與阿托伐他汀呈劑量依賴性。阿托伐他汀屬于羥甲基戊二酰酶A還原酶抑制劑,屬于臨床常用的調脂制劑,能抑制TC的合成。現代藥理結果表明腦梗死患者給予阿托伐他汀類藥物有助于改善腦卒中結局,能改善腦梗死結局,降低死亡率。臨床研究表明阿托伐他汀具有抗動脈粥樣硬化,改善腦梗死患者結局,發揮抗炎、免疫調節活性作用。同時,阿托伐他汀能抑制Th1表達,促進Th2表達,糾正急性腦梗死患者Th17/Treg失衡。國外學者臨床研究表明腦梗死患者給予阿托伐他汀治療后免疫水平得到明顯改善,且高劑量阿托伐他汀治療效果更加,能提高Treg頻率,糾正機體Th17/Treg失衡,且該效應在腦梗死早期產生。臨床研究表明:阿托伐他汀屬于是一種HMG-CoA還原酶選擇性、競爭性抑制劑,能降低血漿膽固醇、脂蛋白水平,亦可增加肝臟細胞表面的LDL受體,提高低密度脂蛋白的攝取、分解。為了進一步分析骨髓調節性T細胞與腦梗死患者治療預后,本研究中對二者進行相關性分析,結果表明:腦梗死患者治療后進行6個月隨訪,23例患者死亡,55例患者取得良好預后。SPSS Pearson相關性分析結果表明腦梗死患者預后與Treg細胞、IL-10、TGF-β1水平均呈正相關性(P<0.05),由此看出阿托伐他汀用于腦梗死患者中能獲得良好的治療預后,且與骨髓調節性T細胞存在明顯的相關性。因此,腦梗死患者治療過程中加強骨髓調節性T細胞水平測定能評估患者預后,治療時可加強患者骨髓調節性T細胞測定結果調整治療方案,使得患者的治療更具科學性。
綜上所述,骨髓調節性T細胞在腦梗死患者中呈低表達,能參與疾病發展,且與預后呈正相關性,給予高劑量阿托伐他汀有助于改善患者預后,調節骨髓調節性T細胞水平。但是,本研究中亦存在諸多局限性,一方面實驗中納入病例數相對較少,需要大樣本量進一步驗證;另一方面對患者完成數據統計、分析時,存在較大的人為誤差,均需要進一步分析與研究。

