機械加載改善高脂飲食誘導的肥胖相關骨丟失
王珂雨,李心樂,2,劉大全,2,張平,2,3△
肥胖作為一種全身性代謝疾病,肥胖及其相關的代謝后遺癥發病率在全球范圍內逐年增加[1-2]。骨髓中的脂肪組織對骨骼發育產生負面影響,肥胖個體中骨折風險明顯增加,這挑戰了傳統的脂肪量對骨骼健康起到保護作用的觀點[3]。脂肪細胞主要由骨髓間充質干細胞產生,其與成骨細胞的關系比其他來源的間充質細胞更緊密[4]。且有證據表明,間充質干細胞向脂肪細胞分化的增強是導致骨質疏松的原因之一[5]。
由于肥胖的患病率逐年增加,且其并發癥日趨增多,但傳統的治療方法并不能取得令人滿意的療效[6-7]。大多數患者服用雙膦酸鹽(一種用于治療骨質疏松癥的藥物)來治療肥胖引起的骨質流失[8],但長期使用會增加股骨骨折的發生率[9]。目前還沒有針對肥胖相關的骨代謝疾病的有效治療方法。機械加載是一種低頻率、強度小、作用于膝關節等滑膜關節的溫和機械刺激,能模擬人體主動運動,從而影響骨骼內部相關合成代謝反應的物理治療手段。本課題組前期研究顯示,對膝關節進行機械加載可以促進股骨頸和脛骨的創傷愈合[10-11],還能夠促進血管重構和骨重建[12],但有關機械加載對肥胖導致的骨量丟失的影響尚不清楚。本研究通過建立肥胖性骨質流失的動物模型,探討機械加載對肥胖引起的骨丟失的修復作用,并且初步探究其潛在機制。
1 材料與方法
1.1 材料
1.1.1 實驗動物 45 只 SPF 級 C57BL/6 雌性小鼠(14 周齡,體質量18~20 g)購自中國人民解放軍軍事醫學科學院實驗動物中心,實驗飼料選用含脂量為60%的高脂飼料,購自北京華阜康生物科技有限公司。小鼠飼養于室溫(22±2)℃,濕度(55±5)%,明暗交替12 h 的環境中,整個實驗過程中自由攝取食物和水。本實驗獲天津醫科大學倫理委員會批準,符合實驗動物倫理學的相關規定,動物飼養嚴格遵循天津醫科大學實驗動物管理規定。
1.1.2 主要試劑及儀器 蘇木素-伊紅(HE)染色劑購自北京索萊寶公司,MacNeal's染色劑購自美國Polysciences公司。堿性磷酸酶(ALP)購自中國Proteintech 公司,Runt 相關轉錄因子2(RUNX2)、過氧化物酶體增殖物激活受體γ(PPARγ)和CCAAT/增強子結合蛋白α(C/EBPα)購自美國Cell Signaling Technology 公司,β-肌動蛋白(β-actin)購自美國Sigma 公司。體成分分析儀購自澳大利亞ImpediVet 公司,VMR型小動物麻醉機購自美國MATRX 公司,石蠟切片機購自德國Leica公司,光學顯微鏡購自日本OLYMPUS公司。本課題組自主研發的機械加載治療儀器(中國發明專利號:201610779975.8)。
1.2 方法
1.2.1 動物分組 將45只C57BL/6小鼠隨機分成3組,為正常飲食對照(Sham 組)、高脂飲食(HF 組)和高脂飲食加載治療(HF+L組),每組各15只。在研究初期,各組小鼠的體質量差異無統計學意義。Sham 組給予正常飲食,HF 組和HF+L組給予含脂量為60%的高脂飲食且持續8周。
1.2.2 機械加載 經4 周高脂誘導后1.5%異氟烷吸入麻醉HF+L組小鼠,將小鼠膝關節外側、內側放于加載螺旋桿和定子之間,調節螺旋,保證關節部位松緊適宜(可觸及到小鼠踝關節動脈跳動)后進行機械加載(圖1)。加載條件為1 N,10 Hz,單側膝關節加載3 min/d,雙側共6 min/d,每周連續加載5 d,共加載 4 周[13]。在加載治療的 4 周內,HF 組和 HF+L 組仍持續喂養高脂飲食,直至實驗結束。Sham組和HF組小鼠給予假的機械負荷,將膝關節置于加載儀上,但不接受任何刺激。
1.2.3 收集動物體質量、攝食量等數據 小鼠攝食量采用每5天測量并統計1次的方法。小鼠體質量的測量分別選在造模前檢測實驗基線水平和治療結束后。
1.2.4 體成分分析 在加載治療結束,小鼠處死前進行身體成分分析。測量質量、體長(鼻尖到肛門的長度),將儀器的探針按顏色對應安裝后,不同顏色探針按要求刺入特定的皮下位置。探針位置分布如下:紅色探針位于鼻尖,黃色探針位于雙耳連線中點,藍色探針位于肛門上方,黑色探針位于尾巴距離藍色探針1 cm(圖2),測量并記錄體脂含量、體質量指數(body mass index,BMI)等數據。
1.2.5 骨密度檢測 采用數字化雙能X 線骨密度儀對小鼠進行雙側股骨的骨密度檢測,檢測范圍為雙側股骨全長(即從髂骨髖臼窩上緣至股骨末端下緣),檢測指標為骨密度(bone mineral density,BMD)和骨礦物含量(bone mineral content,BMC)。BMD 和 BMC 的測量分別選在造模前和治療結束后檢測。計算上述指標的變化百分比:(治療結束后-造模前基線水平)/基線水平×100%。
1.2.6 組織學分析
1.2.6.1 組織處理 小鼠斷頸法處死后,將小鼠后腿的皮膚、肌肉及周圍韌帶剝離,保留完整股骨。10%中性福爾馬林溶液將股骨標本固定3 d,再經過3 周的搖床慢搖脫鈣(14%EDTA),再經過乙醇梯度脫水、二甲苯透明、過夜浸蠟后,最后使用石蠟包埋股骨標本,進行冠狀位組織切片,厚度為5 μm。
1.2.6.2 HE染色 股骨組織切片經二甲苯脫蠟、梯度乙醇水化后,HE 染色30 min,脫水、透明后,中性樹膠封片,光學顯微鏡下觀察股骨的組織學變化[14]。每張切片在40倍鏡下股骨遠端生長板下方面積為2 mm2的長方形區域,進行數據采集分析。在藍色區域(面積為2 mm2)內分別選取3 個100 倍視野,選取每組6 例標本。測量骨小梁面積(B.ar)和鏡下視野組織的總面積(T.ar),并計算骨小梁面積分數(B.ar/T.ar),以評估股骨的骨量流失[14]。測量股骨中脂肪細胞的數目(N.adipocytes),脂肪細胞面積(A.ar)和鏡下視野組織的總面積(T.ar),并計算單位面積脂肪細胞數目(N.adipocytes/T.ar)和脂肪細胞面積分數(A.ar/T.ar),以評估高脂飲食誘導的脂肪侵襲股骨情況[15]。使用Olympus CCD DP73軟件進行以上數據的測量。
1.2.6.3 MacNeal's染色 股骨組織切片經二甲苯脫蠟、梯度乙醇水化后,硝酸銀避光染色10 min,自來水沖洗3 min,Na2CO3-甲醛水溶液固定5 min,蒸餾水洗2 min,MacNeal's染色20 min,脫水、透明后樹膠封片,光學顯微鏡下觀察組織形態學改變,評估股骨中成骨細胞的數目。每張切片在股骨遠端生長板下方區域(同HE染色測量區域一致)分別選取3個400倍視野,選取每組6例標本,每組共18個視野。測量成骨細胞數目(N.Ob)和骨小梁長度(BM),并計算MacNeal's染色陽性細胞數(成骨細胞數)占骨小梁長度的比值(N.Ob/BM),評估股骨的成骨細胞活躍情況。
1.2.7 Western blot 檢測 ALP、RUNX2、C/EBPα 和 PPARγ 蛋白表達水平 每組分別取6 個股骨標本,在液氮冷凍狀態下置于研缽中研磨后加入RIPA 裂解液反應20 min,4 ℃、10 000 r/min 離心10 min,取上清液,測量蛋白濃度。每孔取 20 μg 蛋白行SDS-PAGE(恒壓120 V,2 h)。在4 ℃情況下,恒流350 mA 轉膜2 h。后使用5%脫脂牛奶封閉2 h,用 1×TBST 洗膜后,一抗 4 ℃過夜孵育(ALP:1∶2 000;RUNX2:1∶1 000;C/EBPα:1∶1 000;PPARγ:1∶1 000;βactin:1∶10 000),1×TBST 清洗5 次,二抗(1∶20 000)室溫孵育90 min,用凝膠成像系統經化學發光后檢測相關蛋白的表達[13]。
1.3 統計學方法 采用SPSS 20.0 統計軟件進行分析,實驗相關數據以均數±標準差()的形式表示,采用單因素方差分析(ANOVA)進行多組間均數比較,采用LSD-t檢驗進行組間多重比較。P<0.05為差異有統計學意義。
2 結果
2.1 機械加載對高脂飲食誘導小鼠的肥胖程度的影響 實驗表明,機械加載并未干擾小鼠攝食能力,3組小鼠攝食量之間差異無統計學意義。在體型方面,各組小鼠呈現顯著差異,其中HF 組體型較大,HF+L組與HF組相比較小,見圖3。HF組體質量、體脂含量以及BMI 較Sham 組明顯增加(均P<0.01),經機械加載治療后發現,HF+L組小鼠上述指標低于HF組,但仍然高于Sham組(均P<0.01),見表1。
Tab.1 The comparison of body weight,body fat content and BMI before sacrifice between three groups表1 各組小鼠的處死前體質量,體脂含量和BMI的比較(n=10,)

Tab.1 The comparison of body weight,body fat content and BMI before sacrifice between three groups表1 各組小鼠的處死前體質量,體脂含量和BMI的比較(n=10,)
**P<0.01;a與sham組比較,b與HF組比較,P<0.05
組別Sham組HF組HF+L組F攝食量(g/d)3.03±0.58 3.19±0.67a 3.10±0.68ab 0.250體質量(g)20.23±1.23 30.47±3.43a 22.78±2.20ab 46.949**體脂含量(%)20.84±1.45 29.70±1.75a 22.91±1.56ab 84.446**BMI(kg/cm2)5.49±0.28 7.44±0.71a 6.02±0.47ab 37.776**
2.2 機械加載對肥胖小鼠骨量影響 骨密度檢測結果表明,與Sham組小鼠相比,HF組小鼠的骨密度變化率和骨量變化率明顯下降(均P<0.05)。機械加載治療后,HF+L組小鼠的骨密度變化率和骨量變化率明顯升高,但仍然較Sham組下降(均P<0.05),見表2。
2.3 機械加載對肥胖小鼠股骨形態的影響 股骨組織HE 染色顯示,Sham 組小鼠骨髓腔生長板下方骨小梁分布均勻,HF組中生長板下方骨小梁數目和面積明顯減少,而HF+L 組骨小梁數目較多,形態分布較規則,見圖4。將骨小梁面積量化后結果表明,HF組骨小梁面積較Sham組明顯減少,HF+L組骨小梁面積較HF組顯著增加(P<0.05),見表3。
Tab.2 The comparison of bone mineral density change rates and bone mass change rates between three groups表2 各組小鼠的股骨密度變化率和骨量變化率的比較(n=10,)

Tab.2 The comparison of bone mineral density change rates and bone mass change rates between three groups表2 各組小鼠的股骨密度變化率和骨量變化率的比較(n=10,)
**P<0.01;a與sham組比較,b與HF組比較,P<0.05
組別Sham組HF組HF+L組F骨密度變化率(%)31.09±7.11 14.80±0.59a 21.72±0.65ab 23.428**骨量變化率(%)32.42±3.42 12.08±1.72a 20.38±1.14ab 118.277**
MacNeal's 組織學染色結果顯示,Sham 組小鼠骨髓腔中成骨細胞為淡藍色,呈立方型柱狀均勻分布在骨小梁邊緣;HF 組中成骨細胞數目明顯減少,而HF+L 組成骨細胞數目較HF 組多,形態較規則,見圖5。成骨細胞數目量化結果表明,HF 組的成骨細胞數目較Sham 組明顯減少(P<0.001),HF+L 組的成骨細胞數目較HF組顯著增加(P<0.001),但與Sham組相比差異無統計學意義,見表3。
2.4 機械加載對肥胖小鼠股骨中脂肪細胞的影響 HE 染色顯示,Sham 組小鼠股骨遠端生長板下方有少許白色類圓形的空泡樣脂肪細胞,HF組股骨遠端生長板下方出現大量白色類圓形的空泡樣脂肪細胞(圖4 所示),而HF+L 組中出現少量的脂肪細胞。對脂肪細胞進行量化處理后,與Sham 組相比,HF 組的脂肪細胞數目和脂肪細胞面積均顯著增加(P<0.05)。經過膝關節加載治療后,HF+L 組脂肪細胞數目和脂肪細胞面積均明顯減少(P<0.05)。見表4。
Tab.3 The comparison of the percentage of trabecular bone area,the number of osteoblasts per unit length and the expression levels of ALP and RUNX2 in the femur between three groups表3 各組小鼠的股骨中骨小梁面積百分比、單位長度內成骨細胞數目、ALP和RUNX2的表達量的比較(n=6,)
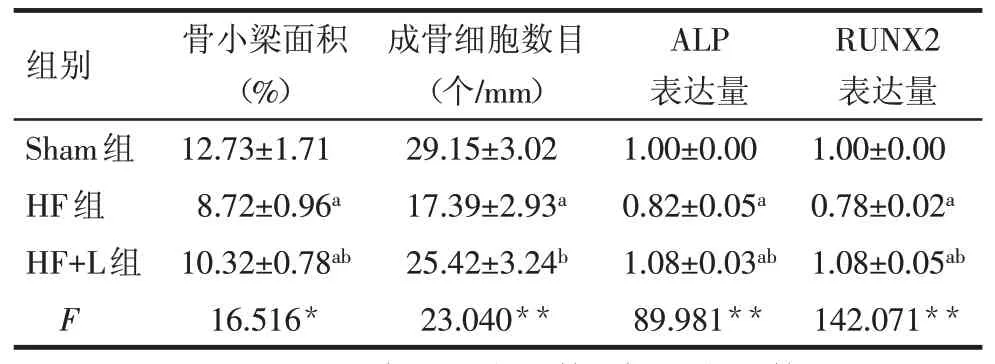
Tab.3 The comparison of the percentage of trabecular bone area,the number of osteoblasts per unit length and the expression levels of ALP and RUNX2 in the femur between three groups表3 各組小鼠的股骨中骨小梁面積百分比、單位長度內成骨細胞數目、ALP和RUNX2的表達量的比較(n=6,)
*P<0.05,**P<0.01;a與sham組比較,b與HF組比較,P<0.05
組別Sham組HF組HF+L組F骨小梁面積(%)12.73±1.71 8.72±0.96a 10.32±0.78ab 16.516*成骨細胞數目(個/mm)29.15±3.02 17.39±2.93a 25.42±3.24b 23.040**ALP表達量1.00±0.00 0.82±0.05a 1.08±0.03ab 89.981**RUNX2表達量1.00±0.00 0.78±0.02a 1.08±0.05ab 142.071**
2.5 機械加載對股骨中成骨生成相關蛋白和脂肪生成相關蛋白表達的影響 股骨組織蛋白檢測分析表明,與 Sham 組相比,HF 組中 ALP 和 RUNX2 的表達明顯降低,C/EBPα 和PPARγ 的表達顯著升高(均P<0.05)。而HF+L 組與 HF 組相比,ALP 和 RUNX2的表達顯著升高,C/EBPα 和PPARγ 的表達明顯降低(均P<0.05)。見表3、4,圖6。
3 討論
Tab.4 The comparison of the number of adipocytes per unit area,the percentage of adipocyte area and the expression levels of C/EBPα and PPARγ in femur between three groups表4 各組小鼠的股骨中單位面積內脂肪細胞數目、面積百分比,C/EBPα和PPARγ的表達量的比較(n=6,)
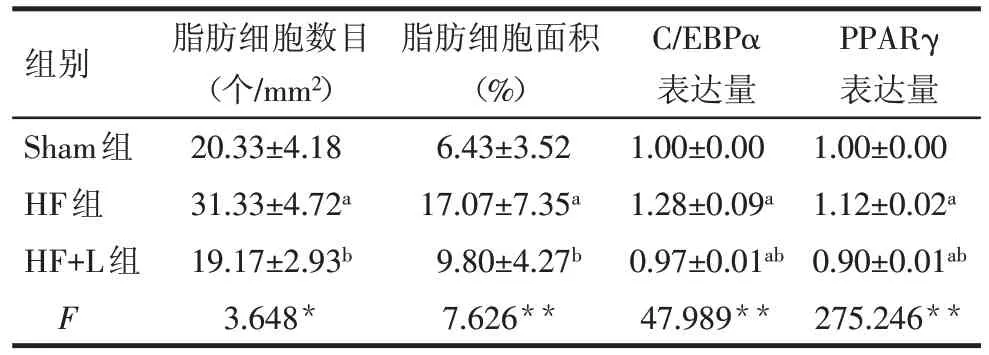
Tab.4 The comparison of the number of adipocytes per unit area,the percentage of adipocyte area and the expression levels of C/EBPα and PPARγ in femur between three groups表4 各組小鼠的股骨中單位面積內脂肪細胞數目、面積百分比,C/EBPα和PPARγ的表達量的比較(n=6,)
*P<0.05,**P<0.01;a與sham組比較,b與HF組比較,P<0.05
組別Sham組HF組HF+L組F脂肪細胞數目(個/mm2)20.33±4.18 31.33±4.72a 19.17±2.93b 3.648*脂肪細胞面積(%)6.43±3.52 17.07±7.35a 9.80±4.27b 7.626**C/EBPα表達量1.00±0.00 1.28±0.09a 0.97±0.01ab 47.989**PPARγ表達量1.00±0.00 1.12±0.02a 0.90±0.01ab 275.246**
3.1 機械加載治療對體質量和體脂的影響 營養過剩(高熱量飲食攝入)和荷爾蒙失調(絕經后雌激素缺乏)可能是肥胖癥及其并發癥的主要原因,而機體對于過剩的能量是以脂肪細胞的形式儲存[16-18]。過度的脂肪堆積是導致代謝性疾病的主要原因。運動是減輕體質量、改善肥胖的有效方式,同時可以改善心肺功能和提高生活質量[19]。但運動減重一般很難長期堅持,見效比較緩慢,而且有可能會造成軟組織損傷。因此,本研究探究了膝關節加載對肥胖的影響。首先小鼠經過8周的高脂飲食喂養建立了肥胖模型,HF 組的體質量、體脂含量和BMI 均顯著高于Sham組。而膝關節加載治療通過降低體質量、體脂含量和BMI,有效減緩了高脂飲食造成的肥胖的發生發展。這些結果顯示,關節機械加載為治療肥胖提供了一種新的物理康復手段。
3.2 機械加載治療對肥胖引起骨量流失的改善作用 肥胖的主要特征是大量脂肪組織的堆積,除了在內臟和皮下存儲中的積累外,脂肪對于骨骼的影響也是值得關注的。肥胖與骨穩態之間的關系十分密切,有證據表明,肥胖的人發生骨折的風險較高,提示脂肪組織可能會對骨骼產生負面影響[3]。本研究中,高脂飲食導致了股骨的骨量流失顯著增加(骨密度降低和骨量降低),而機械加載治療有效減少了肥胖小鼠的骨量流失,本研究結果與Hafner 等[20]研究結果相一致,該研究認為高脂飲食能夠誘導肥胖和脂肪組織炎癥,并導致骨質流失和骨髓脂肪堆積,對骨骼造成不良影響[20]。然而,膝關節加載治療通過改善骨小梁缺失和減少股骨內脂肪堆積來緩解肥胖引起的骨量流失。表明膝關節加載改善了肥胖相關的骨丟失,為治療肥胖引起的骨代謝異常提供了新的策略。
3.3 機械加載治療對成骨細胞和脂肪細胞的影響 由于骨髓脂肪組織的積累[21],肥胖引起的骨質疏松癥的特征是小梁骨中的骨髓脂肪增加和BMD降低[22]。骨髓中脂肪組織的增加可能與間充質干細胞向脂肪細胞和成骨細胞分化的失衡有關[5],其中間充質干細胞向成骨細胞的分化可以減輕骨質流失[23]。C/EBPα 和PPARγ 是脂肪分化的關鍵轉錄因子[24],而RUNX2作為調節成骨細胞生成基因的主要開關[24],ALP 則是一種與類骨素形成和礦化有關的糖蛋白[25]。同時,本研究結果也表明長期高脂飲食導致脂肪生成相關蛋白(C/EBPα 和PPARγ)的表達升高,成骨細胞生成相關蛋白(RUNX2和ALP)的表達降低。膝關節負荷抑制了C/EBPα和PPARγ的表達,并促進了RUNX2和ALP的表達。這些觀察結果表明,機械負荷通過抑制脂肪細胞生成并促進成骨細胞分化來改善肥胖引起的骨量流失。
3.4 不足與展望 隨著我國肥胖人口的逐年增加,肥胖引起的多種相關代謝性疾病也越來越多。傳統的藥物價格昂貴,而且會存在一定的不良反應。因此,找到一種安全有效的治療方式是目前所面臨的重大問題。本實驗表明,機械加載可作為一種新型的物理治療手段,通過促進成骨細胞生成和抑制脂肪細胞來改善高脂飲食引起的肥胖性骨流失,為機械加載對肥胖和肥胖性骨質流失的治療手段和臨床實踐提供了實驗參考。在未來的研究中,我們將進一步探究機械加載對肥胖相關骨丟失的潛在分子機制。

