沉默ECT2對食管癌EC109細胞增殖、細胞周期和裸鼠成瘤能力的影響
劉 翼 ,祝 琳
1)西南醫科大學附屬醫院消化內科 四川瀘州 646000 2)西南醫科大學附屬醫院耳鼻咽喉頭頸外科 四川瀘州 646000
上皮細胞轉化序列2(ECT2)是一種鳥嘌呤核苷酸交換因子,在細胞周期調控過程中發揮著重要作用,與細胞增殖關系密切。越來越多的研究[1-4]發現,ECT2在非小細胞肺癌、乳腺癌、前列腺癌和子宮漿液性乳頭狀癌等多種腫瘤中異常高表達,在腫瘤細胞的增殖、轉移和凋亡等生物學過程中發揮著重要的調控作用,是一個很有前景的腫瘤靶基因。盡管早期已有研究[5]發現,ECT2在食管癌組織中高表達,與患者的預后不良關系密切,發揮著促進食管癌細胞生長的作用,但其調控腫瘤細胞增殖的具體機制并不清楚,以ECT2為治療靶點的實驗依據還不夠充足。因此,本研究采用shRNA介導的RNAi技術沉默ECT2,觀察對食管癌細胞增殖和裸鼠成瘤能力的影響,旨在從細胞實驗和動物實驗探討ECT2調控食管癌細胞生長的分子機制。
1 材料與方法
1.1細胞與主要試劑EC109購于美國ATCC公司。BALB/c裸鼠33只(雌性,4~6周齡,體重23~25 g)購于上海斯萊克實驗動物公司。GV148-shRNA-ECT2及其無效對照shRNA-NC慢病毒由蘇州吉瑪基因股份有限公司制備,shRNA-ECT2干擾序列為5’-GGACAUUAAAGUGGGCUUUTT-3’,shRNA-NC序列為5’-AGUACUGCUUACGAUACGGTT-3’。胎牛血清、胰蛋白酶購于美國HyClone公司,RPMI 1640培養基購于美國Gibco公司,CyclinD1、CDK2、ECT2和β-actin抗體購于英國Abcam公司,P21抗體購于美國Cell Signal公司,P53抗體購于美國Santa Cruz公司。辣根過氧化物酶標記羊抗鼠IgG 二抗購于中國中杉金橋公司,Trizol總RNA抽提試劑購于美國Invitrogen公司。CCK-8試劑盒和細胞周期檢測試劑盒購于中國碧云天生物技術研究所,反轉錄試劑盒購于北京達科為生物公司,RT-PCR試劑盒購于日本TaKaRa公司,RIPA蛋白裂解液和BCA法蛋白定量試劑盒購于中國碧云天生物技術研究所,PVDF膜購于美國Millpore公司。
1.2細胞培養于體積分數50%CO2、飽和濕度和37 ℃的細胞培養箱中以含有體積分數10%胎牛血清的RPMI 1640培養基培養EC109細胞。當細胞幾乎鋪滿培養瓶底部時,用2.5 g/L胰蛋白酶消化傳代。收集生長狀態良好的EC109細胞進行后續實驗。
1.3細胞分組與慢病毒感染實驗分為對照組(未感染)、shRNA-NC組(感染shRNA-NC)和shRNA-ECT2組(感染shRNA-ECT2)。收集對數生長期的EC109細胞,胰蛋白酶消化制成濃度為2.5×106個/mL的細胞懸液。按照每孔500 μL細胞懸液平鋪于6孔細胞板,置于細胞培養箱內培養過夜。棄原液后,向細胞中加入900 μL培養基、5 ng Polybrene和2×106TU慢病毒,感染48 h后,加入2 mg/L嘌呤霉素(篩選穩定轉染的細胞)繼續培養48 h后,收集細胞。
1.4RT-PCR檢測ECT2mRNA的表達收集各組EC109細胞,加入Trizol總RNA抽提試劑提取總RNA。反轉錄合成cDNA,將cDNA作為模板,進行PCR擴增。20 μL總反應體系:2 μL cDNA、10 μL 2×SYBR Premix Ex Taq、上下游引物各0.4 μL、0.4 μL 50×ROX Reference Dye Ⅱ和6.8 μL ddH2O。反應條件:95 ℃預變性30 s;95 ℃變性5 s 、62 ℃30 s,循環40次。由上海生工生物合成的ECT2引物上游:5’-GCCTTGCTTGTGAGGCCACCAA-3’,下游:5’-TCCACTGAGCCGTGGGATGTCA-3’;β-actin引物上游:5’-GGACCTGACTGACTACCTC-3’,下游:5’-TACTCCTGCTTGCTGAT-3’。以β-actin為內參,2-ΔΔCt法計算ECT2 mRNA的相對表達水平。
1.5CCK-8法檢測細胞增殖收集各組EC109細胞,以每孔200 μL細胞懸液(濃度為2×104個/mL)接種于96孔細胞板,每組設4個復孔,另設一個空白調零孔(只加入等體積的培養基),于培養箱內培養。培養至72和96 h后,加入10 μL CCK-8溶液常溫反應2 h,采用酶標儀檢測490 nm處的光密度(OD)值。實驗重復3次。
1.6細胞周期檢測收集各組EC109細胞,磷酸鹽緩沖液洗滌后,胰蛋白酶消化制成濃度為2×104個/mL的細胞懸液,采用預冷的體積分數70%乙醇對細胞進行固定。以碘化丙啶染色后,上流式細胞儀進行檢測。實驗重復3次。
1.7裸鼠移植瘤實驗收集各組細胞,制成濃度為1×106個/mL的細胞懸液。將33只雌性裸鼠隨機分為3組,每組11只,分別將對照組、shRNA-NC組和shRNA-ECT2組細胞以每只0.5 mL注入裸鼠右后肢皮下。接種完畢后,將裸鼠放入SPF級動物房中飼養,觀察成瘤情況。接種30 d后處死裸鼠,剝落移植瘤稱重,并以精確到0.02 mm的游標卡尺測量腫瘤的長徑和短徑,腫瘤體積=長徑×短徑2/2。取部分移植瘤組織,用于P21和P53蛋白的Western blot檢測。
1.8目的蛋白的Western blot檢測收集待測的EC109細胞和移植瘤組織,加入RIPA細胞裂解液于冰上裂解30 min提取總蛋白。按照BCA蛋白檢測試劑盒說明書步驟測定總蛋白的濃度。將蛋白樣品80 μg加入到120 g/L SDS-PAGE凝膠泳道孔中。電泳分離結束后,電轉膜至PVDF膜上。將膜放入含50 g/L脫脂奶粉的封閉液中封閉1 h。加入以封閉液1∶1 000稀釋的一抗(CDK2、CylinD1、ECT2、P21和P53)4 ℃孵育過夜。用1×TBST溶液洗膜10 min,3次后,加入封閉液1∶2 000稀釋的二抗,常溫孵育2 h。洗膜后加入化學發光劑。避光反應5 min,凝膠成像儀掃描拍照,Quantity One軟件分析條帶灰度值,以目的條帶灰度值與內參β-actin條帶灰度值的比值表示目的蛋白的相對表達水平。實驗重復3次。
1.9統計學處理采用SPSS 22.0分析,各組EC109細胞ECT2、CyclinD1、CDK2的表達和增殖活力,移植瘤體積、瘤體質量以及組織中P21和P53蛋白表達的比較使用單因素方差分析和SNK-q檢驗。檢驗水準α=0.05。
2 結果
2.1 3組EC109細胞中ECT2的表達與對照組相比,shRNA-ECT2組細胞中ECT2蛋白和mRNA的表達水平明顯降低,結果見圖1和表1。

1:對照組;2:shRNA-NC組;3:shRNA-ECT2組

表1 3組EC109細胞中ECT2蛋白和mRNA的表達(n=3)
*:與對照組和shRNA-NC組比較,P<0.05
2.2 3組EC109細胞增殖活力和細胞周期與對照組和shRNA-NC組比較,shRNA-ECT2組細胞的增殖活力明顯降低,G0/G1期細胞百分比明顯升高,而S期細胞百分比降低,結果見表2。

表2 3組EC109細胞增殖活力和細胞周期的比較(n=3)
*:與對照組和shRNA-NC組比較,P<0.05
2.3 3組EC109細胞中CyclinD1和CDK2蛋白的表達shRNA-ECT2組細胞中CyclinD1和CDK2蛋白的表達水平較對照組和shRNA-NC組明顯降低,結果見圖2和表3。

1:對照組;2:shRNA-NC組;3:shRNA-ECT2組

表3 3組EC109細胞中CyclinD1和CDK2蛋白的表達(n=3)
*:與對照組和shRNA-NC組比較,P<0.05
2.4 3組細胞體內成瘤能力的比較接種3~7 d對照組和shRNA-NC組裸鼠均有肉眼可見的瘤體生成,在接種部位出現了逐漸變大的皮下小結節;而shRNA-ECT2組中僅有4只裸鼠瘤體生成,成瘤時間較對照組明顯推遲了12 d。shRNA-ECT2組中瘤體體積和瘤體質量均明顯減小,結果見表4。
2.5 3組裸鼠移植瘤組織中P21和P53蛋白的表達與對照組和shRNA-NC組相比,shRNA-ECT2組移植瘤組織中P21和P53蛋白的表達水平均明顯升高,見圖3和表5。

表4 3組細胞體內成瘤能力的比較
*:與對照組和shRNA-NC組比較,P<0.05
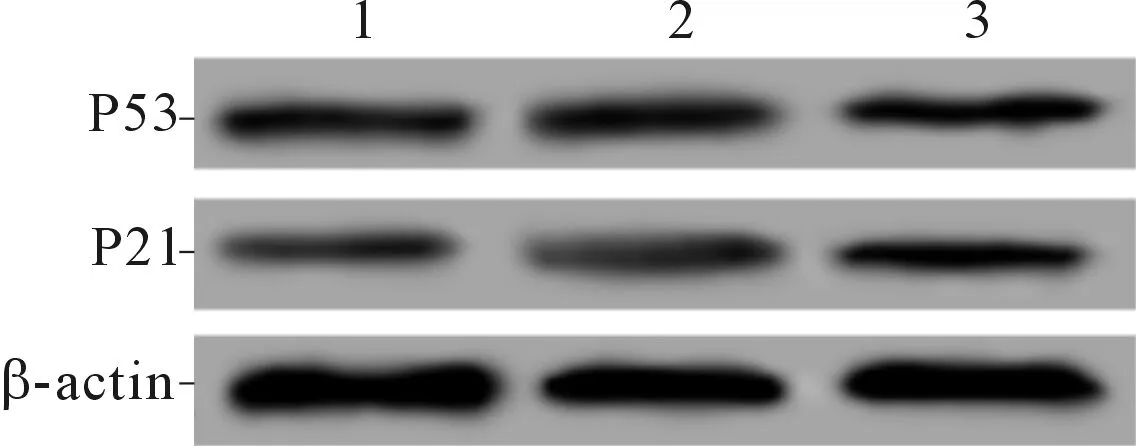
1:對照組 ;2:shRNA-NC組;3:shRNA-ECT2組

表5 3組裸鼠移植瘤組織中P21和P53蛋白的表達水平
*:與對照組和shRNA-NC組比較,P<0.05
3 討論
近年來食管癌的發病率有明顯升高的趨勢,嚴重威脅著人們的身體健康[6-7]。食管癌細胞的惡性增殖是食管癌發生的重要基礎,而此過程受到多種癌基因和抑癌基因的共同調控。深入探討食管癌細胞增殖的調控機制,尋找能夠抑制癌細胞增殖的有效靶點是治療食管癌的重要策略。ECT2被認為是一種重要的癌基因,能夠促進腫瘤細胞的增殖、侵襲和遷移,與腫瘤的發生發展關系密切。ECT2在非小細胞肺癌組織中高表達,被認為是導致總體生存不良和復發的重要因素[8]。ECT2表達上調與肝癌早期復發和預后不良關系密切,敲除該基因可通過抑制Rho/ERK信號通路降低CyclinE/CDK2/Rb的活化,激活P53途徑,抑制腫瘤細胞的增殖和轉移,還能夠在體內減緩腫瘤的生長[9]。ECT2是miRNA-223的靶基因,下調其表達可誘導P21表達,改變CyclinD1-CDK復合物的活性,導致細胞周期G1期發生阻滯,影響骨肉瘤細胞周期進展和增殖[10]。此外,ECT2還在肺腺癌、結直腸癌和胃癌等腫瘤中異常高表達,被作為腫瘤診斷和預后評估的重要標志物[11-13]。
本研究通過慢病毒GV148-shRNA-ECT2感染,成功沉默食管癌EC109細胞中ECT2表達后發現,EC109細胞的增殖活力明顯減弱,這與Hirata等[5]早期發現下調ECT2表達可抑制食管癌TE9細胞增殖的結果相吻合。同時,本研究還發現沉默ECT2表達可使細胞周期阻滯于G0/G1期;進一步檢測發現,在ECT2沉默的EC109細胞中CyclinD1和CDK2蛋白表達受到抑制。另外,通過建立食管癌裸鼠移植瘤模型發現沉默ECT2表達能夠明顯抑制移植瘤的生長,上調移植瘤組織中P21和P53蛋白的表達。已有研究[14-15]證實,P21和P53在食管癌細胞增殖過程中發揮著重要作用。P21和P53均是細胞周期依賴性激酶抑制劑,可通過調控G1/S轉換的周期蛋白CyclinD1和CDK2的表達,使細胞周期阻滯于G1/G0期,進而抑制細胞增殖,發揮抗腫瘤作用[16-18]。本研究結果提示,沉默ECT2表達可通過促進P21、P53表達,進而下調CyclinD1、CDK2表達,影響細胞周期進展,抑制EC109細胞的增殖。
綜上所述,沉默ECT2可抑制食管癌EC109細胞增殖和裸鼠成瘤能力,其作用機制可能與促進P21和P53的表達有關。該結果進一步豐富了ECT2調控食管癌發生發展的分子機制,也為以ECT2為靶點的食管癌治療提供了新的實驗依據。

