殼聚糖改性的聚乳酸-羥基乙酸共聚物神經導管的制備、表征及其生物學性能
張仲寧,薛東鶴 ,張婉衡,張明生,鄭國強
1)鄭州大學第二附屬醫院骨科 鄭州 450014 2)鄭州大學材料科學與工程學院 鄭州 450001
周圍神經的損傷及缺損會導致患者肢體感覺及運動功能障礙,造成生活及勞動能力的下降[1]。目前,自體神經移植是臨床判斷神經修復效果的金標準[2],但是自體神經來源有限,且存在增加創傷、遺留供區感覺障礙、神經束支對合及匹配不佳等諸多缺點[3]。異體神經移植雖避免了供體的限制,但其引起的免疫排斥反應往往導致移植失敗、效果不確切等問題[4]。因此,對周圍神經損傷的治療仍是臨床工作的一大挑戰。隨著組織工程技術和新型材料的發展,用生物材料構建的神經導管被逐漸應用于修復周圍神經損傷,在神經修復領域有著廣闊的前景[5-6]。神經導管是模仿神經通路自然結構的一個縱向組織,作為軸突延伸的一個通道,引導再生神經與靶神經重新相連,而導管本身并不影響神經修復。將天然材料和合成材料相結合,制備兼具良好生物相容性、機械性能以及優異的生物降解性能的神經導管用于周圍神經損傷的修復已成為目前國內外研究的熱點。聚乳酸-羥基乙酸共聚物(PLGA)是聚乳酸(PLA)和聚羥基乙酸(PGA)的共聚物,已被FDA認證用于創傷縫合[7]。PLGA在力學性能和降解時間上都具有很大的優勢,可通過調整PLA和PGA的比例調控聚合物的強度和降解速度[7],使得PLGA成為神經修復領域中最具吸引力的材料。有研究[8-9]表明,細胞在材料表面的黏附、增殖、分化等一系列過程會受到材料表面的理化性質的影響,如材料表面的親/疏水性、拓撲結構和表面粗糙度等。因此組織工程材料和細胞應有良好的接觸界面,以維持細胞表型、生長、增殖和分化,并促進細胞特異性基因表達。在高聚物材料表面固定生物活性分子是改善材料親水性能的有效方式之一。殼聚糖是一種天然大分子,它具有優良的生物相容性和可降解性,并常常被用作表面改性的材料。本研究通過表面截留法利用殼聚糖改善PLGA材料親水性等性能,使其更好地用作神經修復支架。
1 材料與方法
1.1殼聚糖改性PLGA神經導管的制備將PLA∶PGA(體積比)不同比例的PLGA[分別為50∶50,65∶35,70∶30,75∶25和85∶15]加入二甲基甲酰胺(DMF)和四氫呋喃(THF)(體積比為1∶1)中溶解,配制成220 g/L的靜電紡絲溶液。把注入紡絲溶液的注射器固定在KH-2型靜電紡絲機(濟南良睿科技有限公司)注射泵上,流速設為2.4 mL/h,紡絲電壓調整為20 kV。接收裝置為帶有鋁箔的旋轉滾筒,針頭與接收裝置間距18 cm,滾筒轉速1 800~2 000 r/min。將得到的PLGA纖維膜裁剪成3.5 mm×2 mm大小,在直徑1.6 mm鋼針上按 PLA組分比例增長的順序層層卷繞,再置于PBS中靜置1 min,抽去鋼針得到PLGA神經導管。
將PLGA神經導管放置在20 g/L的2,2,2-三氟乙醇(TFE)中溶脹20 min,取出后分別在含有15 mg(CS-15)、20 mg(CS-20)、25 mg(CS-25)、30 mg(CS-30)殼聚糖的冰醋酸溶液(冰醋酸質量濃度為10 g/L)中浸泡24 h,去離子水清洗并干燥。未改性的PLGA神經導管為CS-0。
1.2神經導管的性能測試與表征
1.2.1 形貌表征 將PLGA神經導管觀察面進行噴金處理,利用掃描電子顯微鏡(Zeiss MERLIN Compact,德國)觀察其微觀形貌。用圖像分析軟件Image J分析纖維直徑。
1.2.2 傅里葉變換紅外光譜測試 為觀察殼聚糖對PLGA神經導管改性的效果,采用傅里葉變換紅外光譜儀通過衰減全反射法(ATR)對幾種神經導管進行測試,掃描范圍為4 000~500 cm-1。
1.2.3 接觸角的測定 采用表面水接觸角實驗對改性前后的導管支架進行親水性表征的檢測。將PLGA神經導管沿縱向裁開平鋪,滴加5 μL水,利用接觸角測量儀(上海中晨數字技術設備有限公司)在室溫條件下測定神經導管內表面和外表面接觸角。每個樣品測5個點取平均值。
1.2.4 孔隙率的測試 將PLGA神經導管沿縱向裁開平鋪,測量其長、寬、厚以及干重,計算密度。根據表觀密度和PLGA的標準密度(ρ0=1.22 g/cm3)計算樣本的孔隙率(ε):ε(%)=(1-ρ/ρ0)×100/%。
1.2.5 力學性能的測定 利用夾持裝置夾持PLGA神經導管樣品,在萬能拉伸試驗機(EZ-LX單柱精密拉伸實驗機,島津(中國)有限公司)上進行拉伸試驗。夾持長度為15 mm,加載速度為5 mm/min。實驗均在標準大氣壓條件下進行,采用千分尺測定樣品的厚度。每個樣品測5個點,取厚度平均值。每個樣品平行測3組數據。
1.3細胞相容性檢測
1.3.1 大鼠神經施萬細胞(RSC細胞)的培養 用含有體積分數10%胎牛血清的DMEM培養基復蘇液氮凍存的RSC96細胞,置于37 ℃、體積分數5% CO2的恒溫培養箱內培養,每隔2 d換1次培養基。觀察細胞的生長狀態,當貼壁細胞融合度達到80%時用胰蛋白酶消化傳代。
1.3.2 DMEM培養基預處理 將CS-0和CS-15 PLGA神經導管分別放入含有體積分數10%胎牛血清的DMEM培養基中,置于37 ℃、體積分數5% CO2的培養箱中培養48 h,棄去導管,得到預處理的DMEM培養基。
1.3.3 CCK-8實驗 將經1.3.2中預處理的DMEM培養基分別培養RSC96細胞12、24 和48 h后加入CCK-8,再孵育4 h后450 nm波長下測定光密度值。以未處理的DMEM培養基為對照組。
1.3.4 病毒感染RSC96細胞 將RSC-96細胞接種于6孔板中(5×105個/孔)。培養24 h后加入感染指數(MOI)=30的pCDH-CMV-EF1-copGFP慢病毒(由鄭州大學基礎醫學院微生物與免疫學教研室惠贈),并加入4 mg/L Polybrene輕輕混勻。24 h后更換培養基繼續培養72 h。熒光顯微鏡下觀察病毒感染情況。
1.3.5 細胞種植 將CS-0和CS-15 PLGA纖維膜分別纏繞載破片,放于體積分數3%的新潔爾滅溶液中浸泡24 h消毒滅菌,PBS清洗。將感染慢病毒的RSC96細胞以1×105個/mL加入鋪有PLGA纖維膜纏繞的載玻片的24孔板中,置于37 ℃、體積分數5% CO2的培養箱中培養5 d。對照組用無PLGA纖維膜的載玻片種植細胞。
1.4統計學處理采用Graph Pad Prism 7進行數據整理和分析。應用單因素方差分析比較各項觀察指標組間的差異,檢驗水準α=0.05。
2 結果
2.1殼聚糖改性后PLGA神經導管的形貌圖見圖1、表1。殼聚糖改性后的PLGA導管外表面(圖1左)均有不同程度殼聚糖涂覆,且隨著殼聚糖含量增大,涂覆范圍隨之增大,纖維直徑隨之增粗。導管內表面(圖1右)殼聚糖涂覆較少,纖維排列更加緊密,改性后纖維直徑增粗。

a~d:分別為15、20、25和30 mg殼聚糖改性;1~3:不同放大倍數鏡下觀;左:外表面形貌圖;右:內表面形貌圖

表1 殼聚糖改性對PLGA神經導管纖維直徑的影響(n=3) nm
2.2殼聚糖改性對PLGA神經導管紅外光譜的影響紅外光譜分析結果顯示,與CS-0相比,改性后的PLGA神經導管在1 647 cm-1和1 559 cm-1波長處均出現了殼聚糖酰胺Ⅰ與酰胺Ⅱ的特征吸收峰,表明經改性后殼聚糖被截留在導管表面(圖2)。
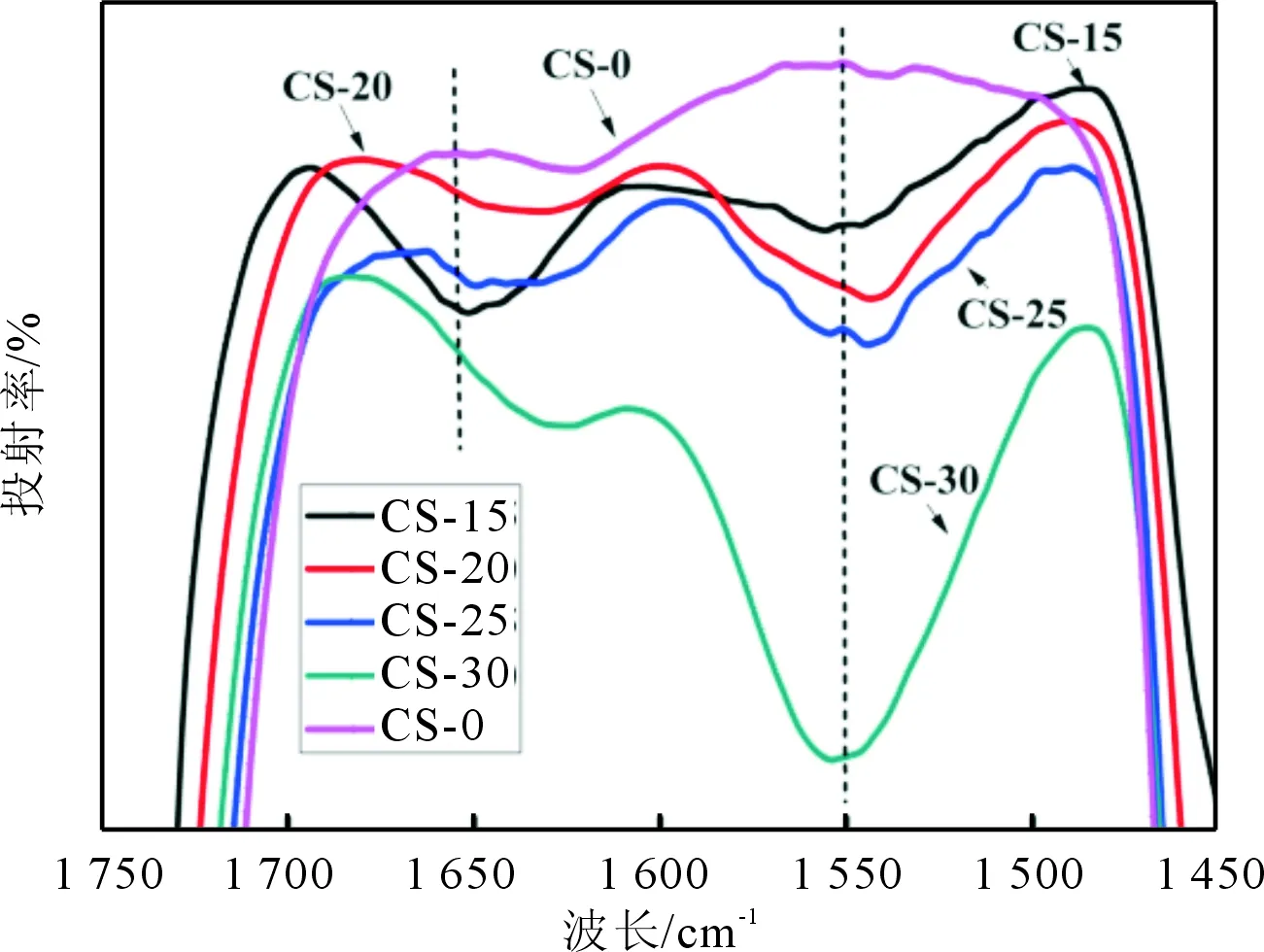
圖2 殼聚糖改性對PLGA神經導管紅外光譜圖的影響
2.3殼聚糖改性對PLGA神經導管親水性的影響見圖3、表2。與CS-0 PLGA神經導管的外表面、內表面接觸角相比,經不同濃度殼聚糖改性后PLGA神經導管接觸角均有一定程度的減小。
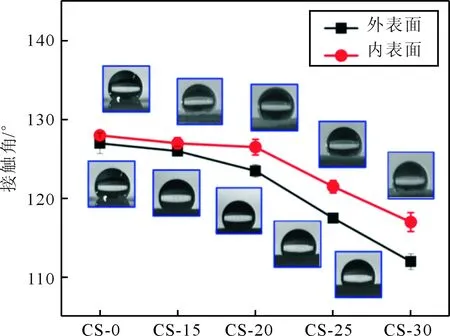
圖3 殼聚糖改性對PLGA神經導管接觸角的影響
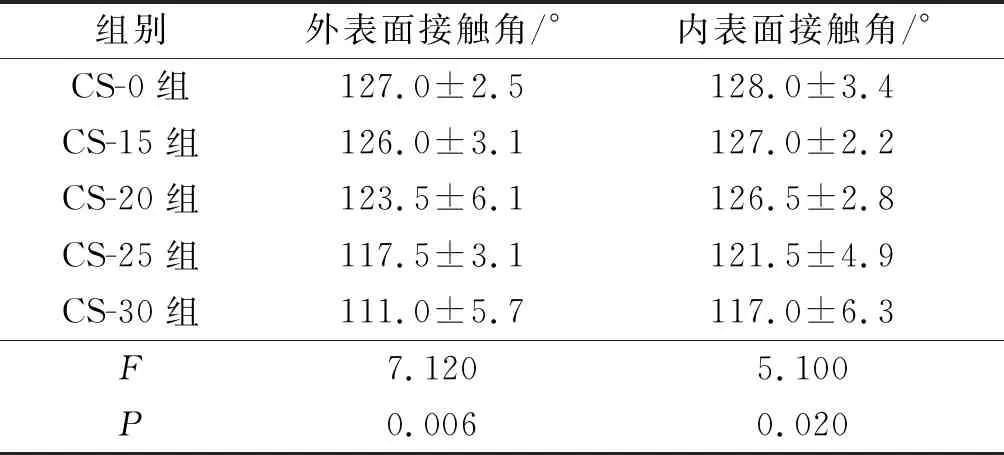
表2 殼聚糖改性對PLGA神經導管接觸角的影響(n=3)
2.4殼聚糖改性對PLGA神經導管孔隙率和支架力學性能的影響見表3。從形貌分析中可以看到大量的殼聚糖黏附在纖維膜表面,覆蓋了纖維膜的孔隙。與CS-0 PLGA神經導管的孔隙率相比,經不同濃度殼聚糖改性后PLGA神經導管孔隙率降低,且殼聚糖濃度越高,孔隙率的下降幅度越大。與CS-0 PLGA神經導管相比,經殼聚糖改性后PLGA神經導管的力學強度均有所提高,拉伸強度分別提高了約39.4%、70.4%、74.6%和90.1%(P<0.001)。
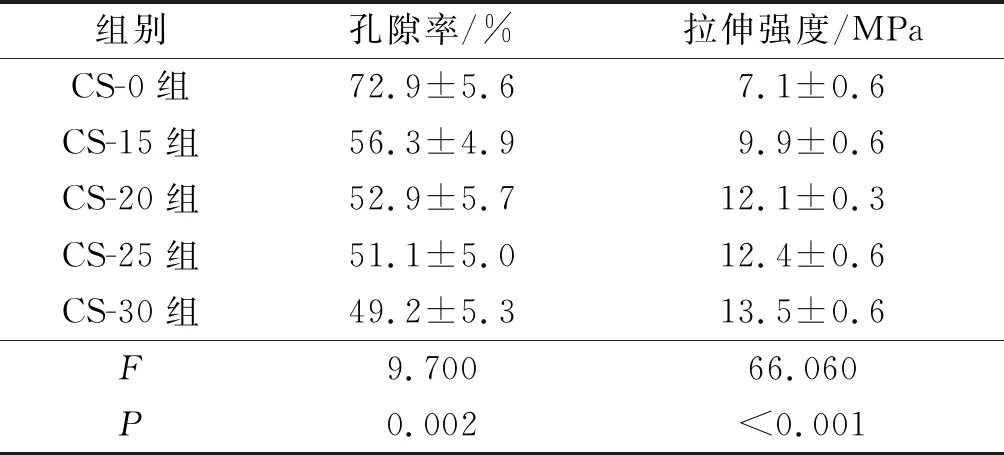
表3 殼聚糖改性對PLGA神經導管孔隙率和伸強度的影響(n=3)
2.6殼聚糖改性的PLGA神經導管對RSC96細胞增殖的影響見表4。與未處理的DMEM培養基培養的RSC96細胞(對照組)相比,PLGA預處理組(CS-0組)和15 mg殼聚糖改性PLGA預處理組(CS-15組)細胞增殖差異無統計學意義,表明RSC96細胞在殼聚糖改性PLGA導管中可以正常增殖。
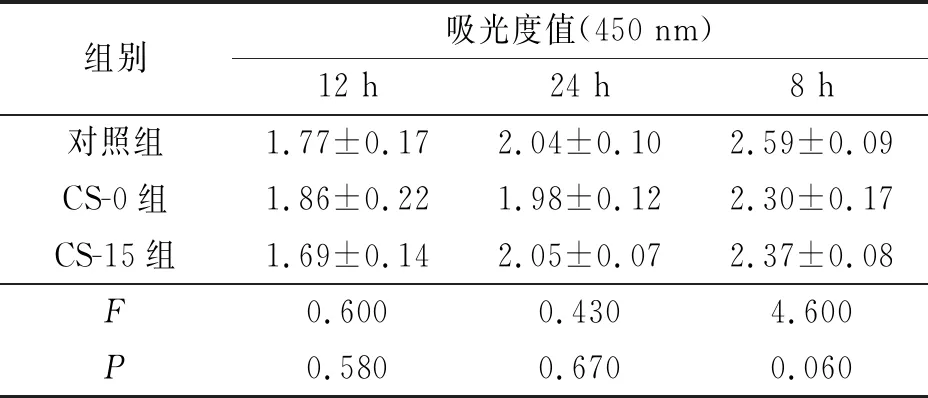
表4 殼聚糖改性的PLGA神經導管對RSC96細胞增殖的影響(n=3)
2.7RSC96細胞在殼聚糖改性的PLGA纖維膜上的生長見圖4。將慢病毒感染的RSC96細胞種植在纖維膜上培養5 d后,在熒光顯微鏡下可觀察到RSC96細胞在CS-0和CS-15纖維膜上均沿纖維取向方向生長,生長為牽伸狀;而直接在玻片上生長的細胞均勻分布,且成散亂無序的狀態。
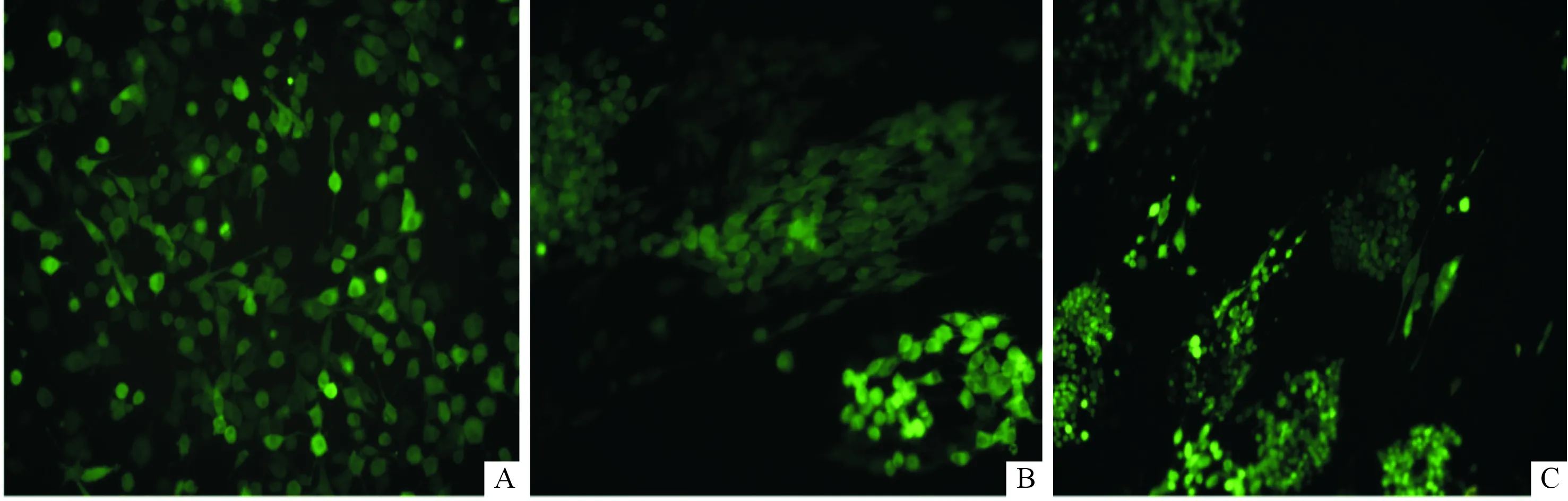
A:對照組;B:CS-0組;C:CS-15組
3 討論
本文通過靜電紡絲的方法制備出具有表面取向結構的PLGA纖維膜,經過高速旋轉滾筒收集到的靜電紡絲PLGA纖維呈現出良好的取向,并且直徑均勻,未出現串珠等現象。為了防止導管材料降解過快或過慢,影響再生神經的生長,采用由內向外增長的順序將5種PLA比例的PLGA纖維膜層層卷繞,制備梯度降解的神經導管支架(課題組之前的實驗數據顯示,導管降解發生時,PLGA從PLA∶PGA比例為50∶50到85∶15逐漸由內層開始降解;降解持續過程中,pH值相對穩定,在7.00~7.23浮動)。
在組織工程中,生物材料表面的親水性對種子細胞的黏附有著重要的作用[10],適度的親水性更有利于細胞的黏附、生長和增殖[11-12]。在高分子材料表面固定生物活性分子是改善材料親水性能的有效方式之一,故本文利用殼聚糖改性PLGA纖維膜。結果顯示,殼聚糖改性的PLGA外表面纖維直徑變粗,這可能是纖維溶脹截留殼聚糖導致的;導管內表面殼聚糖涂覆較少,纖維經過溶脹-截留-消溶,纖維排列更加緊密,直徑較改性前有增粗,但無外表面纖維直徑改變明顯,說明導管內表面截留的殼聚糖并不多;推測這可能是因為殼聚糖溶液比較黏稠、黏附在纖維膜表面,進入內表面較少。同時發現,隨著殼聚糖濃度增大,接觸角下降的幅度越大;推測由于殼聚糖是親水性天然高分子材料,殼聚糖的濃度越大,截留在導管表面的殼聚糖越多,從而引起了導管表面親水性的變化。
神經的修復和再生的環境需要具有適當的孔隙率,不僅為細胞的黏附、遷移、增殖提供空間,并且有利于營養物質的進入以及代謝產物的排出[13-14]。本文殼聚糖改性后導管支架的孔隙率均有所下降,這可能是因為殼聚糖不僅被截留在纖維內部,同時也會黏附在纖維表面和纖維多孔結構的空隙間,殼聚糖濃度越高,孔隙率的下降幅度越大。雖然孔隙率有所下降,但依然維持在正常的范圍以內。
神經導管支架不僅需要具有合適的孔隙率,同時還要具備合適的力學性能,為神經細胞生長和分化提供良好的力學支撐[15]。本文通過檢測神經導管的拉伸強度體現其力學性能。相對于改性前,隨著殼聚糖改性濃度的增加,PLGA導管的拉伸強度增加。這一現象可能是因為經2,2,2-三氟乙醇的溶脹之后的PLGA導管放入殼聚糖溶液后,殼聚糖可進入導管支架的層之間間隙以及纖維之間的孔隙,之后的消溶過程不僅使導管表面截留部分殼聚糖,在導管管壁間、纖維之間也截留了部分殼聚糖,使導管的整體結構更加緊密,從而力學性能顯著提高。
本文中將大鼠神經膠質細胞RSC96在CS-15 PLGA預處理的培養基中培養,細胞能夠正常增殖且細胞活性沒有明顯變化,表明殼聚糖改性的PLGA導管具有良好的組織相容性。將RSC96細胞接種至殼聚糖改性的PLGA纖維膜上培養,細胞的排列以及細胞突觸伸長的方向與纖維膜的取向一致,呈現出一定的方向性,表明細胞能夠在此導管上沿纖維軸向遷移生長。這一特性對于神經引導性再生具有積極意義。神經細胞的引導性再生可加快功能性神經組織的延伸,促進受損區域神經組織與兩端正常神經組織的橋接。
盡管如此,神經的再生以及功能的恢復可能需還要細胞外基質蛋白、神經生長因子等因素構成的微環境,本文中所制備的神經導管并未涉及,因此,構建具有神經再生微環境的PLGA神經導管并進行動物體內實驗的驗證將是下一步的工作重點。

