原發性輸卵管癌肉瘤2例
閆化茹,楊道華,傅國輝
例1,53歲;例2,75歲,均因絕經后陰道流血入院,于術中發現腫塊位于輸卵管,并行全子宮+雙側附件+大網膜切除及盆腔淋巴結清掃術。鏡下見腫瘤均含惡性上皮及間葉成分,伴軟骨肉瘤分化。例2子宮肌層內見3處轉移灶,最大者呈雙相分化。
病理檢查眼觀:例1左側輸卵管腫塊,大小11 cm×9 cm×8 cm,切面灰黃、暗紅色,質軟。例2左側輸卵管壺腹部膨大,內見腫塊,呈息肉狀生長,大小4.5 cm×2.5 cm×1.8 cm,切面灰白、灰黃色,實性為主,質脆。子宮內膜下及肌壁間見灰白色結節3枚,長徑1~1.4 cm,界清。鏡檢:例1腫瘤呈上皮和間葉分化。上皮性腫瘤成分多呈乳頭、微乳頭、管狀及篩狀排列。癌細胞核大,深染,核分裂象易見,胞質少,淡嗜酸性,類似高級別漿液性癌,并可見瘤巨細胞(圖1)。部分癌細胞胞質豐富透明,呈實性巢狀排列,類似透明細胞癌。間葉成分為梭形細胞,穿梭于上皮細胞之間,含少量高級別軟骨肉瘤成分(圖2)。卵巢組織未見腫瘤成分。例2腫瘤位于輸卵管內,息肉狀生長。腫瘤周圍輸卵管上皮有異型(圖3),上皮性腫瘤成分呈乳頭、微乳頭、管狀及實性巢狀排列,細胞核大,異型性明顯,類似高級別漿液性癌。其間見較多高級別軟骨肉瘤及少量梭形細胞肉瘤成分(圖4)。卵巢組織未見腫瘤成分。子宮肌壁間見3處轉移灶,最大者伴雙相分化(圖5),余2處只含腺癌成分,子宮內膜腺體無明顯異型(圖6)。免疫表型:例1透明細胞:僅CK(+);其余上皮細胞:CK7、p53和WT-1均(+);梭形細胞:vimentin(+),CD10部分(+),ER灶(+);軟骨肉瘤:vimentin和S-100均(+)。例2上皮細胞:CK7和WT-1均(+);梭形細胞vimentin(+);軟骨肉瘤:vimentin、S-100、SOX-9均(+)。
病理診斷:例1左側輸卵管癌肉瘤,癌成分主要為高級別漿液性癌,肉瘤成分為高級別梭形細胞肉瘤,局灶呈高級別軟骨肉瘤分化;例2左側輸卵管壺腹部癌肉瘤,子宮肌層內見癌肉瘤轉移。
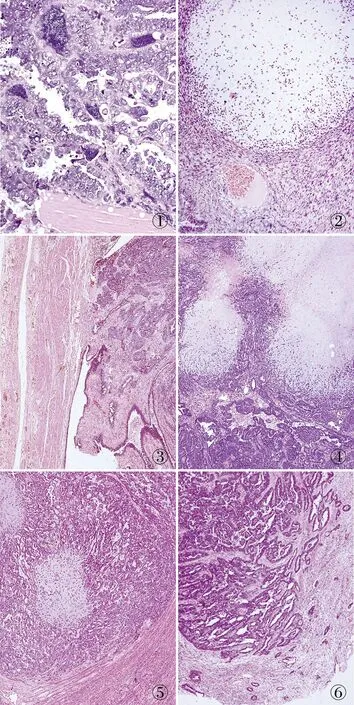
圖1 例1上皮性腫瘤呈乳頭狀排列,癌細胞核大,深染,核分裂象多見,可見瘤巨細胞,胞質少,淡嗜酸性,類似高級別漿液性癌
圖2 例1間葉成分為梭形細胞,穿梭于上皮細胞之間,含少量高級別軟骨肉瘤成分 圖3 例2腫瘤位于輸卵管內,息肉狀生長,與腫瘤移形處輸卵管上皮有異型 圖4 例2上皮細胞間見較多高級別軟骨肉瘤,少量梭形細胞肉瘤成分 圖5 例2子宮肌壁間見3處轉移灶,最大者伴雙相分化 圖6 例2其余2處子宮肌層浸潤灶僅含腺癌成分,表面子宮內膜腺體無明顯異型
討論原發性輸卵管癌肉瘤多見于絕經后婦女。腫瘤常單側發生,多位于輸卵管壺腹部、傘端。發生于傘端者可于浸潤輸卵管管壁前出現腹腔播散[1]。臨床表現為下腹痛、絕經后陰道流血、陰道排液。血清CA125水平可正常或輕度升高,有學者認為CA125可預測女性生殖系統癌肉瘤復發[2]。B超常表現為附件區臘腸樣囊實性占位,界清,但難以與卵巢腫瘤鑒別[3]。部分患者就診時腫塊已擴散至鄰近組織,因此需仔細檢查卵巢,除外卵巢腫瘤轉移。眼觀輸卵管局部增粗,腔內可見腫塊呈息肉狀生長,常伴出血、壞死。鏡下可見惡性上皮與間葉成分混合存在,上皮成分可表現為漿液性腺癌、子宮內膜樣腺癌或透明細胞癌;間葉性成分分為同源性或異源性,異源性成分起源為正常苗勒系統中不存在的成分,包括橫紋肌肉瘤、軟骨肉瘤、脂肪肉瘤及骨肉瘤,其發生頻率依次降低,以上不同成分可單獨或混合出現[4]。除高分化肉瘤區以外,腫瘤內常見低分化區,細胞呈短梭形,彌漫排列[5]。免疫組化:CK、EMA標記上皮成分;CD10、S-100、MSA等區分間葉成分;ER、PR可用于判斷對內分泌治療的敏感性[6];Ki-67高表達者生存期較短,而p53陽性并非患者無瘤生存的預后因素[1]。腫瘤可直接浸潤輸卵管管壁而累及直腸子宮陷窩或轉移至卵巢、膀胱、結腸、闌尾、腹膜、網膜等[1,7]。文獻曾報道1例罕見輸卵管癌肉瘤并發子宮內膜腺癌[8],1例子宮內膜惡性苗勒管混合瘤合并雙側輸卵管乳頭狀漿液性腺癌[9]。查閱資料,原發性輸卵管癌肉瘤轉移至子宮肌層且伴有典型雙相分化者尚無文獻報道。原發性輸卵管癌肉瘤的診斷條件可參考輸卵管癌:(1)腫瘤位于輸卵管內;(2)鏡下上皮呈乳頭狀生長;(3)正常輸卵管上皮與腫瘤性輸卵管上皮之間有移形。例2輸卵管內腫塊與周圍正常輸卵管上皮有移形,而子宮肌層內浸潤灶境界清楚,且子宮內膜腺體無異型性,基本排除原發性子宮癌肉瘤轉移至輸卵管的可能。
原發性輸卵管癌肉瘤的治療為手術為主聯合化療,化療方案常采用紫杉醇+鉑類藥物。近年研究表明BRCA基因可能與女性生殖系統癌肉瘤的發生有關,對于該腫瘤的靶向治療具有指導意義[10]。