舌鱗狀細胞癌中Survivin的表達及與上皮細胞-間質轉化的關系
丁丹丹,程如玉,韓 瑞,張 姍,丁 翔,王尚華,王倩倩,韓影影,徐錦程
舌鱗狀細胞癌(tongue squamous cell carcinoma, TSCC)是口腔癌中最常見的惡性腫瘤,男、女性均可發病,其發病率有逐年上升趨勢,并且發病年齡年輕化[1]。上皮細胞-間質轉化(epithelial-mesenchymal transition, EMT)是鱗狀細胞癌浸潤和轉移的關鍵機制之一,因此探討TSCC的EMT發生機制,對于改善預后,提高患者的生存率至關重要。Survivin是迄今為止發現的凋亡抑制蛋白家族(inhibitor of apoptosis protein, IAP)中凋亡抑制作用最強的蛋白,在多種腫瘤組織中高表達,可抑制腫瘤細胞的凋亡,促進腫瘤細胞的侵襲和轉移[2]。目前,Survivin與TSCC組織EMT表型的關系尚無相關報道。本文檢測Survivin和EMT相關蛋白E-cadherin和N-cadherin在TSCC中的表達,分析其與臨床病理特征的關系,以期為TSCC的相關機制提供參考。
1 材料與方法
1.1 臨床資料收集蚌埠醫學院第一附屬醫院口腔頜面外科2015年1月~2018年12月手術切除且經病理確診的TSCC蠟塊標本63例。所有患者均行手術切除,術前未接受放、化療等。患者年齡29~81歲,中位年齡55歲,男性45例,女性18例。腫瘤直徑<2.0 cm者27例,2.0~4.0 cm者23例,>4.0 cm者13例。依據AJCC(2010年)標準對臨床分期進行劃分,Ⅰ+Ⅱ期37例,Ⅲ+Ⅳ期 26例。根據WHO(1997)口腔鱗狀細胞癌的分類標準對病理分級進行劃分,Ⅰ級22例,Ⅱ級21例,Ⅲ級20例。發生區域性淋巴結轉移者24例,其中有18例淋巴結轉移數目為1~3枚,6例淋巴結轉移數目>3枚;未發生區域性淋巴結轉移者39例。選取8例符合要求的新鮮TSCC組織標本,取材收集后,即刻轉移到-80 ℃冰箱中保存。另選擇63例相應癌旁正常上皮組織作為對照組。
1.2 試劑兔抗人Survivin、E-cadherin、N-cadherin抗體購自北京中杉金橋公司;即用型免疫組化檢測試劑盒、DAB顯色劑及兔抗人β-actin抗體,均購自福州邁新公司;稀釋液及SDS-PAGE電泳試劑盒,均購自北京碧云天公司;PVDF膜購自Millipore公司。
1.3 免疫組化TSCC組織蠟塊標本均制成4 μm厚的切片,免疫組化染色采用EnVision法。一抗用PBS緩沖液代替作為陰性對照,而已知的TSCC組織切片則作為陽性對照。一抗Survivin、E-cadherin及N-cadherin稀釋比均為1 ∶300。
1.4 結果判定Survivin主要表達于細胞核,E-cadherin主要表達于細胞膜,N-cadherin表達于細胞膜和(或)細胞質。按細胞著色強度計分:無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分;每例隨機選擇10個熱點區域的細胞數,按陽性細胞百分數計分:≤5%為0分,6%~25%為1分,26%~50%為2分,>50%為3分。將兩項得分結果相乘:≥3分為陽性,<3 分為陰性。
1.5 Western blot法常規提取組織中蛋白,采用SDS-PAGE膠電轉移至PVDF膜上,室溫浸泡于5%脫脂牛奶中封閉2 h,加入一抗Survivin、E-cadherin、N-cadherin以1 ∶500的比例稀釋,β-actin以1 ∶1 000比例稀釋,4 ℃過夜。次日,TBST洗滌2~3次后孵育二抗(辣根過氧化物酶標記的山羊抗兔IgG 1 ∶2 000)2 h,TBST洗滌2~3次。暗室中將混勻的發光液均勻涂在PVDF膜上,使用凝膠成像系統拍照,并通過圖像分析軟件測定各條帶的灰度值。
1.6 統計學分析應用SPSS 16.0軟件進行統計學分析,采用χ2檢驗分析Survivin與TSCC臨床病理特征的關系;采用Pearson相關檢驗對Survivin表達與EMT標志蛋白的免疫組化結果進行相關性分析,采用t檢驗分析統計組間的差異,P<0.05為差異有統計學意義。
2 結果
2.1 Survivin、E-cadherin及N-cadherin在TSCC和癌旁正常上皮組織中的表達免疫組化檢測結果顯示,TSCC組織中Survivin陽性主要定位于細胞核,E-cadherin陽性主要定位于細胞膜,N-cadherin陽性定位于細胞膜和(或)細胞質(圖1~7)。統計分析發現,三者在TSCC和癌旁正常組織中的陽性率組間差異有統計學意義(P<0.01,表1)。
2.2 Survivin、E-cadherin及N-cadherin與TSCC臨床病理特征的關系統計結果顯示,臨床分期及病理分級越高、有淋巴結轉移的TSCC組織中Survivin陽性率明顯增高,差異有統計學意義(P<0.05),其表達與腫瘤直徑、性別、年齡均無關(P>0.05)。E-cadherin和N-cadherin表達與TSCC臨床分期、病理分級、淋巴結轉移相關,差異有統計學意義(P<0.05);與腫瘤直徑、患者性別及年齡均無關(P>0.05,表2)。Western blot實驗結果進一步證實與免疫組化結果一致(圖8)。
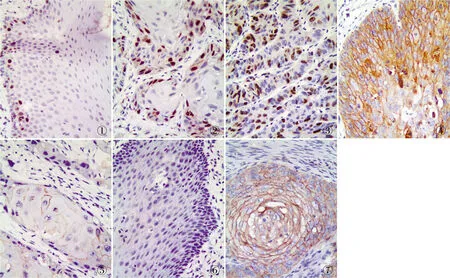
圖1 Survivin在癌旁正常上皮組織中的表達,EnVision法圖2 Survivin在無淋巴結轉移TSCC組織中的表達,EnVision法 圖3 Survivin在有淋巴結轉移TSCC組織中的表達,En-Vision法 圖4 E-cadhrin在癌旁正常上皮組織中的表達,EnVision法 圖5 E-cadher-in在TSCC組織中的表達,EnVi-sion法 圖6 N-cadherin在癌旁正常上皮組織中的表達,EnVision法 圖7 N-caderin在TSCC組織中的表達,EnVision法

表1 TSCC和癌旁正常組織中Survivin、E-cadherin和N-cadherin的表達[n(%)]
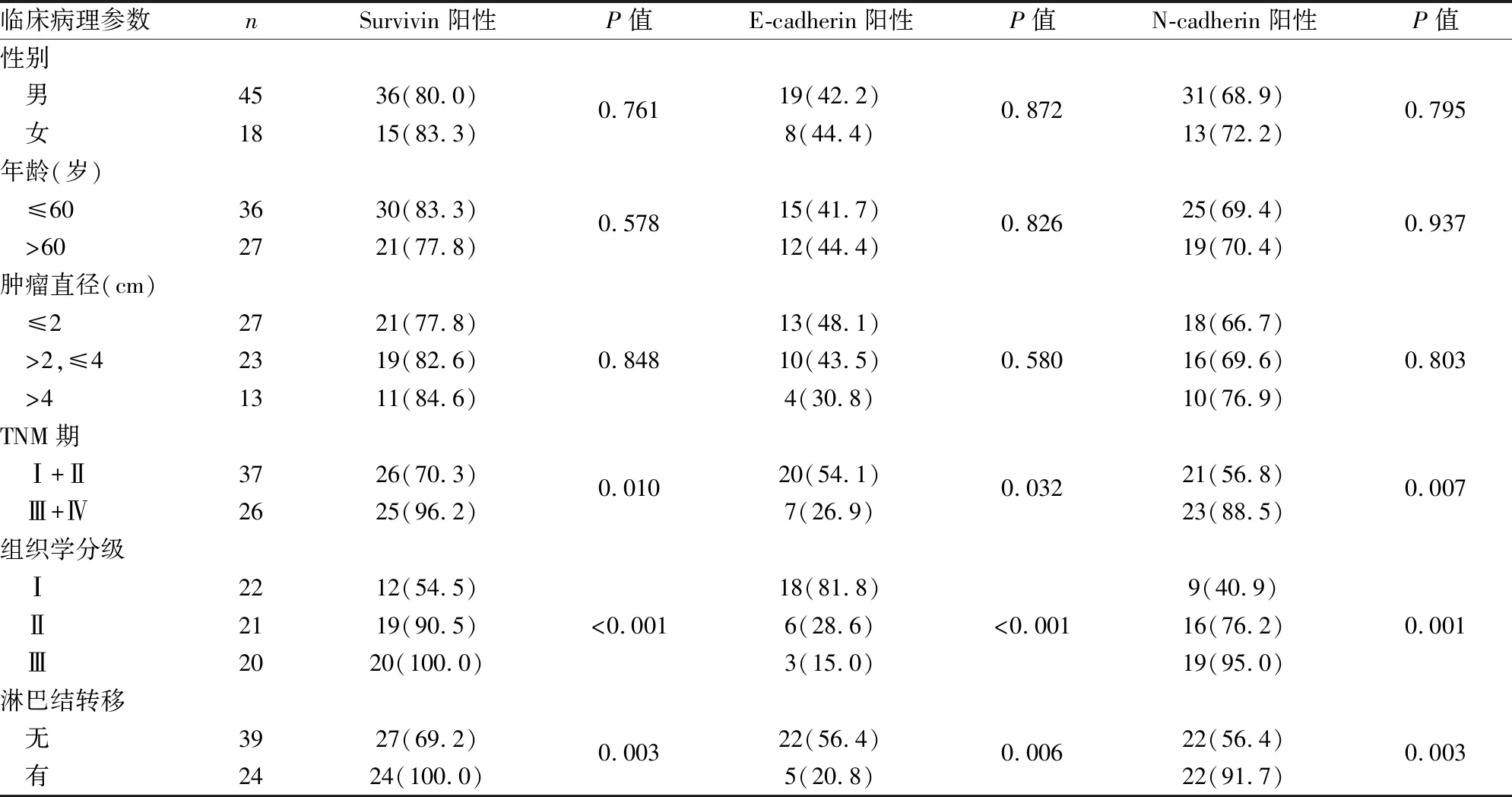
表2 TSCC中Survivin、E-cadherin、N-cadherin的表達與臨床病理特征的關系[n(%)]
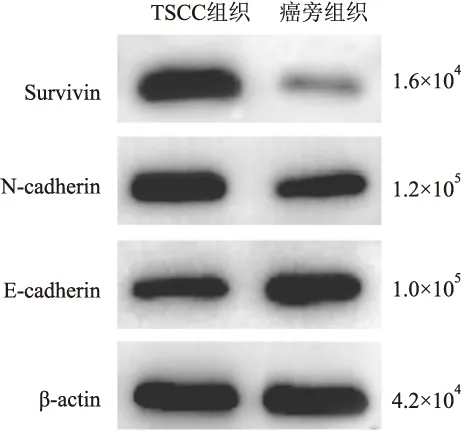
圖8 Survivin、N-cadherin、E-cadherin在TSCC組織及癌旁正常組織中的表達
2.3 TSCC組織中Survivin與E-cadherin、N-cadherin表達的相關性TSCC組織中E-cadherin和N-cadherin的陽性率分別為42.9%和69.8%。相關性分析顯示,Survivin與E-cadherin的表達呈負相關(r=-0.315,P=0.012),與N-cadherin的表達呈正相關(r=0.474,P<0.001,表3)。
3 討論
有研究表明,EMT是癌細胞獲得侵襲和遷移能力的首要環節[3]。EMT是上皮細胞失去細胞極性和細胞黏附而獲得間質特征的可逆過程,其中E-cadherin和N-cadherin是EMT的主要特征性蛋白。當細胞發生EMT時,表現為上皮性標志物的表達下調,如E-cadherin;而間質型標志物的表達上調,如N-cadherin[4]。因此,可通過檢測E-cadherin和N-cadherin來鑒定EMT的發生。本組結果顯示,E-cadherin在TSCC組織中表達明顯低于癌旁正常組織,且隨著腫瘤臨床分期、病理分級越高,以及淋巴結轉移的數目越多,E-cadherin在TSCC組織中的表達越低。N-cadherin在TSCC組織中的表達明顯高于癌旁正常組織,且隨著腫瘤臨床分期、病理分級越高,以及淋巴結轉移數目越多,N-cadherin在TSCC組織中的表達越高。

表3 TSCC中Survivin與E-cadherin、N-cadherin表達的相關性
Survivin在多數腫瘤中過表達,促進腫瘤的增殖和轉移。Survivin作為節點蛋白,與參與有絲分裂、凋亡、功能整合增殖、細胞死亡和細胞內環境穩定的多種信號相互作用[5-6]。有研究發現[7-10],Survivin與胃癌、乳腺癌、結腸癌、子宮頸癌等惡性腫瘤的轉移有關。本實驗結果表明,TNM分期越高則Survivin表達越高,病理分級越高則Survivin表達越高,有淋巴結轉移者Survivin表達越高,提示Survivin表達增強可能對TSCC的侵襲和轉移有重要的促進作用。
有研究表明[11-13],Survivin對EMT有潛在的誘導作用,從而促進結腸癌及卵巢癌的轉移。本組結果表明,在TSCC組織中Survivin的表達與E-cadherin呈負相關,與N-cadherin呈正相關,提示Survivin可能作為誘導EMT進程的誘因之一,參與多種信號通路(TGFb、ERK1/2、P13K/AKT)促進癌細胞EMT的發生[14]。本組僅在組織水平驗證Survivin與EMT在TSCC組織中的表達水平及相關性分析,而Survivin是通過何種途徑調控TSCC組織EMT的發生需更深入的探討。