核蛋白14對黑素瘤新生血管形成的影響及機制研究
李璟蓉 趙瑞 王康瑋 方銳華
1廣州市第一人民醫院皮膚科 510180;2廣州市第一人民醫院病理科 510180
核蛋白14(nucleolar protein 14,NOP14)是一種含有857 個氨基酸的核蛋白,是40S 核糖體成熟所必 需 的 蛋 白 質[1?2]。 在 卵 巢 癌 患 者 血 液 中 發 現NOP14 表達下調,低表達的NOP14 顯著降低卵巢癌患者的總生存期[3]。體內和體外研究表明,過表達NOP14 能夠抑制乳腺癌的發生和轉移[4]。但NOP14 在胰腺導管癌細胞系及臨床腫瘤組織樣本中表達水平上調,抑制NOP14 可抑制胰腺導管癌細胞的遷移和侵襲,NOP14 通過突變型p53 調控miR?15對P21的表達,從而促進胰腺導管癌的生長和侵襲[5]。我們的前期研究結果表明,NOP14 在黑素瘤組織中低表達,與腫瘤的大小和淋巴轉移情況顯著相關,發揮抑制黑素瘤細胞生長和轉移的作用[6?7]。鑒于血管形成和黑素瘤生長轉移的密切關系[8],我們推測NOP14可能參與調控黑素瘤的血管新生。本研究中我們探討NOP14 表達與黑素瘤血管形成的關系,進一步探索NOP14 抑制黑素瘤細胞生長和轉移的機制,為黑素瘤的靶向治療提供新的靶點和理論基礎。
對象與方法
1.對象:納入 2016 年 1 月至 2018 年 12 月在廣州市第一人民醫院經病理確診的40 例黑素瘤患者的黑素瘤組織作為實驗組。所有標本均為廣州市第一人民醫院病理科留存的石蠟標本。本研究取得廣州市第一人民醫院倫理委員會批準(批件號:K?2017?107?01和 K?2017?083?01)。
2.材料:人臍靜脈內皮細胞(HUVEC)、黑素瘤細胞 A375 和 SK?MEL?1 產自上海中科院細胞庫。NOP14 抗體產自美國 Proteintech 公司。CD31 抗體產自中國臺灣Arigo Biolaboratories 公司。血管內皮生長因子受體(vascular endothelial growth factor receptor,VEGFR)一抗產自美國Abcam 公司。血管內皮生長因子(VEGF)和甘油醛-3-磷酸脫氫酶(GAPDH)一抗以及Western 印跡所需二抗產自美國 Cell Signaling Technology 公司。Transwell 小室產自美國Corning 公司。免疫組化二抗NovoLink 聚合物檢測系統RE7280?K 檢測試劑盒產自德國Leica公司。人VEGFB 和人VEGFR 1/Flt1 ELISA 檢測試劑盒產自武漢華美生物工程有限公司。Lipofectamine 2000 產自美國Promega 公司。CCK8試劑盒產自日本Dojindo Molecular Technologies 公司。Trizol試劑來自美國Invitrogen公司。
3.免疫組化及結果判定:組織切片脫蠟后,按常規行抗原修復、CD31 或者NOP14 一抗孵育和顯色反應。封片后,按照文獻[9]方法判讀CD31 和NOP14染色結果。NOP14染色強度計分標準:無色為 0 分,黃色為 1 分,棕黃色為 2 分,棕褐色為 3 分;陽性率計分標準:未染色為0 分,1% ~25%細胞陽性為 1 分,26% ~ 50% 為 2 分,51% ~ 75%為3 分,>75%為4 分。NOP14 染色強度計分和陽性率計分的乘積即為NOP14 表達的總評分,總評分 1 ~ 4 分為低表達,5 ~ 8 分為中表達,9 ~ 12 分為高表達。 CD31 的染色結果以微血管密度(microvessel density,MVD)表示:以任何一個獨立的淡黃-棕褐色的內皮細胞或內皮細胞群作為1 個血管,在低倍鏡下選取血管高密度區,在400 倍視野下,分別隨機計數5 個不重疊視野的微血管數,取其平均值即為每例的MVD 值。以上判讀均由3 位病理診斷醫師分別以雙盲方法綜合評估完成后取平均值,忽略組間及組內觀察者差異。
4.NOP14 過表達載體的構建及NOP14 siRNA合成:通過PCR 調取NOP14 的全長編碼區,所需引物如下,正向引物5′? tacaagtccggactcagatctGCCACC ATGGCGAAGGCGAAGAAGG?3′和反向引物 5′?gtaccgtcgactgcagaattcTTATTTTTTGAACTTTTTCCTC TTCAG?3′。回收 NOP14 PCR 擴增產物,連接到pEGFP?C1 載體中,通過測序確定連接成功。靶向NOP14 的siRNA(siNOP14)序列為5′?GGAAAGAG CUGAUUGAAGA ?3′ ,陰 性 對 照 siRNA 的 序 列(siNC)為5′?AGGUGGAAAUAUGGAAGAC?3′。引物和siRNA由上海吉瑪制藥技術有限公司合成。
5.實驗分組:按照上海中國科學院細胞庫提供的方法培養A375和SK?MEL?1細胞,當細胞融合度50% ~ 60% 時 ,將 0.5 μg NOP14 過 表 達 載 體(NOP14 組)、0.5 μg pEGFP?C1 空載體(空載體組)、50 nmol/L siNOP14(siNOP14 組)以及 50 nmol/L siNC(siNC 組)分別轉染到A375和SK?MEL?1中,轉染方法參考Lipofectamine 2000 說明書。轉染24 h后收集以上各組 A375 和 SK?MEL?1 細胞,分別與HUVEC共培養作為共培養組。
6.熒光定量 PCR 檢測 NOP14 mRNA 的表達:收集各組A375 和SK?MEL?1 細胞(約106個),Trizol試劑提取總RNA。按照前期報道的方法[6]檢測細胞中NOP14 和內參照18S mRNA 的表達水平。采用2-△△Ct法計算NOP14 mRNA的相對表達水平。
7.細胞計數試劑盒 8(CCK8)檢測 HUVEC 增殖:將1×105HUVEC接種于Transwell小室下室,培養箱內過夜;次日,上室加入各組A375和SK?MEL?1細胞200 μl(2 × 105個/ml),培養24 h 后,收集下室細胞及培養基,接種在96孔培養板中,分別于1、2、3 和 4 d 后,按照 CCK8 試劑盒說明,檢測 450 nm 波長處吸光度(A值)。以只加CCK8 試劑的孔作為空白孔,每組細胞的A450 值減去空白孔的A450 值作為實驗組最終A450值,表示細胞增殖活性。
8.Transwell 實驗檢測HUVEC 遷移和侵襲能力:遷移實驗中,于Transwell 小室的下室分別加入各組 A375 和 SK?MEL?1 細胞懸液 600 μl(2 ×105個/ml),待貼壁后換成600 μl 無血清培養基,上室加入HUVEC 200 μl(2×104個/ml),培養24 h后,0.1%結晶紫染色。于200倍相差顯微鏡下拍照,計數5 個視野下的穿膜細胞數,取平均值作為遷移細胞數。侵襲實驗中Transwell 上室用Matrigel 膠包被,其余步驟同上,計數5 個視野下的穿膜細胞數,取平均值作為侵襲細胞數。
9.Matrigel 血管擬態實驗檢測細胞的管腔形成能力:實驗前 1 天使用 Matrigel 膠包被 Transwell 下室,取500 μl(2×104個/ml)HUVEC 接種在Matrigel膠上;上室加入各組A375 和SK?MEL?1 細胞 200 μl(2 × 105個/ml),37 ℃、5% CO2培養箱培養 6 h,于200 倍相差顯微鏡下拍照,計數5 個視野下分支節點數,取平均值作為各組細胞的分支節點。
10.Western 印跡檢測 NOP14、VEGF 和 VEGFR在各組細胞中的表達:收集各組A375 和SK?MEL?1細胞(約106個),RIPA 裂解液提取總蛋白。按照文獻[7]中方法檢測NOP14、VEGF 和VEGFR 在各組細胞中的表達,并利用美國Media Cybernettics 公司的 Image Pro?Plus 6.0 軟件分析 Western 印跡的條帶灰度值,目的蛋白的相對表達量= 目標蛋白灰度值/內參蛋白灰度值。
11.ELISA 檢測培養基上清液中VEGF 和VEGFR 的含量:收集各組細胞的培養基上清液,按照人VEGFB 和VEGFR 1/Flt1 ELISA 試劑盒說明書檢測VEGF和VEGFR的含量。
12.統計處理:應用SPSS 19.0 軟件,計量資料以表示,采用線性回歸模型分析黑素瘤組織中NOP14 表達水平與MVD 的關系,多因素方差分析檢驗細胞增殖活性的差異,獨立樣本t檢驗分析兩組間實驗指標的差異。以P<0.05 為差異有統計學意義。
結果
1.黑素瘤組織中NOP14 表達和CD31 表達的相關性:免疫組化檢測NOP14 和CD31 表達的代表圖見圖1。NOP14 高表達組(20 例)CD31 相對表達水平(MVD)為44±13,中表達組(17例)為58±16,低表達組(3 例)為62 ± 11。相關性分析顯示,NOP14 表達和 MVD 呈負相關(r= -0.525,P=0.017),見圖2。
2.NOP14 過表達和RNA 干擾驗證:見圖3。與siNC 組相比,siNOP14 組 A375 和 SK?MEL?1 細胞中NOP14 mRNA(t值分別為25.00、40.92,均P< 0.01)及蛋白表達水平(t值分別為3.76、4.16,均P< 0.01)均顯著降低,說明NOP14 被成功沉默。與空載體組相比,NOP14組A375和SK?MEL?1細胞中NOP14的mRNA(t值分別為4.06、5.35,P< 0.05、0.01)和蛋白表達水平(t值分別為4.30、4.35,均P< 0.01)顯著升高,且可以檢測到相對分子質量為126 000 的NOP14 和 EGFP 的融合蛋白,說明 NOP14 已成功過表達。
3.NOP14 對黑素瘤細胞 VEGF 和 VEGFR 表達的影響:Western 印跡檢測(圖4)顯示,與空載體組相比,NOP14 組 A375 和 SK?MEL?1 細胞中 VEGF(t值分別為 5.60、2.91,P值分別 < 0.01、0.05)和VEGFR 的表達水平顯著降低(t值分別為3.18、3.38,均P< 0.05);與siNC 組相比,siNOP14組A375和SK?MEL?1 細胞中 VEGF(t值分別為 15.81、3.88,P值分別 < 0.01 和 0.05)和 VEGFR(t值分別為3.97、3.46,均P< 0.01)表達水平顯著增加。ELISA結果(圖5)顯示,與空載組相比,NOP14 組A375 和SK?MEL?1 細胞培養基中 VEGF(t值分別為 224、113.7,均P< 0.01)和 VEGFR(t值分別為 59.12、22.16,均P< 0.01)含量顯著降低;與siNC 組相比,siNOP14 A375 和 SK?MEL?1 細胞培養基中 VEGF(t值分別為30.91、121.20,均P< 0.01)和VEGFR 的含量顯著增加(t值分別為14.45、14.23,均P< 0.01)。
4.NOP14 對 HUVEC 增殖能力的影響:見圖 6。與 A375 或 SK?MEL?1 空載體共培養組相比,A375或SK?MEL?1 NOP14共培養組HUVEC 的A450值在培養后第1、2、3 和4 天均顯著降低,不同時間的增殖活性差異有統計學意義(F值分別為168.61、172.37,均P< 0.01),不同分組間增殖活性差異亦有統計學意義(F值分別為131.85、189.10,均P<0.01),分組和時間存在交互作用(F=28.08、35.44,均P< 0.01)。與 A375 或 SK?MEL?1 siNC 共培養組相比,A375 或者 SK?MEL?1 siNOP14 共培養組HUVEC 的A450 值在培養后第 1、2、3 和 4 天均顯著升高,不同時間共培養組HUVEC 細胞的增殖活性差異有統計學意義(F值分別為477.76、394.20,均P< 0.01),不同分組間差異亦有統計學意義(F值分別為79.92、157.02,均P< 0.01),分組和時間存在交互作用(F值分別為9.95、17.89,均P< 0.01)。
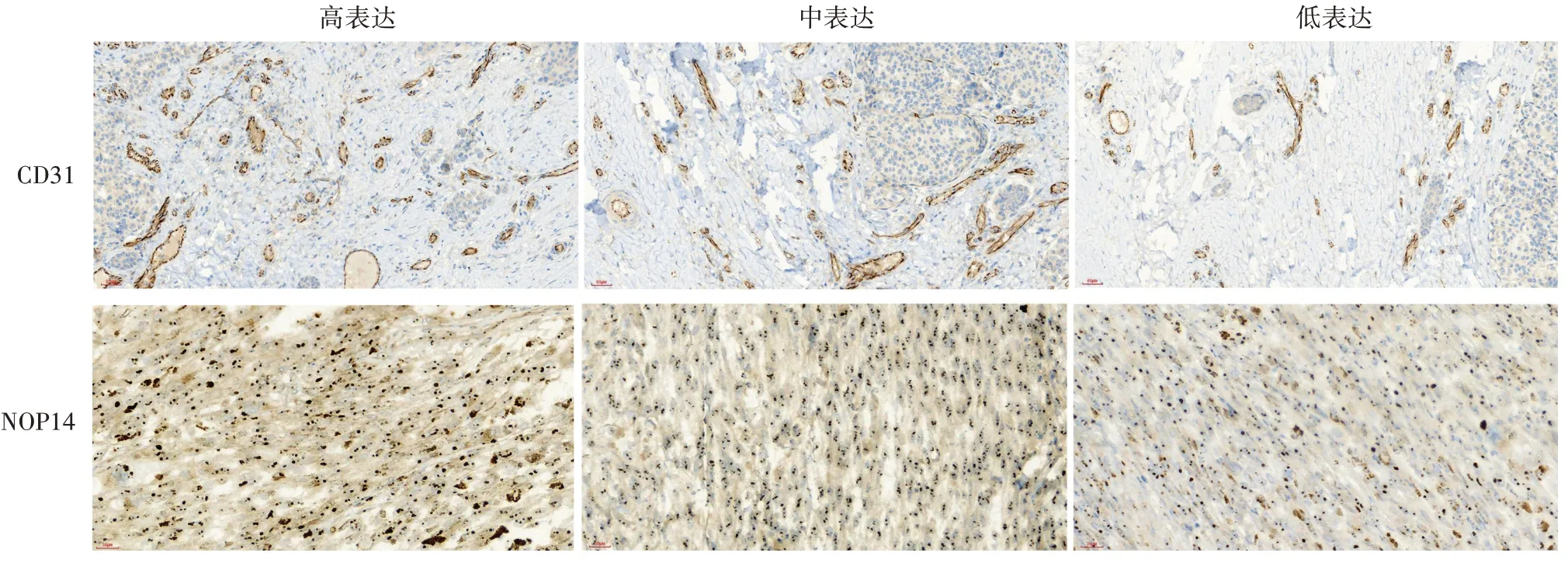
圖1 免疫組化檢測黑素瘤組織中核蛋白14(NOP14)和CD31的表達(×200)

圖2 40 例黑素瘤組織中核蛋白14(NOP14)與CD31 表達量(微血管密度)的相關性分析

圖3 實時PCR和Western印跡分別檢測轉染核蛋白14過表達載體(NOP14 組)或者siNOP14(siNOP14 組)后 A375 和SK?MEL?1 細胞中NOP14 mRNA(3A)和蛋白(3B、3C、3D)表達水平 NOP14組和siNOP14 組細胞NOP14 分別被成功過表達和沉默。siNC:陰性對照siRNA;siNOP14:靶向NOP14 的siRNA;GAPDH:甘油醛-3-磷酸脫氫酶。n=3,a:P < 0.05
5.NOP14 對HUVEC 遷移和侵襲能力的影響:見圖7。與A375 空載體共培養組HUVEC 相比,A375 NOP14 共培養組HUVEC 的遷移和侵襲細胞數顯著降低(遷移:22 ± 5 比 63 ± 8,t= 7.07,P=0.002;侵襲:14 ± 5 比45 ± 10,t=4.94,P=0.008)。與 A375 siNC 共培養組 HUVEC 相比,A375 siNOP14 共培養組HUVEC 的遷移和侵襲細胞數顯著增加(遷移:152 ± 30 比 59 ± 4,t= 5.36,P=0.006;侵襲:134 ± 21比50 ± 8,t=6.40,P=0.003)。與不同組SK?MEL?1細胞共培養后,HUVEC 遷移和侵襲能力的變化趨勢和與A375細胞共培養一致。
6.NOP14 對HUVEC 管腔形成能力的影響:見圖 8。與 A375 或 SK?MEL?1 空載體共培養 組HUVEC 相比,A375 或 SK?MEL?1 NOP14 共培養組HUVEC 形成的分支節點數顯著降低(A375:8 ± 2比14 ± 3,t= 5.06,P< 0.001;SK?MEL?1:11 ± 1 比19 ± 3,t= 6.93,P< 0.001)。與 A375 或 SK?MEL?1 siNC 共培養組 HUVEC 相比,A375 或 SK?MEL?1 siNOP14 共培養組HUVEC 形成的分支節點數顯著增加(A375:27 ± 3 比15 ± 4,t= 6.10,P< 0.001;SK?MEL?1:28 ± 4比16 ± 2,t=7.25,P< 0.001)。
討論
2012 年的一項調查顯示,在較發達地區黑素瘤的發病率和死亡率分別為9.3/10 萬和1.2/10 萬,欠發達地區分別為 0.7/10 萬和 0.3/10 萬[10]。據估計,2015 年在美國有73 870 例新病例被診斷,并有9 940 人將死于黑素瘤[11?12]。我國等亞洲國家的黑素瘤發病率與歐美國家相比較低,但發病率增長較快。2003—2007 年中國44 個腫瘤登記地區黑素瘤發病率合計為0.49/10萬,死亡率合計為0.24/10萬[13]。與1988 年相比,2007 年北京市和上海市黑素瘤發病率和死亡率明顯上升[13]。轉移是導致黑素瘤患者死亡的重要原因,一旦發生轉移其5 年生存率大約只有16%[14],中期生存時間大約只有11 個月[15]。因此,如何抑制黑素瘤的轉移是目前亟待突破的關鍵問題。

圖4 Western 印跡檢測轉染核蛋白14(NOP14)過表達載體(NOP14 組)或者NOP14 siRNA(siNOP14 組)對A375 和SK?MEL?1 細胞中血管內皮生長因子(VEGF)和VEGF受體(VEGFR)表達水平的影響 4A:代表性電泳圖譜;4B:蛋白相對表達量統計結果。siNC:陰性對照siRNA;siNOP14:靶向NOP14 的siRNA。n = 3,a:P < 0.05圖5 ELISA 檢測轉染核蛋白14(NOP14)過表達載體(NOP14 組)或者NOP14 siRNA(siNOP14 組)后A375 和SK?MEL?1 細胞培養基中血管內皮生長因子(VEGF)和VEGF 受體(VEGFR)表達水平 siNC:陰性對照siRNA;siNOP14:靶向NOP14 的siRNA。n=3,a:P < 0.05

圖6 CCK8 實驗分析核蛋白14(NOP14)對人臍靜脈內皮細胞(HUVEC)增殖能力的影響 與空載體共培養組相比,NOP14 共培養組HUVEC 增殖能力降低;與siNC 共培養組相比,siNOP14 共培養組HUVEC 增殖能力增強。siNC:陰性對照siRNA;siNOP14:靶向NOP14 的siRNA。n=3,a:P < 0.05
血管形成是黑素瘤轉移的關鍵環節[8]。研究顯示,癌組織中微血管增加可促進癌細胞的合成代謝,為腫瘤細胞的快速增長及物質代謝提供物質基礎[16]。MVD 越高,進入血循環的腫瘤細胞數及其誘發微血管形成的能力越強。因此研究腫瘤血管形成對了解惡性腫瘤發生、發展、侵襲和轉移的生物學行為和機制以及抗腫瘤血管形成有重要的理論意義和臨床應用價值。本研究結果表明,黑素瘤中NOP14 的表達水平和MVD(CD31 的表達)呈負相關,提示NOP14 可能在調控血管新生中發揮重要作用。隨后的細胞實驗表明,過表達NOP14 的黑素瘤細胞表達VEGF 和VEGFR 的能力明顯減弱,且干擾NOP14 表達的黑素瘤細胞表達VEGF 和VEGFR 的能力明顯增強。VEGF 可通過結合臨近血管內皮細胞表達的VEGFR 來啟動腫瘤血管新生,在腫瘤的血管新生過程中扮演重要角色[17]。這些結果表明,NOP14 可能通過調控腫瘤細胞VEGF分泌影響臨近血管內皮細胞的血管再生能力。通過建立黑素瘤細胞和血管內皮細胞HUVEC 的Transwell共培養模型,我們發現過表達NOP14的黑素瘤細胞可明顯抑制HUVEC的增殖、遷移、侵襲和管腔形成能力,反之干擾NOP14 表達的黑素瘤細胞則可明顯促進HUVEC的增殖、遷移、侵襲和管腔形成能力。既往研究表明,血管內皮細胞增殖、遷移、侵襲和管腔形成能力的增強是血管新生的必備條件[18]。因此,我們推測,NOP14 在調控血管新生中發揮重要作用,NOP14可以作為抑制黑素瘤血管新生的潛在重要靶點。

圖7 Transwell 實驗檢測核蛋白14(NOP14)對人臍靜脈內皮細胞(HUVEC)遷移和侵襲能力的影響 與空載體共培養組相比,NOP14 共培養組HUVEC 遷移和侵襲能力降低;與siNC 共培養組相比,siNOP14 共培養組HUVEC 遷移和侵襲能力增強。siNC:陰性對照siRNA;siNOP14:靶向NOP14 的siRNA

圖8 Matrigel 血管擬態實驗檢測核蛋白14(NOP14)對人臍靜脈內皮細胞(HUVEC)管腔形成能力的影響 與空載體共培養組相比,NOP14 共培養組HUVEC 管腔形成能力降低;與siNC 共培養組相比,siNOP14 共培養組HUVEC 管腔形成能力增強。siNC:陰性對照siRNA;siNOP14:靶向NOP14 的siRNA
我們首次提出NOP14 參與調控腫瘤血管新生,NOP14可以抑制黑素瘤血管新生。NOP14在其他腫瘤中的作用可以從另一個方面支持我們的結論[4]。以往研究表明,過表達NOP14可以明顯抑制黑 素 瘤 細 胞 的 遷 移 和 侵 襲 能 力[6?7],且 過 表 達NOP14 能夠抑制乳腺癌腫瘤的發生和轉移[4],同樣發揮抑制腫瘤惡化的作用。這些結果表明,NOP14在調控腫瘤的發生發展中可能發揮重要的作用,但其具體作用需要進一步探討。
雖然蛋白融合技術是蛋白研究中常用的實驗技術,但融合的EGFP 可能會影響目標蛋白質的折疊,進而影響其功能的發揮。我們的實驗結果證明融合EGFP 后NOP14 可以明顯影響黑素瘤細胞的功能,且與干擾NOP14 表達的功能相反,說明融合EGFP 對NOP14 的功能沒有本質上的改變。但是,仍可能存在其他影響,這是本文的缺陷之一。另外,瞬時轉染的穩定性不如慢病毒感染,可能會影響本文結論的可靠性,我們將在后續實驗中采用慢病毒感染構建穩定低表達或者過表達NOP14 的細胞株的方式進一步驗證本文的結論。
總之,本研究表明,NOP14 在調控黑素瘤的血管新生中發揮重要作用,該結果進一步明確了NOP14在調控黑素瘤發生發展中的作用,并將為抗腫瘤血管新生藥物的研發提供新的理論基礎。將來我們將驗證NOP14 和其他血管新生標志物(如CD34和CD105)表達的相關性,分析NOP14和血管新生標志物的相關性在不同類型的黑素瘤組織中是否存在差異,進一步明確NOP14 和黑素瘤血管新生的關系。
利益沖突所有作者均聲明不存在利益沖突

