通過對比NSG小鼠探討正常免疫小鼠人結腸癌移植瘤模型的特點和意義
程姝敏,張 凱,諶 通,畢研貞,劉銅軍,孔令斌,唐慧昕,王全義,洪 豐*,舒振鋒
(1.濟寧醫學院臨床學院,山東 濟寧272000;2.吉林大學第二醫院;3.吉林大學中日聯誼醫院;4.首都醫科大學附屬北京佑安醫院;5.濟寧醫學院附屬醫院;6.上海美峰生物技術有限公司)
CDX(cell-line-derived xenograft)模型是將人腫瘤細胞系接種到免疫缺陷小鼠體內構建的模型[1],此模型均是以裸鼠、NSG小鼠等為實驗動物,具有人腫瘤細胞遺傳、分子、形態結構等方面的特征,能反映人腫瘤遺傳多樣性[2,3],但因為缺少正常免疫系統,難以確切、真實地反映腫瘤發生、發展與患者免疫功能變化之間的內在聯系。此實驗借助新型微載體材料,在具有正常免疫系統C57BL/6小鼠背部種植人源性結腸癌細胞,同樣方法種植于NSG小鼠背部,通過比較兩種小鼠的成瘤情況及腫瘤病理特點等,探討具有正常免疫功能C57BL/6小鼠人結腸癌移植瘤模型構建及其意義。此模型的成功構建為揭示結腸癌發病機制和研制抗結腸癌新藥提供了更合適的模型。
1 材料與方法
1.1 微載體、細胞系
微載體:新型微載體microcarrier 6是由美國 ELYON BIOTECHNOLOGIES LLC公司提供的具有低免疫原性、生物兼融性等特點的多孔支架(圖1 A)[4]。細胞系:人結腸癌HCT116細胞貼壁培養于由Sigma公司生產的RPMI-1640 DMEM和10%國產胎牛血清的完全培養液(圖1 B)。
1.2 實驗動物C57BL/6小鼠20只,6-8周齡,22-25 g體質量,雄性小鼠;NSG小鼠20只,6-8周齡,22-25 g體質量,雄性小鼠,均購自濟南朋悅實驗動物繁育有限公司。飼養于無特定病原體(specific pathogen-free,SPF)級實驗動物中心,整個試驗過程均符合實驗室動物護理和使用委員會指南的要求。
1.3 C57BL/6、NSG小鼠人結腸癌模型的分組及建立將C57BL/6、NSG小鼠分別按移植物的不同分為細胞對照組、細胞-微載體復合物實驗組,每組各10只。C57BL/6、NSG小鼠均按照以下要求接種于背部皮下:對照組每只小鼠接種含2×107個/mL HCT116細胞PBS液100 μl;實驗組每只小鼠接種含2×107個/mL HCT116細胞和20 μg微載體的復合物懸液100 μl。細胞-微載體復合物(圖1 C)是由對數生長期HCT116細胞與處理修飾后的微載體混合而成,調整細胞及微載體濃度后,為使微載體內細胞達到飽和,放于5%CO2、37℃培養箱中培養24 h。
1.4 C57BL/6、NSG小鼠腫瘤生長觀察指標皮下注射移植物后每日觀察小鼠的食欲、活動度及體質量變化,記錄成瘤時間、瘤體大小和成瘤率[5]。接種后4周處死荷瘤小鼠,常規解剖,記錄腫瘤的體積、質地、浸潤以及壞死程度。移植瘤病理組織行常規HE染色、免疫組化染色,一抗CDX-2、CEA均由福州邁新生物技術開發有限公司提供。

圖1 A新型微載體microcarrier 6(100×);B人結腸癌HCT116細胞(200×);C細胞-微載體復合物(200×)
2 結果
2.1 C57BL/6、NSG小鼠生存及腫瘤生長情況
2.1.1C57BL/6小鼠生存及腫瘤生長情況 實驗組和對照組均無小鼠死亡。實驗組小鼠于13天開始,食欲、活動度較前減少,體質量較前增加;對照組小鼠食欲、活動度,體質量較前無顯著性差異。
實驗組C57BL/6小鼠共接種10只,8只成瘤,成瘤率達80%(圖2 A)。接種的第7-9天,背部可觸及腫瘤,13-17天肉眼可見背部皮下隆起腫塊,生長迅速,4周時,腫塊體積約0.6-1.1 cm3,生長曲線見圖3。形態相對規整,圓形或橢圓形,紅白相間,表面可見新生血管。對照組C57BL/6小鼠整個實驗過程中均未成瘤。
2.1.2NSG小鼠生存及腫瘤生長情況 實驗組NSG小鼠10只,無死亡;細胞對照組NSG小鼠10只,死亡1只。實驗組、對照組小鼠均于5天開始,食欲、活動度較前減少,體質量較前增加。
實驗組NSG小鼠9只成瘤,成瘤率達90%(圖2 B);對照組共接種10只,死亡1只未成瘤,余均成瘤,成瘤率達90%。實驗組、對照組均于接種的第5-7天,背部可觸及腫瘤。10-15天肉眼可見背部皮下隆起腫塊,生長迅速,4周時,腫塊體積約0.8-1.3 cm3,生長曲線見圖3,形態相對規整,圓形或橢圓形,紅白相間,表面可見新生血管。
2.2 C57BL/6、NSG小鼠病理組織學檢查
C57BL/6、NSG小鼠病理組織學均表現為:移植瘤包膜完整,易與周圍組織分離,形態多樣,以橢圓形為主,表面見新生血管網(圖2 C)。光鏡下可見大量核大深染的異型性細胞雜亂排列,染色質呈粗顆粒狀,核仁明顯,核分裂像增多,并向周圍組織浸潤生長,腫瘤邊緣見新生血管生成,中央偶見壞死(圖4A、4B)。實驗組腫瘤組織內偶見未被清除的少量殘余微載體(圖4 C)。

圖2 A C57BL/6荷瘤小鼠;B NSG荷瘤小鼠;C 移植瘤
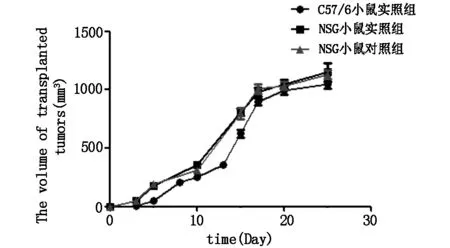
圖3 移植瘤生長曲線
2.3 免疫組化檢測結果
免疫組化染色示CDX-2、CEA均為陽性表達(圖5A、5B),染色結果判定:陽性顆粒定位于腫瘤細胞質內,陽性細胞數≤5%為陰性(-),陽性細胞數≥5%為(+),證實異型細胞為人源性結腸癌細胞(圖5)。

圖4 移植瘤HE染色 A移植瘤(100×);B移植瘤(200×);C移植瘤(200×)箭頭:殘余微載體。
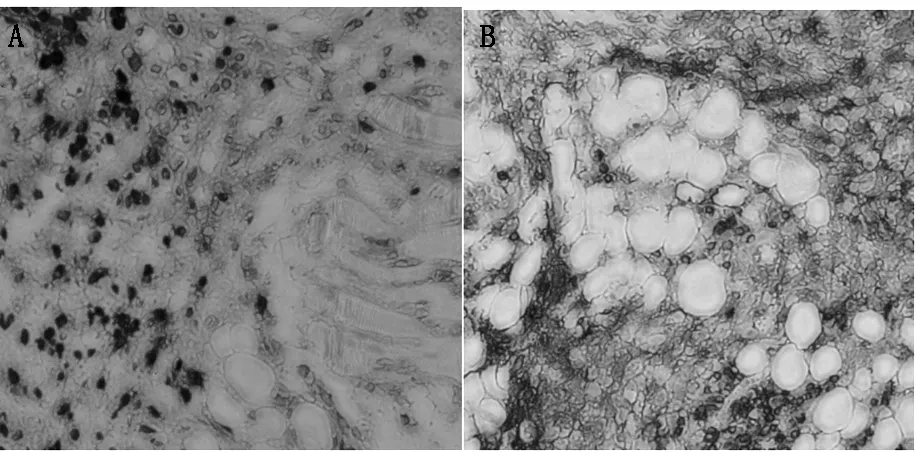
圖5 移植瘤免疫組化染色(200×) A:CDX-2;B:CEA
3 討論
目前國內外常用于研究腫瘤的動物模型有CDX模型和人源腫瘤異種移植(patient-derived xenograft,PDX)模型[6]。這些模型均采用免疫缺陷小鼠,其中NSG小鼠為免疫缺陷程度最高的小鼠,對異源性細胞幾乎沒有排斥反應,是最適合異源性移植的工具鼠[7]。然而腫瘤的發生發展與機體免疫力密切相關,該模型鼠缺少免疫系統,不能闡明腫瘤形成過程中與宿主免疫系統之間的相互影響,也無法篩選一些通過免疫功能激活的抗腫瘤藥物。
該實驗借助一種新型微載體—microcarrier6,成功構建了以正常免疫小鼠為動物模型的人結腸癌移植瘤模型,彌補了因免疫缺陷小鼠缺乏免疫細胞而不能準確模擬機體免疫系統對腫瘤的免疫攻擊等重要缺點。microcarrier6具備低免疫源性,可減小不同種屬間免疫相關沖突,大量腫瘤細胞以微載體為支架,聚集并快速生長,經膠原蛋白和SDF-1a修飾后,有利于新生血管深入微載體網狀結構內,為腫瘤的生長提供足夠的營養[8,9]。該實驗中,C57BL/6小鼠實驗組成瘤率可達80%,對照組均未成瘤,提示微載體具有屏障作用,能減少免疫系統對異源性結腸癌細胞的直接殺傷及/或排斥作用。同樣將結腸癌細胞系種植于NSG小鼠,實驗組與對照組均成瘤,成瘤率達90%,鏡下病理除實驗組偶有殘余微載體,其余結果兩組均一致,表明在免疫系統缺陷的情況下,無論是否存在microcarrier6,結腸癌細胞系均可在NSG小鼠移植部位成瘤。C57BL/6小鼠與NSG小鼠相比,雖然成瘤速度慢,但鏡下病理組織均表現為大量核大深染的異型腫瘤細胞雜亂排列,并向周圍組織浸潤生長,腫瘤邊緣見新生血管生成,中央偶見壞死。免疫組化示CDX-2、CEA均為陽性表達,證實異型細胞為人源性結腸癌細胞。
綜上所述,本實驗借助新型材料—微載體,成功構建了正常免疫小鼠的結腸癌移植瘤模型,此方法成瘤率高、操作簡單,可重復性強,為研究結腸癌發病機制和臨床抗腫瘤藥物篩選,尤其是免疫抗腫瘤藥篩選以及抗結腸癌新藥的研發提供了新的更理想的動物移植瘤模型。

