重組人粒細胞集落刺激因子治療IVF-ET不明原因反復種植失敗患者的效果研究
劉 珊,魏蕊霞,于曉惠,從 幸,劉榮娜,楊 波
盡管體外受精-胚胎移植(in vitro fertilization and embryo transfer, IVF-ET)技術使很多不孕患者獲得子代,但是仍然有約10%的患者經歷著反復種植失敗。因此,不明原因反復種植失敗(unexplained repeated implantation failure, uRIF)是目前急需解決的一大難題[1]。uRIF是指≥3次胚胎移植中至少有一個優質胚胎或多次胚胎移植累計移植胚胎數超過10枚仍未獲得臨床妊娠,而未發現任何影響胚胎移植的全身因素和子宮局部因素[2-3]。盡管反復移植失敗病因復雜多樣,但是生殖專家一直在努力尋找其病因及解決辦法,如宮腹腔鏡檢查除外子宮內外環境、胚胎移植時間調整、應用各種藥物改善子宮內膜容受性等,而療效并不顯著[4-5]。人粒細胞集落刺激因子(granulocyte colony stimulating factor, G-CSF)是一種正向調節粒系細胞分化的細胞因子,可一定程度促使其分化、增殖,還可調節Th1/Th2平衡[6-7]。事實上,G-CSF還可作用于人體內的多種成熟細胞,參與其正常生理功能的發揮。研究發現,G-CSF在人妊娠過程中具有非常重要的作用,它參與了人卵泡、胎盤及子宮內膜的生長發育,是胚胎著床過程中非常重要的一種細胞因子[8-9]。故本研究擬對uRIF患者胚胎移植前及移植后第3、5日分別皮下注射重組人粒細胞集落刺激因子(recombinant human granulocyte colony stimulating factor, rh G-CSF),旨在觀察rh G-CSF對uRIF患者療效。
1 對象與方法
1.1 對象及分組 本研究選擇2018年1月—2019年4月因輸卵管因素或男方因素在我院生殖醫學科行IVF-ET的uRIF患者120例。納入標準:①取卵年齡≤38歲;②既往經歷3個移植周期,每周期均移植1~2個優質胚胎未獲妊娠者,此次為第四次凍融胚胎移植(frozen embryo transfer, FET);③至少剩余2個胚胎(卵裂期或囊胚期胚胎)凍存,其中有≥1個優質胚胎。排除標準:①既往子宮內膜厚度≤8 mm,伴子宮內膜息肉、宮腔積液、輸卵管積水者;②有內分泌及代謝紊亂、血栓形成傾向或抗磷脂綜合征者;③剩余胚胎<2個。所有患者根據藥物治療方法的不同均分為觀察組和對照組。兩組取卵年齡、不孕年限、體質量指數及移植日子宮內膜厚度等比較差異均無統計學意義(P>0.05),具有可比性。見表1。本研究獲醫院倫理委員會批準同意。

表1 不同藥物治療的體外受精-胚胎移植不明原因反復種植失敗兩組基本情況比較
注:觀察組為予重組人粒細胞集落刺激因子聯合常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組,對照組為僅予常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組
1.2 治療方法 月經規律患者選擇自然排卵周期行FET,從月經第10日開始監測卵泡和內膜,當卵泡直徑≥18 mm或內源性促黃體生成素(LH)>20 mU/ml時,應用人β絨毛膜促性腺激素(β-HCG)6000 U誘導排卵,并行內膜轉換,排卵后第3日或第5日行FET。月經周期紊亂者行激素替代周期或促排卵周期FET,激素替代周期FET者從月經來潮第3日起予戊酸雌二醇片(廣州拜耳醫藥保健有限公司生產,國藥準字:J20130009)每次1 mg、每日2次口服,每4日增加戊酸雌二醇片2 mg直至最大劑量12 mg/d,待子宮內膜厚度≥8 mm時予內膜轉化,同時檢測血雌激素(E2)和孕酮(P)水平,內膜轉化后第3日或第5日予FET;促排卵周期FET者從月經來潮第3日起予來曲唑(江蘇恒瑞醫藥股份有限公司生產,國藥準字:H19991001)2.5 mg/d口服,連用5 d,后聯合或不聯合應用人絕經期促性腺激素(麗珠集團麗珠制藥廠生產,國藥準字:H10940097)75~150 U/d和(或)戊酸雌二醇片2~4 mg/d,超聲監測卵泡大小和子宮內膜厚度,當卵泡直徑≥18 mm或內源性LH>20 mU/ml時,應用β-HCG 6000 U誘導排卵,并行內膜轉換,排卵后第3日或第5日行FET。
對照組在FET期間僅行常規黃體支持,排卵周期黃體支持方案為黃體酮軟膠囊[博賞醫藥咨詢(上海)有限公司生產,注冊證號:H20160265] 陰道給藥,每次200 mg、每日1次,聯合地屈孕酮片[雅培貿易(上海)有限公司生產,注冊證號:H20170221]口服,每次20 mg、每日2次;激素替代周期黃體支持方案為黃體酮軟膠囊陰道給藥,每次200 mg、每日2次,聯合地屈孕酮片口服,每次20 mg、每日2次。移植后12~14 d查血β-HCG,陰性者停藥,陽性者繼續用藥至移植后8~10周。觀察組在對照組治療基礎上加用rh G-CSF治療,胚胎移植前1 h皮下注射rh G-CSF(華北制藥金坦生物技術股份有限公司生產,國藥準字:S19991017)300 U,胚胎移植后第3、5日分別皮下注射rh G-CSF 150 U。
1.3 觀察指標 觀察兩組此次FET的生化妊娠率、臨床妊娠率、胚胎種植率、流產率,以及不良反應和預后。生化妊娠率=生化妊娠周期數/移植周期總數×100%,臨床妊娠率=臨床妊娠總數/移植周期總數×100%,胚胎種植率=著床胚胎總數/胚胎移植總數×100%,流產率=流產的周期總數/臨床妊娠周期總數×100%。移植后第12日或第14日血β-HCG>25 mU/ml為生化妊娠,移植后4周超聲下看到孕囊為臨床妊娠。
2 結果
2.1 兩組子宮內膜準備過程中E2、LH及P水平比較 內膜準備過程中自然周期、促排卵周期兩組排卵日E2、LH及P水平和人工周期內膜轉化日E2及P水平比較差異均無統計學意義(P>0.05),見表2。
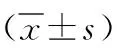
表2 不同藥物治療的體外受精-胚胎移植不明原因反復種植失敗兩組內膜準備過程中E2、LH及P比較
注:觀察組為予重組人粒細胞集落刺激因子聯合常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組,對照組為僅予常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組;LH為促黃體生成素、E2為雌激素、P為孕酮,且自然周期和促排卵周期均為排卵日數據,人工周期為內膜轉化日數據;自然周期觀察組28例、對照組30例,促排卵周期觀察組12例、對照組14例,人工周期觀察組20例、對照組16例
2.2 兩組移植胚胎情況比較 兩組此次移植胚胎類別、移植胚胎數及優質胚胎數比較差異均無統計學意義(P>0.05),見表3。

表3 不同藥物治療的體外受精-胚胎移植不明原因反復種植失敗兩組移植胚胎情況比較
注:觀察組為予重組人粒細胞集落刺激因子聯合常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組,對照組為僅予常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組
2.3 兩組臨床結局比較 觀察組生化妊娠率和臨床妊娠率均高于對照組,差異均有統計學意義(P<0.05或P<0.01)。見表4。觀察組胚胎種植率為39.7%(46/116)高于對照組胚胎種植率26.9%(28/104),差異有統計學意義(χ2=3.982,P=0.048),但觀察組和對照組流產率分別為14.7%(5/34)、20.0%(4/20),比較差異無統計學意義(χ2=0.247,P=0.633)。

表4 不同藥物治療的體外受精-胚胎移植不明原因反復種植失敗兩組臨床結局比較[例(%)]
注:觀察組為予重組人粒細胞集落刺激因子聯合常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組,對照組為僅予常規黃體支持治療的體外受精-胚胎移植不明原因反復種植失敗患者組
2.4 不良反應及預后 觀察組僅2例出現輕微發熱(<38℃),第2日自行緩解,無其他不良反應。對照組中3例移植后成功妊娠,但孕近2個月時胚胎停育,行清宮術,胚胎絨毛染色體無異常;1例胚胎移植后輸卵管妊娠,腹腔下切除患者輸卵管。觀察組中4例移植后成功妊娠,孕近2個月時胚胎停育,行清宮術,胚胎絨毛染色體無異常;1例自然流產,未行清宮術。
3 討論
胚胎植入是一個成功的半同種移植,其成功有賴于發育潛能高的胚胎、良好的子宮內膜及母體對胚胎的免疫耐受[10]。胚胎來源的滋養層細胞向母體子宮內膜的遷移、浸潤是正常胚胎植入及胎盤形成的關鍵環節[11]。由于G-CSF受體主要存在于胎盤組織和滋養層細胞,因此推測G-CSF可能具有調節滋養層細胞植入和維持早期妊娠的作用[12-13]。子宮內膜中的T細胞主要分布于功能層,包含豐富的T細胞亞群。CD4+ T細胞激活后按分泌細胞因子譜分為Th1型和Th2型兩個功能亞群。大量研究表明,Th1型細胞介導的免疫應答不利于妊娠,而Th2型細胞介導的免疫應答有利于妊娠[14-15]。體內外實驗證實,G-CSF不斷重復刺激能維持G-CSF受體在CD4+ T細胞上的表達量[16],這可能是G-CSF對T細胞免疫調節的重要機制。G-CSF抑制T細胞的異種反應性,使T細胞處于免疫低反應狀態。G-CSF可以誘導T細胞的應答不足并促進T細胞由Th1型向Th2型分化[17-18]。因此,子宮內膜局部的免疫異常可能是導致uRIF的原因。
反復種植失敗病因非常復雜,涉及范圍較為廣泛,主要包括配子或胚胎質量及其發育潛能、子宮內膜容受性和局部免疫狀態等多個方面。對于uRIF患者而言,雖然治療方法多種多樣,如各種藥物及子宮內膜輕微搔刮術改善內膜容受性和淋巴細胞主動免疫治療調節母體免疫等,但是療效并不顯著[19]。2009年Scarpellini和 Sbracia[20]首次提出對患有復發性流產(recurrent spontaneous abortion, RSA)的夫婦孕前應用rh G-CSF直到孕19周,治療組的妊娠率和活產率顯著高于對照組,且新生兒未發現明顯的畸形。2013年,Gleicher等[21]對體外受精且有RSA史患者應用G-CSF獲得較好的妊娠結局。
本研究內膜準備過程中兩組E2、LH及P水平無明顯差異,移植日子宮內膜厚度差異亦無統計學意義;觀察組較對照組明顯提高了生化妊娠率、臨床妊娠率和胚胎種植率。兩組移植胚胎數目及優質胚胎數均無差異,推測可能是母胎界面免疫細胞因子調節,促進滋養層細胞增殖和侵襲,改善了子宮內膜局部免疫所致。已有研究證實,G-CSF可刺激自然移植物的細胞滋養細胞增殖并抑制其凋亡,在G-CSF的作用下滋養細胞偽足增多、變長,侵襲能力增強[22]。故G-CSF對母胎界面具有雙向調節作用,一方面對免疫細胞具有一定抑制作用,另一方面對滋養細胞生物學功能具有很好的促進作用[23]。
G-CSF經靜脈或皮下注射后主要分布在腎臟、骨髓和血漿中,以氨基酸代謝途徑被降解,并主要由尿排泄。本藥在腫瘤領域中應用已近20年,尚未出現明顯不良反應和致畸報道。Scarpellini和Sbracia[20]對35例RSA患者在妊娠前及妊娠期間皮下應用G-CSF達9周,并未發現嚴重不良反應和胎兒先天性異常。目前研究表明,在安全劑量范圍內應用G-CSF不影響母體健康及胎兒健康;無論哪種給藥方法, 用藥48 h后檢測尿中藥物濃度及血中藥物濃度均在臨界值以下[24]。但是G-CSF靜脈及皮下注射時可能存在一些風險及輕微不良反應,如腰痛、胸痛、骨痛、發熱、頭痛、倦怠、心悸等不適,偶有皮膚發紅、皮疹、食欲不振、惡心、嘔吐等消化道反應及肝損害等。對于出現疼痛者可口服吲哚美辛或肌內注射異丙嗪對癥治療,余不適無需特殊處理[25]。本研究觀察組中僅2例出現發熱,均低于38℃,第2日自行緩解,余患者無其他不適。
總之,rh G-CSF能改善uRIF患者再次解凍移植的妊娠結局,且應用安全性較好。但因本研究樣本量較少,未研究rh G-CSF對胚胎植入的作用機制,將來需設計更加嚴謹的隨機對照研究探討rh G-CSF在生殖免疫方面的作用和機制,以及其規范治療方案、給藥方式、嚴格的適應證及禁忌證。

