基于NALP3炎性體的痛風寧對急性痛風性關節炎大鼠抗炎作用量效和時效研究
王建輝 李保林 蔡唐彥 郭潔梅 朱亞菊 滕方舟 張藝強 肖艷 毛驍 蘇友新


摘要:目的? 觀察痛風寧對急性痛風性關節炎(AGA)大鼠NALP3炎性體及相關炎癥因子的影響,探討其抗炎作用的量效與時效關系。方法? 將240只SD大鼠隨機分為造模組200只和正常組40只。右后踝關節腔內注射尿酸鹽混懸液制作大鼠AGA模型,成模大鼠隨機分為模型組、秋水仙堿組及痛風寧低、中、高劑量組,每組40只。正常組和模型組大鼠給予等量生理鹽水灌胃,其余組大鼠給予相應藥物灌胃干預。首次干預后6、12、24、48 h各組隨機取10只大鼠處死,收集右后踝關節液與滑膜組織,采用ELISA、Western blot和RT-qPCR分別檢測白細胞介素-1β(IL-1β)、前列腺素E2(PGE2)含量及NALP3、ASC、Caspase-1蛋白和mRNA表達。結果? 與正常組比較,模型組大鼠各時間點IL-1β、PGE2含量及NALP3、ASC、Caspase-1蛋白和mRNA表達明顯升高(P<0.01);與模型組比較,痛風寧中、高劑量組及秋水仙堿組大鼠各時間點IL-1β、PGE2含量及NALP3、ASC、Caspase-1蛋白和mRNA表達均明顯降低(P<0.01,P<0.05);與秋水仙堿組比較,痛風寧中、高劑量組大鼠各時間點IL-1β、PGE2含量及NALP3、ASC、Caspase-1蛋白和mRNA表達無明顯差異(P>0.05),痛風寧低劑量組大鼠明顯升高(P<0.01,P<0.05)。結論? 中劑量痛風寧在下調模型大鼠NALP3、ASC、Caspase-1蛋白和mRNA表達及降低IL-1β、PGE2含量方面作用相對較佳,且首次干預后48 h抗炎作用相對明顯。
關鍵詞:痛風寧;NALP3炎性體;急性痛風性關節炎;量效;時效;大鼠
中圖分類號:R285.5 ???文獻標識碼:A??? 文章編號:1005-5304(2020)01-0051-06
DOI:10.3969/j.issn.1005-5304.201906101
Study on Tongfengning on Dosage Effect and Time Effect of Anti-inflammatory in Model Rats with Acute Gouty Arthritis Based on NALP3 Inflammasome
WANG Jianhui1, LI Baolin1, CAI Tangyan2, GUO Jiemei1,2, ZHU Yaju1, TENG Fangzhou1,ZHANG Yiqiang1, XIAO Yan1, MAO Xiao1, SU Youxin1,2
1. Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China;
2. Fuijiang Health College, Fuzhou 350101, China
Abstract: Objective To observe the effects of Tongfengning on NALP3 inflammasome and related inflammatory factors in acute gouty arthritis (AGA) rats; To explore the dosage effect and time effect of its anti-inflammatory effect. Methods Totally 240 SD rats were randomly divided into model rats (n=200) and normal rats (the normal group, n=40). The AGA model was made by intraperitoneal injection of urate suspension into the right posterior ankle joint of the rats. Model rats were randomly divided into model group, colchicine group and Tongfengning low-, medium- and high-dosage groups, with 40 rats in each group. Normal group and model group were given the same amount of normal saline for gavage, and other groups were given the corresponding medicine for gavage intervention. At 6 h, 12 h, 24 h, and 48 h after the first intervention, 10 rats in each group were sacrificed at each time point, and the right posterior ankle joint fluid and synovial tissue were collected. ELISA, Western blot, and RT-qPCR were used to detect the contents of interleukin-1β (IL-1β) and prostaglandin E2 (PGE2), and expressions of NALP3, ASC, Caspase-1 protein and mRNA. Results Compared with the normal group, the contents of IL-1β and PGE2, and the expressions of NALP3, ASC, Caspase-1 protein and mRNA increased in the model group at each time point (P<0.01); Compared
with the model group, the contents of IL-1β and PGE2, and the expressions of NALP3, ASC, Caspase-1 protein and mRNA significantly decreased in Tongfengning medium- and high-dosage groups at each time point (P<0.01, P<0.01); Compared with the colchicine group, the contents of IL-1β and PGE2, and the expressions of NALP3, ASC, Caspase-1 protein and mRNA were not significantly different in the Tongfengning medium- and high-dosage groups at each time point (P>0.05), while they increased significantly in Tongfengning? low-dosage group (P<0.01, P<0.05). Conclusion The medium dosage of Tongfengning is relatively better in down-regulating the expressions of NALP3, ASC, Caspase-1 protein and mRNA and decreasing the contents of IL-1β and PGE2, and its anti-inflammatory effects were relatively obvious 48 h after the first intervention.
Key words: Tongfengning; NALP3 inflammasome; acute gouty arthritis; dosage effect; time effect; rats
痛風是由于尿酸生成增多和/或尿酸排泄減少導致尿酸鹽(MSU)沉積所致的晶體相關性關節病[1]。臨床所見痛風多為急性痛風性關節炎(acute gouty arthritis,AGA)的狀態,發病急驟,多于深夜發作,受累關節及周圍組織紅、腫、熱、痛和功能受限均明顯,尤其是疼痛呈撕裂樣、刀割樣或咬噬樣,且進行性加劇[2],嚴重影響患者身心健康。痛風寧是本課題組在痛風“內濕致痹”發病觀[3]指導下組方并經臨床使用多年的效驗方,該方能明顯降低關節液中炎癥因子含量,減輕AGA動物模型關節炎癥反應[4-7]。前期研究發現,痛風寧可能通過下調核苷酸結合寡聚化結構域樣受體蛋白3(NALP3)炎性體中NALP3蛋白、凋亡相關斑點樣蛋白(ASC)和Caspase-1的表達,進而抑制下游炎癥因子的生成以減輕AGA炎癥反應[8],但其抗炎作用的量效與時效尚未完全闡明。本研究通過觀察不同劑量痛風寧干預AGA大鼠模型不同時間點NALP3、ASC、Caspase-1蛋白和mRNA表達,以及下游炎癥因子白細胞介素-1β(IL-1β)、前列腺素E2(PGE2)含量的變化,進一步探討痛風寧抗炎作用的量效與時效關系,為該方臨床應用提供依據。
1? 實驗材料
1.1? 動物
3月齡健康雄性SD大鼠240只,SPF級,體質量(200±20)g,上海斯萊克實驗動物有限責任公司提供,動物許可證號SCXK(滬)2012-0002。飼養于福建中醫藥大學實驗動物中心SPF級動物房,溫度(22±2)℃,相對濕度60%±10%,12 h/12 h明暗周期,自由攝食飲水。
1.2? 藥物及制備
痛風寧(土茯苓∶萆薢∶丹參∶川牛膝∶秦艽∶腫節風∶澤瀉∶金錢草∶蒼術∶黃柏=10∶5∶5∶4∶3∶5∶5∶7∶3∶2),飲片購自福建中醫藥大學附屬國醫堂醫院,藥物經煎煮、過濾、濃縮成含原藥材1 g/mL痛風寧藥液,置于4 ℃冰箱保存備用。秋水仙堿片,西雙版納藥業有限責任公司,0.5 mg/片,批號170302,用蒸餾水配制成0.04 mg/mL秋水仙堿混懸液,備用。
1.3? 主要試劑與儀器
MSU晶體(美國Sigma公司,批號BCBV0453),以無菌生理鹽水為溶劑,MSU晶體與聚山梨酯-80(吐溫80)以1500 mg∶6 mL配成25 mg/mL MSU混懸液,滅菌后4 ℃備用;大鼠IL-1β、PGE2 ELISA試劑盒(上海西唐科技有限公司,批號1710262、1710251),兔抗大鼠NALP3單克隆抗體(武漢博士德,批號84111P141),小鼠抗大鼠ASC單克隆抗體、兔抗大鼠Caspase-1單克隆抗體(上海圣克魯斯,SC-514414、22915-1-AP),β-actin小鼠單克隆抗體、HRP羊抗兔IgG、HRP羊抗鼠IgG(美國Proteintech公司,批號66009-1-IG、SA00001-2、SA00001-1),BCA蛋白濃度測定試劑盒(增強型)、Trizol(北京碧云天,批號040617170707、2017072402),超敏ECL化學發光試劑盒(美國Thermo公司,批號101316170228),ChamQ SYBR qPCR Master Mix、RNA Isolater Total RNA Extraction Reagent(南京Vezyme公司,L/N7E160F7、R12301)。RH-B-1-S25型磁力攪拌器(德國IKA公司),ELX800型全自動酶標儀(美國Bio-Tek公司),PowerPacTM型電泳儀、Yrdimes S-D Blotter型半干轉印系統、ChemiDocXRS化學發光成像系統(美國Bio-Rad公司),ABI 7500型Real-Time PCR儀(美國ABI公司),PE 9600型PCR擴增儀。
2? 實驗方法
2.1? 分組、造模和給藥
實驗大鼠適應性喂養7 d,采用隨機數字表法分為造模組200只和正常組40只。造模組參照Coderre等[9]方法造模,向大鼠右后踝關節腔內注射25 mg/mL MSU混懸液0.2 mL。于造模后4 h進行模型鑒定[10],成模大鼠隨機分為模型組、秋水仙堿組和痛風寧低、中、高劑量組,每組40只。正常組大鼠注射等量生理鹽水。參照人與大鼠體表面積換算法[11],按成人每日服用痛風寧劑量為中劑量,得痛風寧低、中、高劑量組大鼠每日給藥量分別為7.65、15.3、30.6 mL/kg,按成人秋水仙堿每日最大治療藥量6 mg,得秋水仙堿組每日大鼠給藥量為0.6 mg/kg,正常組和模型組給予等量生理鹽水灌胃,每日2次,連續2 d。
2.2? 一般觀察
觀察大鼠精神、飲食、行為、毛發、大便等。
2.3? 標本采集
首次干預后6、12、24、48 h,各組隨機選取10只大鼠,腹腔注射10%水合氯醛(3 mL/kg)麻醉,備皮,消毒。于冰上切開大鼠右后肢踝關節囊,生理鹽水沖洗,收集關節沖洗液于無菌EP管,離心,取上清液,-20 ℃冰箱保存。再取踝關節滑膜組織,置于無酶EP管,-80 ℃冰箱保存。取材完畢后,脫頸處死。
2.4? 白細胞介素-1β、前列腺素E2含量檢測
按ELISA試劑盒說明書進行操作,酶標儀測定450 nm波長處各反應孔OD值,計算關節液中IL-1β、PGE2含量。
2.5? NALP3、ASC、Caspase-1蛋白表達檢測
液氮中充分研磨滑膜組織,稱重,裝入EP管,按1 mg∶5 μL比例加入裂解液,冰上震蕩勻漿后,離心,取上清液。按BCA法操作測定總蛋白濃度。配好分離膠與濃縮膠,蛋白上樣按每孔30 μg計算上樣量,Marker上樣量為3 μL,上樣完成后進行凝膠電泳(20 V、10 min,60 V、20 min,100 V、80 min)。切取目的蛋白條帶,轉膜至PVDF膜。隨后將PVDF膜置于TBST中漂洗5 min,再置于封閉液中室溫封閉2 h;一抗4 ℃搖床孵育過夜(一抗稀釋比例:NALP3 1∶200;ASC 1∶200;Caspase-1 1∶5000;β-actin 1∶5000),TBST漂洗3次×10 min;二抗室溫孵育1 h,TBST 漂洗3次×10 min。PVDF膜進行化學發光顯影,并應用Image-Pro Plus軟件分析條帶灰度值,計算目的蛋白相應表達量。
2.6? NALP3、ASC、Caspase-1 mRNA表達檢測
液氮中充分研磨滑膜組織,按Trizol法提取組織總RNA。分光光度計測定樣品OD260 nm/OD280 nm值,計算每管RNA濃度。按試劑盒說明書進行反轉錄-聚合酶鏈反應合成cDNA,依次加入相應體積RNA溶液(按3 μg上樣量計算),再用ddH2O定容至18 μL,然后加入4×gDNA 6 μL至24 μL,混勻后離心,置于PCR儀(42 ℃、2 min),再加5×qRt Super Mix Ⅱ 6 μL至30 μL,蕩勻后離心,置于PCR儀(50 ℃、15 min,85 ℃、2 min)進行反轉錄。隨后進行RT-qPCR反應,擴增目的基因產物,條件:95 ℃、30 s預變性,95 ℃、10 s變性,60 ℃、30 s退火延伸,40個循環。計算ΔCt值,以2-ΔΔCt分析各基因相對表達量。從Gene bank查找目的基因CDS序列,利用Primer 5.0設計引物,并委托上海鉑尚生物技術有限公司合成,以β-actin為內參,引物序列見表1。
3? 統計學方法
采用SPSS20.0統計軟件進行分析。計量資料以±s表示,若服從正態分布,多重組間比較采用方差分析,兩兩比較采用LSD檢驗;若不服從正態分布,則采用非參數Kruskal-Wallis檢驗。P<0.05表示差異有統計學意義。
4? 結果
4.1? 一般狀況
正常組大鼠精神、飲食與大便等均無異常,活潑好動,皮毛光澤;模型組大鼠精神和飲食均欠佳,皮毛無光澤,慵懶不好動;痛風寧低劑量組大鼠精神略有疲倦,飲食削減,皮毛欠光澤,活動減少,大便正常;痛風寧中、高劑量組大鼠精神與活動尚可,飲食、大便正常,皮毛欠光澤;秋水仙堿組大鼠出現精神不佳,飲食銳減,皮毛干枯,慵懶不好動,大便稀溏等。
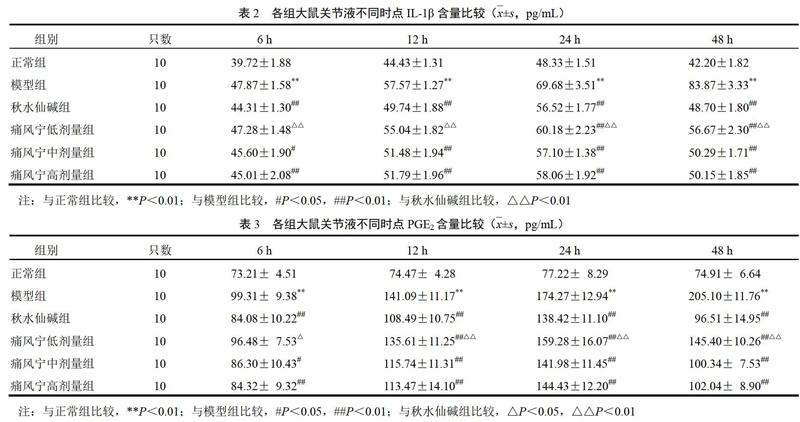
4.2? 痛風寧對大鼠關節液白細胞介素-1β、前列腺素E2含量的影響
與正常組比較,模型組大鼠各時點IL-1β、PGE2含量均明顯增加(P<0.01);與模型組比較,痛風寧中、高劑量組及秋水仙堿組大鼠各時間點IL-1β、PGE2含量明顯降低,差異有統計學意義(P<0.01,P<0.05);與秋水仙堿組比,痛風寧中、高劑量組大鼠各時間點IL-1β、PGE2含量無明顯差異,痛風寧低劑量組大鼠則明顯升高(P<0.01,P<0.05)。見表2、表3。
4.3? 痛風寧對大鼠關節滑膜組織NALP3、ASC、Caspase-1蛋白表達的影響
與正常組比較,模型組大鼠各時點NALP3、ASC、Caspase-1蛋白表達均明顯升高(P<0.01);與模型組比較,痛風寧中、高劑量組和秋水仙堿組大鼠各時間點NALP3、ASC、Caspase-1蛋白表達明顯降低(P<0.01,P<0.05);與秋水仙堿組比較,痛風寧中、高劑量組大鼠各時間點NALP3、ASC、Caspase-1蛋白表達無明顯差異,痛風寧低劑量組大鼠則明顯升高(P<0.01,P<0.05)。見表4~表6、圖1。
4.4? 痛風寧對大鼠關節滑膜組織NALP3、ASC、Caspase-1 mRNA表達的影響
與正常組比較,模型組大鼠各時間點NALP3、ASC、Caspase-1 mRNA表達均明顯升高(P<0.01);與模型組比較,痛風寧中、高劑量組和秋水仙堿組大鼠各時間點NALP3、ASC、Caspase-1 mRNA表達明顯降低(P<0.01,P<0.05);與秋水仙堿組比較,痛風寧中、高劑量組大鼠各時間點NALP3、ASC、Caspase-1 mRNA表達無明顯差異,痛風寧低劑量組表達明顯升高(P<0.01,P<0.05)。見表7~表9。
5? 討論
中醫歷代醫家對痛風急性發作期和慢性關節炎期的臨床表現頗有論述,常將其歸為“痹證”“歷節風”等范疇。但目前關于痛風病因病機的認識尚未一致,經課題組前期梳理總結,認為內生濕濁為痛風發病關鍵,“內濕”滋生稽留,郁久化熱,致氣血運行不暢則留瘀,濕濁瘀熱積滯,痹阻筋脈肢節,發為痛風。故針對痛風“內濕致痹”的病機特點,創制具有清熱利濕、消腫止痛功效的痛風寧。方中黃柏長于清下焦濕熱,蒼術長于燥濕健脾,二藥共奏清熱燥濕之功,加之川牛膝引藥下行,導濕外出,兼以活血通經,三藥合用謂之三妙丸,常用于濕熱下注之痹證;土茯苓、萆薢、澤瀉、金錢草皆有所長,共行利濕泄濁、清熱解毒、通利關節之功;丹參、秦艽、腫節風皆屬入血之品,共行清熱涼血、活血祛瘀、消腫止痛之功。諸藥合用以達標本兼治之效。
研究表明,固有免疫中NOD樣受體成員NALP3可感受到病原菌入侵及機體損傷信號,形成炎性體,引起免疫防御反應[12-13]。當細胞內無活性NALP3蛋白在識別MSU被激活后,募集ASC、Caspase-1蛋白形成NALP3炎性體,繼而活化的Caspase-1切割IL-1β前體生成IL-1β,并分泌到胞外,同時IL-1β激活COX-2,促進PGE2合成,引發關節局部紅、腫、熱、痛等,導致AGA發生[14-16]。可見,NALP3炎性體信號通路在痛風急性發作過程中發揮關鍵作用。
本研究發現,模型組大鼠IL-1β、PGE2含量增加及NALP3、ASC、Caspase-1蛋白和mRNA表達升高,且隨時間呈升高趨勢,而且痛風炎癥反應在一定時間內隨時間加重,這與AGA部分特征類似;痛風寧各劑量組及秋水仙堿組均可抑制NALP3炎性體相關蛋白合成,降低下游炎癥因子IL-1β、PGE2含量,表明痛風寧與秋水仙堿對該通路具有明顯抑制作用,或存在多靶點效應,可同時干預信號通路上下游。現代藥理研究表明,土茯苓有效成分總黃酮能減輕關節局部炎癥反應,消除關節腫脹,且其抗痛風關節炎作用與NALP3炎性體關系密切[17]。黃柏生物堿與蒼術糖苷類成分能抑制關節液中炎癥因子IL-1β和IL-6水平,減輕關節炎癥損傷,治療痛風效果良好[18]。同時,各劑量組在首次干預后48 h下調NALP3、ASC、Caspase-1蛋白和mRNA表達幅度以及減少IL-1β、PGE2含量明顯優于其余3個時點,說明痛風寧首次干預后48 h抗炎作用相對明顯。另外,各時點痛風寧中、高劑量對IL-1β、PGE2含量抑制與秋水仙堿比較無明顯差異,但低劑量抑制作用不佳;高劑量抗炎作用稍優于中劑量,可能因為高劑量藥物濃度較高,其抗炎效應短時間內快速發揮,隨著時間推移,藥物濃度達到飽和,抗炎效應達到峰值,這與我們觀察到痛風寧中、高劑量在12、24、48 h抗炎效應相當的現象一致。中藥復方中不同成分的藥理作用不同,如果單純增加劑量可能會出現藥理作用相互抵消,劑量過大或可出現嚴重毒副作用。鑒于用藥安全和療效,我們提出中劑量為痛風寧相對理想劑量,更適用于臨床。
綜上,中劑量痛風寧在下調NALP3、ASC、Caspase-1蛋白和mRNA的表達,以及降低IL-1β、PGE2炎癥因子含量方面的作用相對較佳,且首次干預后48 h時抗炎作用相對明顯。
參考文獻:
[1] 中華醫學會風濕病學分會.2016中國痛風診療指南[J].中華內科雜志,2016,55(11):892-899.
[2] 汪洋,溫成平,謝志軍.急性痛風性關節炎的中醫藥治療研究進展[J].中國中醫急癥,2011,20(11):1809-1810.
[3] 何湞,王藝茹,李亞楠,等.蘇友新教授治療痛風經驗[J].福建中醫藥, 2016,47(2):43-44.
[4] 蘇友新,賴震,鄭良樸,等.痛風寧顆粒對雞痛風模型血清黃嘌呤氧化酶活性的影響[J].福建中醫藥,2006,37(2):41-42.
[5] 蘇友新,劉曉平,鄭良樸,等.痛風寧顆粒對尿酸鈉致新西蘭兔痛風性關節炎模型關節液IL-1β、TNF-α的影響[J].福建中醫藥,2008,39(4):45-46.
[6] 蘇友新,劉曉平,鄭良樸,等.痛風寧顆粒對實驗性血尿酸升高大小鼠尿酸代謝的影響[J].福建中醫藥,2008,39(5):45-46.
[7] 蘇友新,陳寶軍,趙富強,等.痛風寧顆粒對急性痛風性關節炎模型大鼠膝關節PGE2、IL-8及IκB-α、IKK-α的影響[J].福建中醫藥,2013, 44(3):68-70.
[8] 滕方舟,蔡唐彥,郭潔梅,等.痛風寧對急性痛風性關節炎模型大鼠IL-1β,TNF-α及NALP3炎性體的影響[J].中國實驗方劑學雜志,2018, 24(17):120-125.
[9] CODERRE T J, WALL P D. Ankle joint urate arthritis in rat:an alternative animal model of arthritis to produce by Freunds adjuvant[J]. Pain,1987,28(3):379-393.
[10] 蔡唐彥,王旭,何湞,等.急性痛風性關節炎大鼠模型的建立及模型維持時間觀察[J].中國實驗動物學報,2017,25(5):494-499.
[11] 陳奇.中藥藥理研究方法學[M].2版.北京:人民衛生出版社,2006:1168-1170.
[12] 賀玲玲,趙東寶.NALP3炎性體在痛風發病中的作用[J].中華臨床醫師雜志(電子版),2013,7(11):4992-4994.
[13] 黨萬太,周京國,謝文光,等.NLRP3炎性體在痛風性關節炎患者炎癥反應中的機制研究[J].中國免疫學雜志,2014,30(3):373-377.
[14] MARTINON F, PETRILLI V, MAYOR A, et al. Gout-associated uric acid crystals activate the NALP3 inflammasome[J]. Nature,2006, 440(7081):237-241.
[15] MARTINON F, TSCHOPP J. Inflammatory caspases and inflammasomes:master switches of inflammation[J]. Cell Death and Differentiation, 2007,14(1):10-22.
[16] SCHNEIDER S L, ROSS A L, GRICHNIK J M. Do inflammatory pathways drive melanomagenesis?[J]. Exp Dermatol,2015,24(2):86-90.
[17] 金曉敏,張曉熙,郭璐,等.基于NLRP3炎性體軸土茯苓總黃酮對痛風性關節炎的作用和機制[J].中國實驗方劑學雜志,2018,24(4):90-95.
[18] 劉瓏瓏,潘紅英,時樂,等.三妙丸抗急性痛風關節炎配伍機制研究[J].世界科學技術-中醫藥現代化,2014,16(5):997-1004.
(收稿日期:2019-06-08)
(修回日期:2019-07-17;編輯:華強)
基金項目:國家自然科學基金(81473495)
通訊作者:蘇友新,E-mail:suyouxin777@hotmail.com

