習酒濃香型制酒糟醅接種探討
李輝煌,楊剛仁,滕 鈺,王秀龍,鄧軍成,余文麗
(1.貴州茅臺酒廠(集團)習酒有限責任公司,貴州習水 564622;2.貴州省食品藥品檢驗所,貴州貴陽 550004)
濃香糟醅入窖后發酵好壞的主要標志之一,就是溫度的上升。它不僅是發酵的表面可見現象,更重要的是它是發酵程度的標尺,是控制發酵主要工藝參數的準則。濃香型白酒生產入窖糟醅升溫規律是“前緩、中挺、后緩落”。前期升溫快,糖化速度快,而大曲中所含酒精酵母較少,其生長與代謝速度跟不上糖化速度,這樣糖化與發酵不同步,使相當一部分糖被升酸菌所利用,造成酒醅酸度上升,出酒率下降[1]。前期升溫慢或不升溫,淀粉利用不充分,會導致出酒率不高,酒質不好的結果。所以我們在生產中要充分利用生產條件使入窖糟醅正常升溫。但在實際生產中,因為母糟活力和環境氣溫低等因素的影響,導致糟醅入窖后升溫緩或不升溫。

表1 習酒公司制酒一車間九班2018年冬季入窖糟醅升溫情況 (℃)
在濃香型白酒生產中,每年都要遇到溫度極低的冬天。冬天入窖糟醅稍不注意,就會因為糟醅、糠殼、水、曲和入窖條件等因素導致入窖糟醅升溫緩或不升溫的現象產生。針對入窖升溫困難的情況,生產中一般采取的措施為前期對糟醅的配比進行調整或糟醅入窖一段時間后進行翻窖移位的措施。
前期調整糟醅配比就是對“八大要素”中的某幾樣要素進行調整,因影響因素較多,調整難度較大,容易導致配比失調,糟醅入窖后還是存在升溫困難。而后期只能進行翻窖移位,翻窖移位發酵是把窖內糟醅所處的位置進行移位,通過移位方式讓糟醅在空氣中暴露一遍,使糟醅能重新帶入一定量的空氣,讓處于休眠狀態的兼性微生物復蘇,同時使糟醅借此機會自然網羅空氣、工具和場地中的有益微生物,使激活后的微生物和新網羅的微生物成為窖內二次發酵的生力軍。表1 為入窖糟醅因升溫緩慢或不升溫采取翻窖移位后的起始溫度,翻窖移位后,窖池升溫有明顯改善。翻窖移位雖然能夠起到補救作用,但在實際生產中,翻窖移位發酵操作勞動強度大、工序復雜;同時翻窖移位發酵同樣容易使糟醅感染雜菌,如果糟醅被感染反而得不償失,所以希望能找到更好的辦法解決存在的問題。
為此,我們對糟醅進行接種技術實驗,糟醅接種技術與調整入窖糟醅配比和翻窖移位工序操作相比較,有工序簡潔、勞動強度低、易操作、易推廣等優點。
1 糟醅接種理論基礎
1.1 糟醅堆積前后微生物的變化(表2)

表2 糟醅堆積后微生物變化情況[3] (個)
生產中,起堆時每1 g糟醅中酵母菌往往不足1萬個活菌,而堆積中增加為>4×105個。根據表2可以看出,堆積后有大量發酵所需的以酵母菌為主的微生物生成。
1.2 其他化合物生成
若糧糟在加曲后、入窖前采用堆積升溫的方法,則可增加阿魏酸等成分的生成量[4]。而阿魏酸及其衍生物等成分屬芳香族化合物。
1.3 醬香工藝堆積原理
根據醬香白酒的工藝堆積原理:較高溫度的堆積是產生醬香物質的重要條件,由于大曲中基本上沒有酵母,發酵產酒所需的酵母要通過晾堂上堆積網羅。因此,堆積是擴大微生物數量,為入窖發酵創造條件的過程[4]。堆積發酵在濃香型大曲酒生產過程中是有益的,由于在堆積和發酵過程中,溫度有較大提高,可使產酒量提高,酒香較好,與原來不經過堆積發酵生產的酒質相比,達到了香氣優雅、悅人的目的[5]。因此,以上理論為本次實驗奠定了基礎。
1.4 試驗方案
實驗目的:通過先將小部分入窖糟醅經過堆積糖化升溫,待微生物繁殖后與入窖糟醅拌和,進行微生物接種,以保證入窖糟醅有足夠的有益微生物,確保入窖糟醅升溫正常。
實驗方法:將小部分待入窖糟醅進行堆積糖化、地面升溫后,再與其他入窖糟醅拌和均勻后入窖。
實驗過程:(1)將降溫加曲后的入窖糟醅,取200 kg 放置于晾堂上,收成半圓;(2)因酵母菌繁殖最佳溫度為28~32 ℃,而溫度超過36 ℃酵母菌將自然衰亡。所以待糟醅溫度上升到28~30 ℃,將糟醅攤開平鋪,防止溫度進一步上升;(3)按照大約100∶1 的比例,均勻將堆積升溫后的糟醅均勻拌和在入窖糟醅內。
2 結果與分析
2.1 微生物檢測
實驗將未接種的糟醅和接種后的糟醅分別取樣對細菌、酵母、霉菌進行檢查,檢查結果如表3。
由表3 可以看出,糟醅經過地面糖化,富集大量的有益微生物,接種后入窖糟醅的細菌、霉菌、酵母菌數量和種類都要優于未接種的糟醅,特別是發酵所需要的酵母菌,為糟醅入窖后升溫提供了強有力的保證。
2.2 升溫對比情況(圖1、圖2)
從圖1和圖2可以看出:
未接種糟醅1~4 次測溫(糟醅入窖后第一次測溫為起始溫度,然后每隔1 d 測1 次溫度,下同)平均升溫1.9 ℃,從每個窖的情況看呈現升溫緩慢或不升溫現象。對此采取了翻窖移位后,溫度得以保證,但仍達不到理想的升溫情況。依然存在升溫緩慢、頂溫不高和升溫幅度不大的情況。
接種后的糟醅1~4 次測溫平均升溫6.6 ℃,堆積后的糟醅中有大量繁殖的微生物,經過接種的方式將微生物帶入入窖糟內,改變了入窖糟醅的微觀環境和發酵狀態,從每個窖的升溫速度、幅度和頂溫來看都要優于不接種的糟醅。接種后的糟醅升溫情況較正常,接近理想升溫的狀態。
2.3 色譜分析及酒體感官評級結果
入庫酒對比情況,將接種和未接種的糟醅取酒后分別單獨按照正常入庫進行色譜分析和口感品評鑒定,結果見表4。

表3 糟醅接種前后微生物變化情況

表4 色譜分析報告
由表4 可以看出,接種后的糟醅所烤取的酒乙酸乙酯、丁酸乙酯、乳酸乙酯、己酸乙酯含量均高于未接種糟醅。我公司對大宗入庫基酒的己酸乙酯含量要求為≥1.8 g/L,接種后的糟醅入庫基酒己酸乙酯含量高于標準0.61 g/L,而未接種的糟醅入庫基酒己酸乙酯含量只高于標準0.05 g/L。取酒后接種糟醅的主體香四大酯均高于未接種糟醅。酒體感官品評定級結果見表5。

表5 酒體感官品評定級結果
由表5 可以看出,接種糟醅入庫酒被評定為乙級酒,未接種糟醅被評定為丙級酒,我公司將乙級及以上的基酒定為優質酒,丙級及丙級酒以下定為普通酒或劣質酒。因接種后的糟醅入窖后微生物環境優于未接種的糟醅,確保了濃香風味物質的形成,口感達到了公司優質酒定級要求。
2.4 出酒率對比(表6)
由表6 可以看出,接種后糟醅出酒率高于未接種糟醅出酒率。接種糟醅入窖后升溫接近理想狀態,糟醅發酵正常,出酒率得以保證。而未接種的糟醅升溫緩慢或不升溫,在主發酵期,淀粉未能得到充分利用,導致出酒率低。
2019 年第二排次,車間各班平均出酒率為37.59%,未接種糟醅出酒率為36.74%,比平均出酒率低0.85%。接種糟醅出酒率37.87%,高于平均出酒率0.28%
3 結論
白酒生產中,物質的產生可以從兩條路徑來看,一條是淀粉→糖→乙醇(酒精);另一條是淀粉、蛋白質、脂類等→白酒中的微量成分[5]。未接種糟醅因升溫緩或不升溫,糟醅發酵不良,微生物生長和繁殖困難,淀粉等成分轉化不徹底,最終的結果表明產量和質量都不盡人意。當入窖糟醅升溫情況不理想時,可以采取糟醅接種,增加所需要的入窖微生物數量,改變不良的發酵狀態,使糟醅入窖后能夠正常發酵,保證產出正常。
本研究得出結論如下:(1)冬季溫度較低,糟醅收溫溫度為18~20 ℃之間。堆積糖化需要72~96 h 才能將溫度升到30 ℃以上。實際生產具有連續性,如果每次都采取用新入窖糟醅進行糖化,生產時間周期會延長。可以采取將第一次糖化好的糟醅預留使用十分之一,再與新入窖糟醅進行拌和后堆積升溫,這樣可以大大縮短堆積升溫的時間,一般20 h 就能將溫度升到30 ℃;(2)在堆積升溫時一定要注意堆積產地和周邊衛生,以防雜菌感染;(3)當堆子升溫到30 ℃時,將堆子攤開,因冬季環境溫度低,可以使微生物進入鈍化狀態,防止堆子進一步升溫,使酵母菌衰亡;(4)糟醅接種只適用于入窖糟醅升溫困難所采取的措施,正常糟醅使用后糟醅升溫猛,不利于產出。
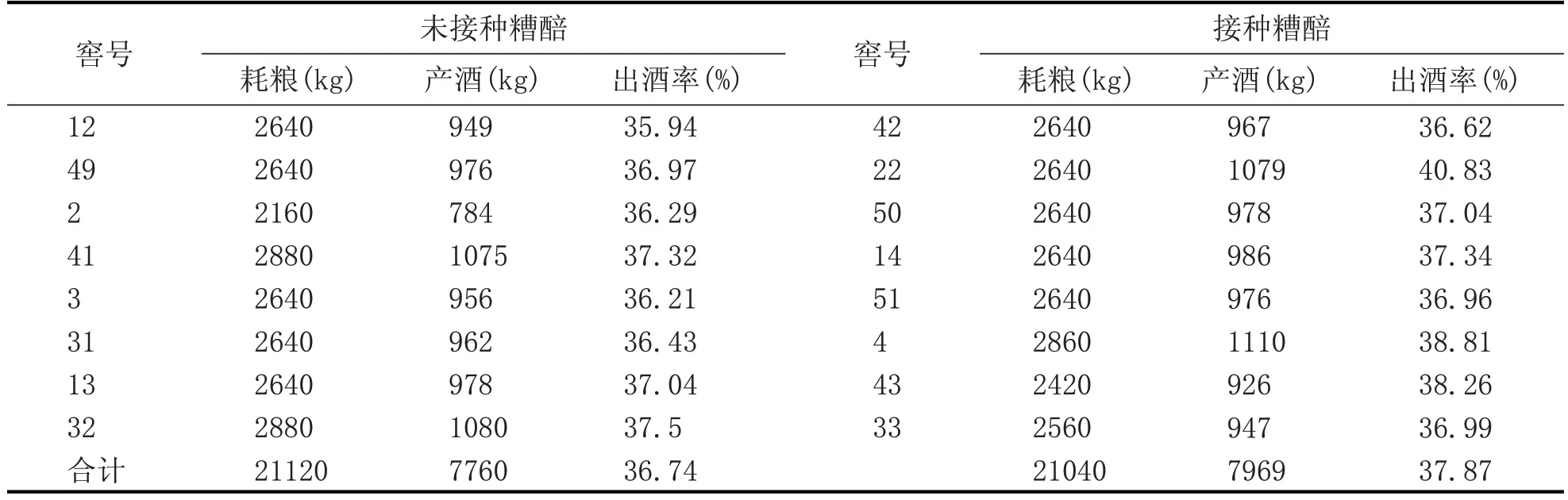
表6 未接種糟醅與接種糟醅出酒率對比表

