本院173例藥物不良反應分析
惲敏 高陽 劉鶯 馮樂波
【摘要】 目的:了解本院藥物不良反應(ADR)的發生特點和規律。方法:收集2018年1-10月本院上報的173例ADR報告,從患者性別、年齡、給藥途徑、藥物分類、發生時間、臨床表現等方面進行統計分析。結果:在173例ADR報告中,男87例(50.29%),女86例(49.71%);靜脈注射給藥100例(57.80%),口服給藥60例(34.68%);抗菌藥物55例(31.79%),鎮痛藥21例(12.14%);心血管系統16例(9.25%);用藥后15~30 min發生ADR有42例(24.28%);ADR損害以皮膚系統為主,占32.11%;其次為消化系統、神經系統,各占24.77%、14.22%。結論:分析影響ADR發生因素,防止ADR的發生,為臨床安全用藥提供參考依據。
【關鍵詞】 藥物不良反應 分析 合理用藥
Analysis of 173 Adverse Drug Reactions in Our Hospital/YUN Min, GAO Yang, LIU Ying, FENG Lebo. //Medical Innovation of China, 2020, 17(04): -162
[Abstract] Objective: To analyze the characteristics and regularities of adverse drug reactions (ADR) in our hospital. Method: A total of 173 cases of ADR in our hospital from January to October 2018 were statistically analyzed according to gender, age, route of administration, drug classification, occurrence time and clinical manifestations of ADR. Result: Among 173 cases of ADR, 87 patients (50.29%) were male, and 86 patients (49.71%) were female. 100 cases (57.80%) were administered intravenously, and 60 cases (34.68%) were administered orally. There were 55 cases (31.79%) of antimicrobial drugs, 21 cases (12.14%) of analgesics and 16 cases (9.25%) of cardiovascular system. 42 cases (24.28%) occurred ADR in 15 to 30 minutes after administration. The main organs or systems involved in ADR were the skin (32.11%), followed by the digestive system (24.77%) and nervous system (14.22%). Conclusion: Analying the affecting factors of ADR, it is necessary to prevent the occurrence of ADR and provide a reference for clinical safety medication.
[Key words] Adverse drug reactions Analysis Rational drug application
First-authors address: Changzhou Wujin Peoples Hospital, Changzhou 213002, China
doi:10.3969/j.issn.1674-4985.2020.04.040
藥物不良反應(ADR)是指合格藥物在正常劑量下出現與用藥目的無關的有害反應。隨著藥物種類的增多,給藥途徑的不同,服藥后的效果,使得循證藥物的ADR評價和分析日益重要[1]。此次研究將對2018年1-10月本院上報的173例ADR報告進行分析,為臨床安全用藥提供依據,現報道如下。
1 對象與方法
1.1 對象 收集2018年1-10月本院上報的173例ADR報告。
1.2 方法 采用回顧性研究對上報內容患者的性別、年齡、給藥途徑、藥物分類、ADR發生時間、ADR主要臨床表現等方面進行分類、統計、分析、評價。
2 結果
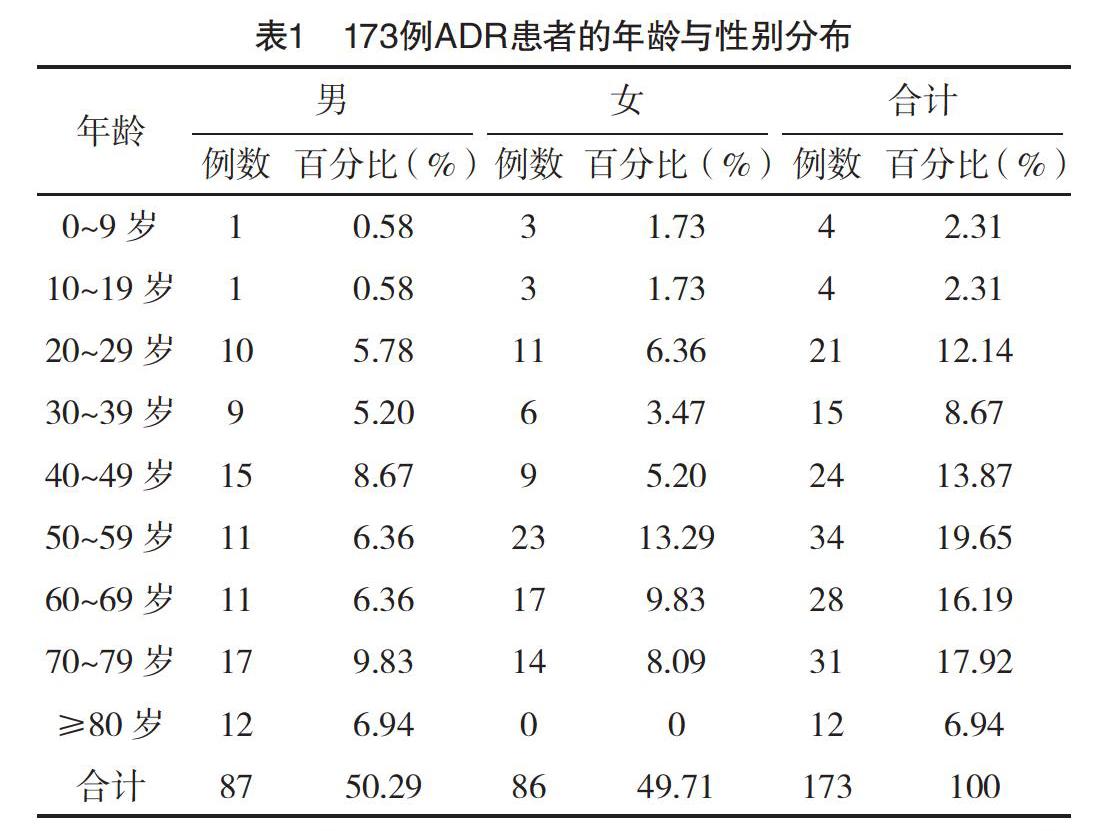
2.1 ADR患者年齡與性別分布 173例ADR患者中,男87例(50.29%),女86例(49.71%);年齡50~59歲人數最多。見表1。
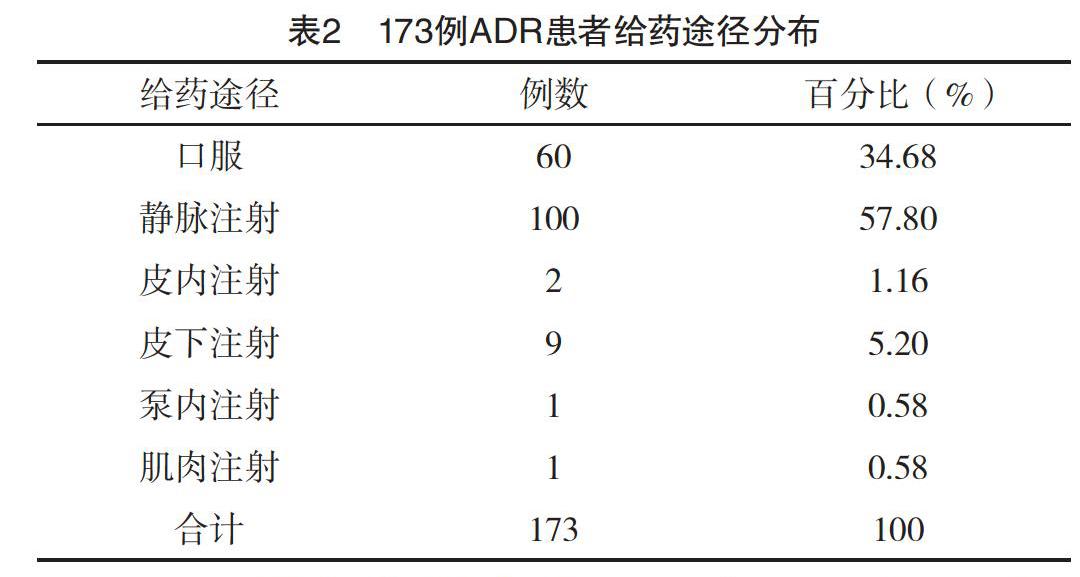
2.2 ADR給藥途徑分布 173例ADR患者中,靜脈注射給藥100例(57.80%)最多,口服給藥60例(34.68%)次之,見表2。
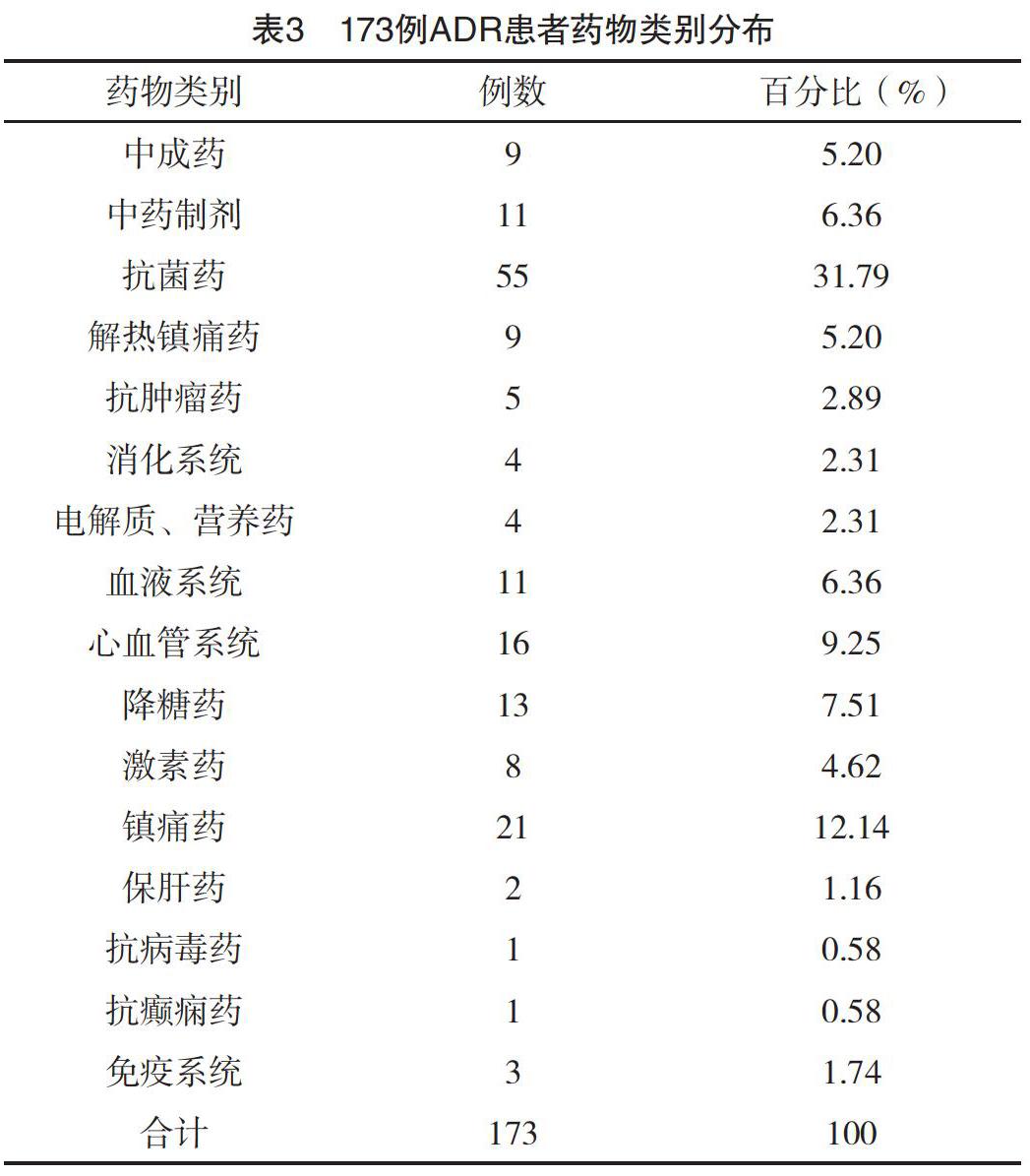
2.3 ADR藥物類別分布 173例ADR報告中,抗菌藥物55例(31.79%)最多,鎮痛藥21例(12.14%)次之,同時地佐辛ADR例數最多19例,見表3。
2.4 ADR發生時間分布 173例ADR報告中,用藥后15~30 min發生ADR者42例(24.28%),見表4。
2.5 ADR所涉及器官或系統損害的臨床表現分布 173例ADR報告中,以皮膚及其附件損害尤為常見,占32.11%;其次為消化系統、神經系統,各占24.77%、14.22%。見表5。
3 討論
3.1 ADR患者年齡與性別分析 從統計結果來看,男女比例約為1︰1,與國內大部分文獻中女性發生率高于男性有所不同[2-3]。各年齡段大多均有ADR,60歲以上老人有71例,占41.04%,可能與自身機體的組織器官功能減退、免疫力下降有關;若自身有基礎疾病需聯合用藥,會增加ADR的風險。若患者沒有良好的用藥依從性或對藥物的敏感性和耐受力下降,也會增加ADR的發生率[4]。另外,本院兒童用藥的ADR可能與自身組織器官未發育成熟、藥物代謝排泄能力、兒童專用藥的種類與數量、用量用法有關[5]。
3.2 ADR給藥途徑分析 173例ADR中,靜脈注射給藥100例(57.80%),口服給藥60例(34.68%),與國內文獻[6]報道一致。靜脈注射雖起效快,但藥物直接進入血液,缺少屏障,增加ADR的發生率,可能與滴速、溶酶體有關;藥物配伍禁忌多,換藥之間未沖管,使得藥液之間的pH值不同,增加ADR的發生率。口服給藥方式可能與藥物劑型及輔料有關。不管以何種給藥途徑或一起服用不同藥物時,藥物之間可能發生氧化水解等反應,或食物對藥物的影響,可能伴有藥物成分的改變,產生新的過敏原,增加ADR的發生率。因此臨床上應嚴格遵守“能口服不肌注,能肌注不輸液”的給藥原則,在病情改變后合理改變給藥方式[7]。
3.3 ADR藥物類別分析
3.3.1 抗菌藥物 抗菌藥物引起ADR的發生率最高為55例(31.79%),與國內文獻[8-10]報道一致。在抗菌藥物中頭孢類抗生素最多23例,其中頭孢他啶5例,頭孢西丁4例。由于頭孢類藥品種類繁多、選擇性廣、抗菌譜廣等,被廣泛運用。本院頭孢類抗生素總類和數目較多,使得臨床上醫生無指征用藥,隨之用藥頻率增加,用藥劑量增大,增加了ADR的發生率,與國內文獻[11]報道分析相似。故臨床上嚴格遵循《抗菌藥物臨床應用基本原則》,嚴格掌握適應證,聯合用藥合理性,及時對癥治療,預防為主。此類藥物以四元的β-內酰胺環和六元的氫化噻嗪環的稠合體為母核,其中四元的β-內酰胺環易受酸堿、酶的催化開環而失活,降低藥物活性,可能會增加ADR的發生率。同時用藥前醫生未詢問患者是否飲酒或飲用含有酒精的飲料或用藥后醫生或藥師未詳細交代服藥期間不宜飲酒或飲用含有酒精的飲料,可能也會增加ADR的發生率,因藥物與酒精反應抑制肝中乙醛脫氫酶,導致酒精代謝的中間產物乙醛代謝受阻,使其在體內不斷蓄積出現雙硫侖反應。
喹諾酮類15例,其中莫西沙星7例,左氧氟沙星6例,該藥物在組織中藥物濃度高、劑型豐富/給藥無須皮試等優點,被廣泛應用于臨床[12]。但藥物新品種的出現,交叉耐藥性顯著,ADR發生率增加[13]。這類藥物以4-吡啶酮-3-羧酸為基本結構,3位羧基和4位酮基與含鈣鎂鋅的食物合用形成螯合物,降低藥物活性,可能會增加ADR的發生率;8位取代基的不同會對光毒性強度有影響,在運輸和儲存過程中藥品應避光,靜滴時選擇有避光作用的輸液材料,但在本院因藥品說明書中沒有明確指出或提到,在輸液過程中可能不會采取相應措施,增加ADR的發生率;3位羧基顯酸性,對本身胃腸道有刺激性,易引起胃腸道的不適,增加了ADR的發生率。
青霉素類10例,因抗菌譜廣且高效被廣泛應用,但化學結構中β-內酰胺母環易被降解,在酸的作用下生成青霉二酸,再生成青霉胺和青霉醛;在堿性條件下生成青霉酸,先生成青霉噻唑酸,再分解成青霉胺和青霉醛。這些分解產物與體內蛋白質結合成為抗原誘發變態反應[14]。此外,部分青霉素類抗生素的側鏈也還有抗原決定族,能刺激集體產生特異性IgE[15],如阿莫西林。因青霉素類藥物價格相對較低,本院使用頻率較高,增加了ADR的發生率。醫生用藥前應詢問患者有無過敏史或用藥前做皮試,對老幼孕患者應調整合理劑量;藥師應加強用藥監護,對不合理用藥積極干預,避免抗菌藥物濫用。
3.3.2 鎮痛藥 鎮痛藥21例(12.14%),其中地佐辛19例。地佐辛是阿片受體混合激動-拮抗劑,其鎮痛效果好、無明顯依賴性、安全劑量范圍廣等優點,應用于臨床麻醉鎮痛、術后鎮痛、癌痛治療等[16]。但截至2011年,美國和加拿大已不再臨床上使用的地佐辛,在中國被廣泛用于術后,其不良反應居多,過度鎮靜和呼吸抑制、惡心嘔吐、頭暈出汗、皮膚發紅等[17]。本院地佐辛價格比同類藥高,應綜合考慮經濟用藥。
3.3.3 中藥制劑 中藥制劑11例(6.36%),可能與提取工藝不夠完善,注射劑中含有色素、鞣酸、揮發油、蛋白質等物質與其他藥物配伍發生理化變化,說明書不夠完整等因素有關[18]。某些中藥本身含有有毒成分,過量服用即可中毒。
3.4 用藥后發生ADR的時間分析 表4可見,用藥后30 min發生ADR者73例(42.20%),可能與給藥方式有關。靜脈注射給藥起效快,ADR產生也快;口服給藥后經首關效應、胃腸道消化吸收、肝腸循環后起效,發生ADR較慢。故用藥過程中或用藥后出現ADR應立即停藥,積極處理,做到“發現、早停藥、早處理”,避免嚴重的ADR發生[19]。
3.5 ADR后所涉及的器官或系統損害臨床表現分析 表5可見,ADR臨床表現多種多樣,以皮膚及其附件的損害最為常見為70例次(32.11%),與文獻[20]報道一致,其臨床表現為皮疹、瘙癢、潮紅、蕁麻疹、水腫等。其次為消化系統54例次(24.77%),主要表現為惡心嘔吐、腹痛腹瀉、納差、食欲異常;神經系統31例(14.22%),表現為頭暈頭痛、麻木、眩暈嗜睡、胡言亂語。因以上臨床表現易于發現和診斷,故上報例數較多[21],但有些慢性潛在不易發現的ADR存在較高漏報率,影響患者康復[22]。醫護人員應在治療前詢問患者用藥史、過敏史、家族史、是否有不良嗜好等,治療時密切觀察,避免ADR的發生。
綜上所述,ADR的發生與患者性別、年齡、給藥途徑、藥物分類、用量用法、配伍禁忌、聯合用藥等多種因素有關。本院應發現問題,提出干預措施,完善ADR監測系統,提高醫護人員對ADR的認識,有效避免ADR的發生。藥師要參與臨床工作,杜絕不合理用藥,為臨床安全用藥提供參考依據。
參考文獻
[1]劉建平,邢建民.循證的藥品不良反應評價方法[J].中國藥物警戒,2010,7(1):12-15.
[2]王喜芬,康定文.436份藥品不良反應報告分析[J].中國醫院用藥評價與分析,2007,7(5):391-393.
[3]譚建中,張俐.462例藥品不良反應報告[J].中國醫院用藥評價與分析,2018,18(5):701-704.
[4]劉劍威.我院90例藥品不良反應分析[J].北方藥學,2018,15(11):194-195.
[5]楊林勇,劉新社,蕭偉,等.我國常見兒童藥物不良反應及對策研究[J].中國中藥雜志,2016,41(14):2743-2747.
[6]冉坤,李飛,李娜,等.468例藥品不良反應報告分析[J].重慶醫學,2015,44(36):5146-5149.
[7]孟祥云,高雷,姜怡,等.某院581例藥品不良反應報告分析[J].安徽醫藥,2015,19(1):199-202.203.
[8]王鳳霞,沈欽華,樊國斌,等.我院190例藥物不良反應報告分析[J].中國藥房,2015,26(5):641-643.
[9]陳燕,段寶珍,陳俊敏.我院162例藥品不良反應報告分析[J].中國當代醫藥,2015,22(1):184-186.
[10]亢衛華,黃燕琳,李繼泉.457例藥品不良反應報告[J].中國醫院用藥評價與分析,2017,17(2):271-272,275.
[11]鄭火珺,葉建云.我院抗菌藥物不良反應報告相關因素分析[J].中國藥業,2013,22(6):94-96.
[12]李銳,李錦玥,趙曜,等.某三甲醫院308例藥品不良反應報告分析[J].中國醫藥導報,2017,14(32):120-123.
[13]劉又寧.關注氟喹諾酮類藥物不良反應[J].中國社區醫師,2010,7(1):20-21.
[14]趙光純,張艷麗.386例抗菌藥物不良反應報告分析[J].中國醫院藥學雜志,2012,32(1):73-74.
[15]周法庭,朱曉丹,波順慶,等.β-內酰胺環和側鏈結構誘導青霉素類抗生素過敏的研究進展[J].醫學綜述,2018,24(3):444-448.
[16]鄭彬,佘守章.地佐辛在麻醉鎮痛領域的應用進展[J].廣東醫學,2015,36(21):3266-3268.
[17]樊寶才.我院骨科地佐辛注射液致不良反應80例分析[J].中國藥房,2015,26(32):4521-4522.
[18]馮婕.藥品不良反應238例分析[J].臨床合理用藥,2018,11(2A):55-57.
[19]譚才燕,陳金英,梁靜芳,等.470例藥品不良反應分析[J].中國醫院用藥評價與分析,2015,15(11):1505-1507.
[20]喬逸,惲艷琴,徐煥春,等.我院2012-2015年997例藥品不良反應報告分析[J].中國藥物應用與監測,2017,14(1):34-36.
[21]孫國平,王海飛.668例藥品不良反應報告[J].中國醫院用藥評價與分析,2018,18(3):409-411.
[22]朱亞寧,張月芳,豐航,等.陜西某醫院2011-2013年藥品不良反應報告分析[J].中國藥物與臨床,2015,15(11):1650-1652.
(收稿日期:2019-08-16) (本文編輯:程旭然)

