基于證據推理與模型認知素養的氧化還原知識構建探討
黎旭陽
【摘要】氧化還原反應是中學化學的核心概念,它分散在學生化學學習的全過程。常用的教學方法中,學生短時間內難以認識其本質,進而無法建立相關的知識模型。在教學中不斷改進若由化合價變化切入,運用證據推理建立模型認知的方式,能使學生迅速了解氧化還原反應的特征與本質,并體會到證據推理與模型認知在學習中的重要作用。
【關鍵詞】化合價;電子偏移;氧化還原反應
胡久華教授指出氧化還原反應是高中化學核心概念[1],氧化還原反應的思想貫穿了學生化學學習的全階段,氧化還原反應知識還是解釋相關生產生活事件和現象的有效工具。
普通高中化學課程標準(2017年版)提出要以發展化學學科核心素養為主旨,五大素養中包含了證據推理與模型認知素養。基于證據推理與模型認知素養開展氧化還原反應教學能夠有效地解決常用的教學方式中存在的不足,取得更好的教學效果。
一、氧化還原教學中常見的教學方式
1.講授式
奧蘇貝爾指出,學生需要花好幾小時才能收集到的信息,如果通過教師的有效講解,可以大大縮短他們的學習時間。有效的講授式教學能夠充分地傳遞知識信息,引發學生思考、理解與記憶,并掌握科學的思維方法。
講授式的模式通常由以下幾個環節構成。環節一,根據學生已有的知識列出氧化反應的代表:Cu+O2CuO,以及還原反應的代表:CuO+H2Cu+H2O,由此引導學生從氧元素的得失角度進行分析。環節二,建立起氧化反應。還原反應不是孤立發生的,氧化反應與還原反應是同時進行的反應,要構建氧化還原反應的概念。環節三,進一步分析反應中各元素化合價,得出氧化還原反應都有化合價的升降,并利用該特征分析不含氧元素的反應如Fe+CuSO4=FeSO4+Cu。環節四,形成有化合價升降的反應都是氧化還原反應的概念,掌握通過化合價判斷反應是否為氧化還原反應的方法。
2.探究式
杜威強調科學教學不僅僅是教給學生探究的結論,而且需要學生形成探究的思維,掌握探究的操作程序,即讓學生像科學家搞科學研究工作那樣去探索和獲取知識。這種思想后來就發展為科學教學的一種方法,即探究式教學。
在氧化還原的探究式教學中,探究式教學的主要思路是“①展示氧化反應或還原反應→②通過標識化合價,探究化合價變化情況→③得出結論:氧化還原反應都有化合價變化→④運用結論分析無氧元素的反應→⑤建立起通過化合價判斷反應類型的知識體系→……”在教學的過程中,教師設計問題,讓學生討論發現氧化還原反應的特征是化合價的變化,然后利用這一特征去解決相應的問題。
3.講授式和探究式的特點與局限
講授式和探究式在教學設計的總體路線上是一致的,都是利用學生已經掌握的氧化反應、還原反應的定義去認識、評判化學反應,并由此引發認知沖突,使學生感受到已有知識的局限性,然后換一個角度重新分析找到氧化還原反應所隱含的、共同的外部特征,從而建立對氧化還原反應的新認識。
在實際教學中發現,這兩種教學方式在從含有氧的氧化還原反應過渡到無氧參與的氧化還原反應的過程中,有較大的思維跳躍,對于基礎知識牢固、思維活躍、理解能力強的學生來說,不會產生太大困難;但是對于化學基礎薄弱、思維不太活躍的學困生而言,這樣的推導分析讓他們如墜云霧,無法真正掌握知識重點,更不會運用氧化還原知識解決相關問題。
二、基于證據推理與模型建構的氧化還原反應教學案例
學生化學學科核心素養的發展是一個自我構建、不斷提升的過程,可以通過引導學生開展分類與概括、證據與推理、模型與解釋、符號與表征等具有學科特質的學習活動,結合小組合作、實驗探究、談論交流等多樣化方式促進學生學習方式的轉變。
以任務驅動為方法,在課堂中為學生設立相應的任務,學生在完成相關任務的過程中不斷地梳理凌亂的知識,逐步建構相關的知識體系,掌握運用知識解決問題的技能,內化知識原理,在學習過程中逐漸形成相關的學科素養。
1.環節一:分類與概括——建立證據意識
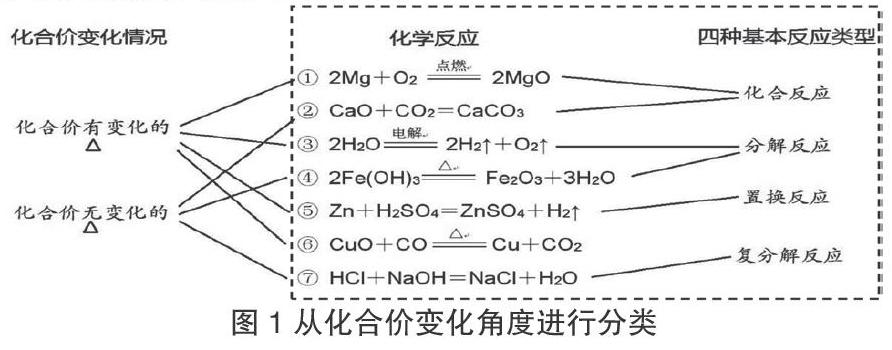
任務一:運用分類知識仔細觀察教師提供的反應方程式,選擇合適的分類方法對反應進行分類,然后向組員闡述自己的分類依據并獲得他們的支持。學生作答情況如圖1中右側虛線框部分。
設計意圖:在對提供的反應進行分類的過程中,大部分學生都能夠依據四大基本反應類型的分類標準進行分類,但是對于反應⑥的歸屬產生了爭議:一部分同學依據置換反應表面特征認為屬于置換反應;另一部分同學認為依據置換反應的原理不屬于置換反應。在爭論中,學生能夠逐漸建立證據意識,掌握利用證據進行分析的技巧。
2.環節二:標注化合價——建構新認知模型
任務二:換個角度認識世界。在前面的任務中歸納發現,同學們在初中掌握的知識是非常牢固的,都是從反應物和生成物的類型,以四大基本反應類型的特征為依據進行分類。但是,大家還掌握了化合價的標注,嘗試一下如果從化合價的角度重新看這些反應會不會有新的發現。學生作答情況見圖1。
設計意圖:通過對化合價進行標注,找到在一部分化學反應中某一元素的化合價在反應前后的變化情況,另一部分化學反應中的所有元素的化合價在反應后并無變化,由此構建了化學反應的新的認知模型——化合價發生改變。
在學生掌握了利用化合價對反應進行分類的方法后,建立關于氧化還原反應的判斷流程,提煉成形成口訣:同元素,前減后,不為零,定氧還。
至此,經過兩個環節的學習活動,學生建立了在不同證據觀點的支撐下可以得到不同的結論的認知。
3.環節三:微觀表征——建立認知圖式
任務三:原子非常小,無法用肉眼觀察,但是科學家為我們提供了微觀與宏觀聯系的工具——原子結構示意圖。下面讓我們帶上原子結構示意圖這個工具,閱讀教材圖2-11氯化鈉形成示意圖,找出反應①化合價升降的原因,模仿畫出形成示意圖。
設計意圖:利用化合價對化學反應進行分類的方法僅僅是對化學反應分類的方法,還未能完整建構氧化還原反應的認知模型。通過引導學生閱讀教材,觀察鎂原子、氧原子的原子結構示意圖,運用教材提供信息分析在反應中電子的得失情況,自主畫出氧化鎂形成示意圖,自主構建氧化還原反應中元素化合價變化的原因。
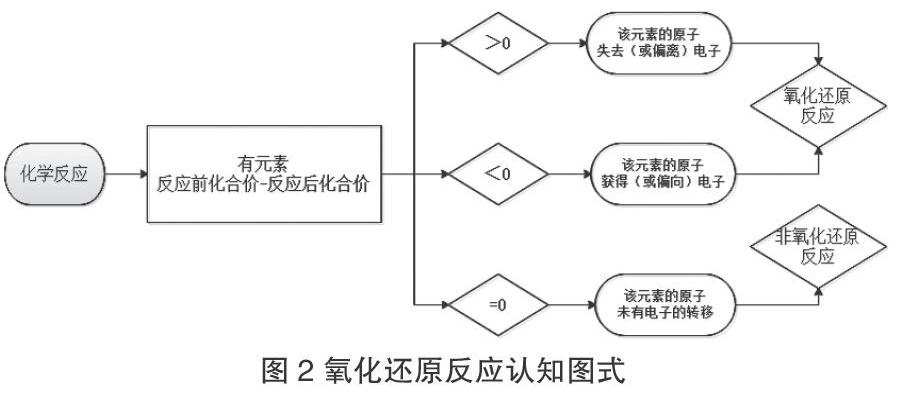
在此基礎之上與學生共同提煉生成氧化還原反應的認知圖式,見圖2。
4.環節四:歸納整理——概念內化
任務四:經過前面的體驗,我們逐漸明確了有的化學反應會有化合價的變化,有的化學反應沒有化合價的變化,導致化合價變化的原因是由于原子的電子發生了得失或偏移。下面我們從知識的本質出發,以電子是否發生轉移為標準,將化學反應分成兩類(即氧化還原反應和非氧化還原反應)。之前我們掌握的四大基本反應類型與氧化還原反應和非氧化還原反應之間存在怎樣的聯系?請用集合的觀點完成關系圖。
設計意圖:四大基本反應類型與氧化還原反應是由于分類角度不同而產生的不同的結論,通過對代表反應的分析,引導學生形成多角度思維的習慣,培養學生根據信息正確選擇模型的能力。
5.環節五:整理聯系——技巧培養
任務五:按要求寫化學方程式,找出規律,總結判斷氧化還原反應的技巧。
(1)一種單質還原一種化合物。
(2)一種單質氧化另一種單質。
(3)一種非金屬單質還原一種氧化物。
(4)同一種物質中一種元素氧化另一種元素。
學生提煉心得:有單質出現的化學反應基本上都是氧化還原反應。
設計意圖:在實際解決問題中,學生需要有一個簡單易行的方式與方法,運用這些方式方法,既能夠提高解決問題的效率,也能夠增強解決問題的信心。
三、課后反思
在解決實際問題的時候通常需要從儲備知識中準確篩選出有助于解決問題的知識。化學的知識點多而且分布較為零散,這個特點會在學生運用化學知識解決問題的過程中會造成不小的障礙。要順利突破這個障礙,不僅需要有扎實的知識儲備,而且需要有科學的思維方式。新課標中明確提出證據推理與模型認知素養就是學生需要養成的科學的思維方式。科學的思維方式不是一朝一夕能夠養成的,需要在日常有意識地滲透到教學的各個環節中,引導學生在分析問題時不要跟著感覺走,而是要有理有據。
【參考文獻】
胡久華,陳欣,支瑤.不同教學處理方式對高中生化學核心概念建構的影響[J].中國教育學刊,2007(07):61-64.

