Y-trap結構的抗PD-1/VEGFR雙功能融合蛋白的研制
劉慶友,何 蕓,洪偉東,鄒 敬,胡品良*
( 1.北京比洋生物技術有限公司, 北京 100176;2.昆明市延安醫院腎內科,云南 昆明 650051 )
免疫檢查點(immune checkpoint)是免疫系統中存在的一些抑制性信號通路,通過調節外周組織中免疫反應的持續性和強度避免組織損傷,并參與維持對于自身抗原的耐受[1]。程序性死亡蛋白-1(programmed death-1,PD-1)和其配體程序性死亡蛋白配體-1(programmed death ligand-1,PD-L1)的相互作用是發揮免疫檢查點作用主要分子。腫瘤細胞正是利用這一重要機制抑制T淋巴細胞活性,達到逃避免疫系統對其攻擊的目的。抑制PD-1/PD-L1抗體主要通過抑制PD-1與PD-L1的結合,促進T淋巴細胞增殖和細胞因子產生,解除PD-1/PD-L1系統對腫瘤活性T淋巴細胞免疫監視的抑制。臨床實踐證實PD-1/PD-L1抗體雖然有較好的治療效果,但平均有效率僅為20-30%左右,有相當一部分患者對這類治療無反應。如何提高免疫治療的有效率是目前腫瘤治療領域需要解決的難題之一。
研究表明血管內皮生長因子(vascular endothelial growth factor,VEGFs)也有參與腫瘤微環境,抑制腫瘤微環境中免疫細胞的作用。在治療腫瘤的研究中發現,抗免疫檢查點與血管生成拮抗藥物有很高的協同效應[2]。
本研究通過分子生物學技術成功構建了一種Y-trap結構的抗PD-1抗體/VEGFR雙功能融合蛋白:將PD-1抗體的輕鏈編碼基因構建至雙表達盒的谷氨酰胺合成酶(GS)表達載體,再將PD-1抗體重鏈編碼基因3’端與VEGFR1的功能區Ⅱ(D2)和VEGFR2的功能區Ⅲ(D3)編碼基因通過柔性片段(GS4)3編碼基因連接。然后進行瞬時表達,收獲培養液;經親和層析純化蛋白;最后檢測蛋白結構、抗原抗體結合能力分析和體內抑瘤試驗等研究。現將該研究結果報告如下。
1 材料與方法
1.1 主要實驗材料
雙表達盒的谷氨酰胺合成酶(GS)表達載體載體p327.7為北京比洋生物技術有限公司所有(專利授權號:CN104195173B),EcoRI、XhoI、XbaI和SalI內切酶購自英國NEB公司,脂質體Lipofectamine2000和無血清培養基CD CHO 培養基購自GIBCO公司,HiTrap MabSelect SuRe純化柱為GE公司產品,293F細胞購自Invitrogen 公司。
1.2 表達載體構建
根據International Nonproprietary Name(INN)數據庫中有關Nivolumab的氨基酸殘基序列,連接肽(GS4)3和VEGFR-1的功能區Ⅱ(D2)和VEGFR2的功能區Ⅲ(D3)氨基酸殘基,優化為適合在中國倉鼠卵巢癌細胞(CHO)中表達的編碼基因序列,并委托上海捷瑞生物工程有限公司合成編碼基因。通過XhoI-EcoRI雙酶切將輕鏈編碼基因連接至表達載體p327.7;通過XbaI-SaII將重鏈編碼基因克隆至已連接輕鏈編碼基因的表達載體p327.7。載體測序驗證正確后備用。所表達的雙功能抗體命名為BY24.3。
同樣將Nivolumab抗體的輕鏈和重鏈的編碼基因,分別通過XhoI-EcoRI和XbaI-SaII雙酶切構建Nivolumab的雙表達盒表達載體,所表達的Nivolumab命名為BY18.1。
根據International Nonproprietary Name(INN)數據庫中有關的aflibercept氨基酸殘基序列數據,優化為適合在中國倉鼠卵巢癌細胞(CHO)中表達的編碼基因序列,并委托上海捷瑞生物工程有限公司合成編碼基因序列,通過XbaISaII構建到p327.7表達載體中。所表達aflibercept的命名為301-8。
1.3 蛋白表達表達及純化
293 F 細胞懸浮培養于無血清CD 293 培養液中,轉染前離心更換新鮮培養基,細胞濃度調整為1×106細胞/ml。以100ml細胞為例,分別將表達質粒DNA 250μg和PEI(Sigma,Cat.No:408727) 500μg分別加入1ml 293培養液中混勻。室溫靜置8min。將PEI /DNA混懸液逐滴加入搖瓶中,輕輕混勻,置于5% CO2、37 ℃搖床培養(120 rpm)5天后收集培養上清。
1.4 表達蛋白的純化
收集轉染的上清,培養上清液用0.22μm濾膜過濾。用pH 7.4的PBS溶液平衡 HiTrap MabSelect SuRe 1ml 柱(GE產品, Cat. No:11-0034-93)10個床體積,流速為0.5ml/min;用pH 7.4的PBS溶液再洗5-10個床體積,流速為0.5ml/min;用100mM檸檬酸緩沖液(pH 3.0)洗脫,流速為0.5ml/min,收集洗脫峰。純化蛋白進行10%SDS-PAGE電泳,分析蛋白大小。
1.5 Biacore方法檢測純化蛋白與PD-1和VEGF -A的結合
采用氨基偶聯的方法首先將抗人IgG 抗體固定于CM5芯片,然后依次捕獲雙特異抗體,再應用Biacore T100儀器檢測蛋白與抗原PD-1(北京義翹神州生物技術有限公司產品,cat:10377-H08H)和VEGF-165(北京義翹神州生物技術有限公司產品,cat:11066-HNAH)的相互作用及親和力。最后用BIAevaluation 4.1 software將數據進行曲線擬合,計算抗體親和力。
1.6 人源化小鼠模型中的抑制腫瘤生長效果
該研究委托北京百奧賽圖基因生物技術有限公司完成。將MC38結腸癌細胞5×105個/0.1 ml接種于雌性B-hPD-1人源化小鼠右側前脅肋部皮下,待腫瘤生長到約108 mm3時按腫瘤體積隨機分組,每組6只,共5組,分別為:溶劑對照組、BY24.3 (6.4 mg/kg)、301-8(aflibercept)(3.3 mg/kg)和 BY18.1(nivolumab) (5 mg/kg),各組劑量以BY18.1(nivolumab)為標準,最終摩爾量一致。所有組給藥途徑均為腹腔注射,每三天給藥1次,連續給藥6次,末次給藥6天后結束實驗。每周測量腫瘤體積及體重2次,記錄小鼠體重和腫瘤體積。實驗結束時,動物安樂死,剝取腫瘤稱重、拍照。計算相對腫瘤抑制率(TGI)。
TGI (%) = [1-(Ti-T0)/(Vi-V0)]×100(Ti:治療組在給藥第i天的腫瘤體積均值, T0:治療組在給藥第0天的腫瘤體積均值;Vi:溶劑對照組在給藥第i天的腫瘤體積均值,V0:溶劑對照組在給藥第0天的腫瘤體積均值)
2 結 果
2.1 表達載體構建
構建成功的BY24.3、BY18.1(nivolumab)和301-8(aflibercept)表達載體經由上海捷瑞生物工程有限公司進行測序,測序結果表明表達載體構建正確。為保證表達載體構建的正確性,大提質粒后,分別應用XbaI-SaII和XhoI-EcoRI雙酶切再次驗證表達載體的正確性。BY18.1(nivolumab)和BY24.3的輕鏈大小一致均為723bp,重鏈分別是1401和2058bp,301-8(aflibercept)為1365 bp。具體結果見圖1。
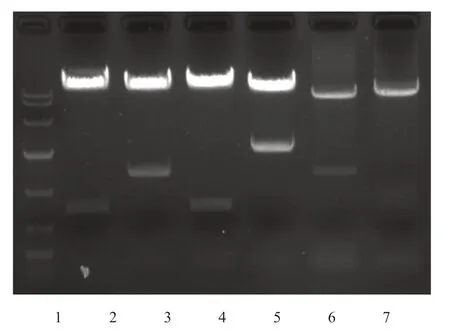
圖1 表達載體構建及重組質粒雙酶切鑒定Fig 1 Construction of expression vector and double enzyme digestion of recombinant plasmid
2.2 蛋白表達及純化
融合蛋白BY24.3的結構見圖2,輕鏈為完整的PD-1抗體輕鏈,通過二硫鍵與PD-1抗體重鏈CH1相連接,VEGFR功能區通過(G4S)3Linker連接至PD-1抗體的C末端。BY24.3輕鏈分子量理論預測23 kDa,實際25 kDa左右,重鏈分子量理論預測72 kDa,實際80 kDa左右。PD-1抗體BY18.1(nivolumab)輕鏈分子量理論預測23 kDa,實際25 kDa左右,重鏈分子量理論預測48 kDa,實際50 kDa左右;VEGFR融合蛋白301-8(aflibercept)分子量理論預測49 kDa,實際62 kDa左右。因受抗體糖基化影響,上述融合蛋白實際分子量略高于理論預測。純化后的各種蛋白還原SDS-PAGE電泳,見圖3。

圖2 雙功能融合蛋白BY24.3結構示意圖Fig 2 Schematic diagram of the construction and final assembly of the bifunctional fusion protein BY24.3

圖3 電泳法分析各純化的蛋白(還原電泳)Fig. 3 Electrophoretic analysis of the purified ptotiens(Reduced)
2.3 Biacore方法檢測純化蛋白與PD-1和VEGF -A的結合
從表1結果可以看出,BY24.3(抗PD-1/VEGFR融合蛋白)保持了BY18.1(nivolumab)抗體與PD-1的親和性,并獲得了與VEGF-A的結合能力。BY18.1(NIVOLUMAB)和BY24.3與PD-1的親和力(KD)基本一致,說明抗PD-1抗體制備成VEGFR融合蛋白后親和力未受影響。301-8(aflibercept)和BY24.3融合蛋白與VEGF-A的親和力達分別到2.74×10-12M和9.59×10-12M。301-8(aflibercept)融合蛋白與VEGF-A親和力要高于BY24.3融合蛋白,但均達到pM級別。

表1 各蛋白與VEGF-A和PD-1的親和力Table 2. Affinity parameters for BY18.1(nivolumab),BY24.3and 301-8(aflibercept) binding to Human VEGF-A or PD-1
2.4 對腫瘤生長的抑制
試驗過程中,所有動物精神狀態良好,無動物死亡。實驗結束時(首次給藥21天后),各組動物體重均出現增長,BY24.3、BY18.1(nivolumab)和301-8(aflibercept)組動物與溶劑對照組動物體重比較無顯著性差異(P>0.05),表明動物對BY24.3、BY18.1(nivolumab)和301-8(aflibercept)耐受良好。
實驗結束時,溶劑對照組平均腫瘤體積為1 3 8 6± 170 mm3, 而BY24.3、BY18.1(nivolumab)和301-8(aflibercept)組平均腫瘤體積分別為452 ± 69、739± 128和1023 ±256 mm3, TGI%分別為73.3%、50.6%和 60.2%。BY18.1(nivolumab)、301-8(aflibercept)與溶劑對照組的腫瘤體積相比有顯著差異(P<0.05),表明BY18.1(nivolumab)和301-8(aflibercept)在此藥效模型上抑瘤作用明顯。 BY24.3與溶劑對照組和BY18.1(nivolumab)、301-8(aflibercept)組腫瘤體積相比均有明顯差異(P<0.05),表明BY24.3有明顯的抑瘤作用,且高于BY18.1(nivolumab)和301-8(aflibercept)。結果見圖4。

圖4 BY24.3 ,BY18.1(nivolumab)和 301-8(aflibercept)蛋白對MC38小鼠結腸癌細胞生長的抑制作用Fig.4 Inhibitory effect of BY24.3 , BY18.1(nivolumab) and 301-8(aflibercept) on MC38 colon cancer cell in B-hPD-1 transgenic mice
3 討 論
雙特異抗體是指采用基因工程技術得到的可以結合兩個抗原或抗原表位的抗體。雙特異抗體實質是一種經基因工程產生的免疫融合蛋白。目前已有3個雙特異性抗體上市:Catumaxomab、Emicizumab 和Blinatumomab。在結構方面,雙特異抗體至少有近百種的構建技術或平臺[3],這些技術多是以兩個抗體為基礎來構建雙特異抗體,采用這些技術構建得到的雙特異抗體有各自的優勢和缺陷:比如基因泰克Knobs-into-Holes異源二聚化技術會導致相當量的同源二聚存在[4-5];雅培一直依賴的的雙可變結構域 Ig(Dualvariable domains Ig,DVD-Ig)技術,內部可變結構域結合抗原的親和力會降低近10倍甚至百倍,且分子量較大,近200 Kd,結合不同抗原(尤其是膜抗原)時依然有相互干擾現象,雅培利用DVD-Ig開發的IL-17/TNF-α雙特異抗體ABT-122和ABBV-257因在臨床試驗中發現存在較高的抗雙特異抗體(ADA)而失敗[6-7]。
PD-1/PD-L1聯合抗血管生成療法的有效性可能基于:通過阻斷VEGF的免疫抑制作用并促進T細胞在腫瘤組織中的浸潤從而提高PD-1/PD-L1單抗的療效。作用于VEGF靶點的藥物可有效“調控”腫瘤新生血管的功能趨向正常,改善由于新生血管異常而導致的腫瘤組織免疫功能“荒漠化”, PD-1或PD-L1抗體與血管生成拮抗藥物聯合用于腫瘤治療有極大的臨床應用前景。在PD-L1抗體Atezolizumab與Bevacizumab(AVASTIN)的一項治療晚期腎癌的II期臨床研究(IMmotion150),研究發現PD-L1高表達的患者接受Atezolizumab與Bevacizumab雙重療法的患者,疾病惡化或死亡率下降了36%,優于單種療法。PD-1聯合樂伐替尼用于晚期腎癌患者一線治療有效率83%,疾病控制率100%[8]。
Y-trap雙特異抗體技術為約翰·霍普金斯大學Bedi教授等于2017年首次命名[9-10]。該雙功能抗體由兩部分組成,一部分是針對特定靶標的抗體,另一部分則是受體部分。這一技術的優勢在于:受體為人體內蛋白,無免疫原性;該結構簡單,僅需要表達兩種組分,在細胞內一次組裝成成品;受體可位于抗體的N端或C端,結合不同配體(抗原)時不相互影響;有的受體與配體(抗原)的親和力比抗體還高;有的受體可以結合多個配體(抗原),具有多功能性等優勢。目前,采用這一技術比較出名的項目是M7824項目(PD-L1/TGFβRII),該項目I期臨床試驗有效率達71.4%,非小細胞肺癌有效率達80%,為免疫治療最高ORR,臨床II期M7824將直接挑戰Keytruda[10]。
本研究將抗PD-1抗體重鏈C端與VEGFR1的功能區Ⅱ(D2)VEGFR 2的功能區Ⅲ(D3))通過柔性片段(GS4)3連接構建的Y-trap雙功能抗體。該雙功能抗體具有高親和性結合PD-1和VEGF-A的功能。通過轉基因小鼠研究結果表明, BY24.3免疫融合蛋白其抑瘤效果可能遠遠好于目前上市的兩個產品Nivolumab和Aflibercept,具有超越PD-1抗體藥物對腫瘤20-30%有效率的能力,因此具有很好的臨床運用前景。

