基于微生物體系合成無機納米材料的研究進展
王文杰 陳玉霞 梁 玲 曾 波 談 潔 袁 荃*,,
(1湖南大學化學化工學院,湖南大學生物學院,化學生物學與納米醫學研究所,長沙 410082)
(2武漢大學化學與分子科學學院,生物醫學分析化學教育部重點實驗室,武漢 430072)
0 引 言
在30多億年漫長的進化歷程中,生物體已經能夠產生具有獨特和精致結構的礦物質,如珊瑚石、牙齒、骨骼和貝殼等等[1-2]。這一過程被稱為生物礦化,即生物體利用有機基質(酶、蛋白質、脂類、多糖等)對無機離子進行精確調控,最終沉淀成具有復雜結構的純無機或者無機有機混合材料[3-5]。生物礦化是生物體維系生存的一種行為[3],在細菌、真菌等微生物中廣為存在。微生物作為地球上最古老的一類生命體,具有體形極小、結構簡單、繁殖速度快等特點[6],能夠利用生物礦化過程合成出各種微小的無機材料。例如,為了在呼吸、集光的同時形成“盔甲”,硅藻等海洋生物可以讓SiO2在細胞表面快速成核、固定,形成具有微米到毫米層級結構的硅質外骨骼,并在細胞死亡后也能保持完好(圖1a)[7-9];一些厭氧性細菌被稱為趨磁細菌(magnetotactic bacteria),它們能夠在細胞內合成形態各異的Fe3O4或Fe3S4磁性納米晶體并呈鏈狀分布(磁小體鏈),從而根據地磁場進行定向移動來擺脫富養環境(圖1(b,c))[10-11];有的嗜金屬微生物群能在污水區域大量繁殖,因為它們能夠將水溶性的重金屬富集并以多種形狀結晶析出來抵御金屬毒性[12-13]。微生物作為分布最為廣泛的一類生物[6,14-15],常常暴露于極端的自然環境之下,它們需要合成各種晶形或非晶形微納尺寸的無機材料來維持自己的生存[14,16-17],這使它們成為了合成無機納米材料的天然工廠。
在過去的二十年間,納米材料正在成為物理、化學、材料等領域的研究重點。納米材料因尺寸極小(1~100 nm),具有表面效應、量子尺寸效應等特性而表現出與其宏觀材料完全不同的物理化學性能[13,18-19]。其中無機納米材料在催化、傳感、環境、醫學等領域扮演重要角色[13],并且其通常由無機物前體通過物理或化學方法制備而成[20-23]。不同于傳統方法,自然界中的微生物已天然具有將無機離子合成為含金、銀、鈣、硅、鐵等無機納米材料的能力[24]。1980年,Beveridge等[25]首次發現枯草芽孢桿菌(B.subtilis)能夠將溶液中的Au3+固定還原成粒徑不到50 nm的Au納米顆粒(AuNPs)。1999年,Klaus等[26]發現硝酸銀溶液會使施氏假單胞菌AG259(P.stutzeri AG259)的周質空間內形成高度分散、具有多種晶形的Ag納米顆粒(AgNPs)。微生物塑造納米材料的現象在上世紀末引起了納米科學家們的廣泛關注,這給無機納米材料的合成帶來了新的啟發。過去幾十年間,研究者們已經利用微生物或者微生物提取物合成了 Au、Ag、Pd、TiO2、CdS 等一系列無機納米材料并闡明了部分合成機理和影響因素[13],發現了微生物體系合成的無機納米材料具有諸多優點。首先,微生物體系合成無機納米材料的過程與微生物的生長、酶的催化等生物過程是同時進行的,保證了合成過程可以在室溫和中性pH條件下發生,環保而且成本較低。其次,微生物對無機納米材料表面進行的生物修飾也使得材料的生物相容性、分散性和穩定性較好[27-28]。上述優勢使得微生物合成技術有望成為合成無機納米材料的重要手段。
利用微生物體系合成無機納米材料正成為一個新興的、具有廣闊前景以及多學科交叉的研究領域,并且有望在未來進行商業化應用。近年來報道了許多關于微生物體系合成無機納米材料的綜述,如Gahlawat和Choudhury[23]從合成機理的角度綜述了微生物合成金屬納米材料的研究進展;李清彪和楊大鵬課題組[29]介紹了了植物、微生物等多種生物合成金屬納米材料的研究;Dahoumane等[30]綜述了藻類合成無機納米材料的進展;張春陽課題組[31]總結了近年來微生物體系和仿生體系合成半導體量子點(QDs)及其生物醫學應用的研究;龐代文課題組[32]綜述了微生物活細胞合成無機納米材料的生物應用研究進展。但是目前關于微生物體系合成不同種類無機納米材料的機理、影響因素,以及這些材料在多個領域應用的綜述還較少。為了較為全面地了解基于微生物體系合成無機納米材料的相關研究,我們將從細菌、真菌、酵母等多種微生物體系合成的金屬和非金屬等不同種類無機納米材料進行系統的綜述,并從其合成機理、影響因素及其在催化、生物醫學等領域的應用等方面進行了闡述,最后我們也對微生物體系合成無機納米材料目前存在的問題以及未來的發展進行了分析和展望。

圖1 (a)硅藻表面精致的硅質外骨骼[7];(b,c)趨磁細菌及其體內的磁小體鏈[10]Fig.1 (a)Morphology of delicate exoskeleton composed of silica on diatom cell surface[7];(b,c)Morphology of magnetotactic bacteria and intracellular magnetosome chains[10]
1 微生物合成無機納米材料的機理
不同的微生物有著不同的無機納米材料合成機制。總體來講,微生物的合成機制來源于3種生物活動過程:微生物對極端環境壓力的抵抗、對無機營養的利用和對能量代謝的需求[13,33]。微生物對極端環境壓力的抵抗能力來自于其對金屬離子的耐毒性機制,包括對金屬氧化態的改變、細胞壁吸附、多肽或多糖的螯合、射流系統等等[33-35];微生物對無機營養的需求指的是微生物主動利用無機離子合成自身的特殊結構,如硅藻主動吸收硅酸鹽合成外骨骼;微生物的能量代謝需求則是微生物將無機基質用于生物體代謝過程以獲得還原性的當量,并用于生物合成或能量儲存[13,33]。微生物體系合成無機納米材料的過程是微生物分泌的多種酶或蛋白質等生物活性分子協同作用的結果,并且不同的合成過程會利用到不同的生物活性分子中。其中常見的參與合成的生物活性分子包括還原型輔酶Ⅰ(NADH)[36]、還原型輔酶Ⅱ(NADPH)[37-38]、硝酸還原酶[34,37-39]、植物螯合肽[13,34,38]、氫化酶[40]、多糖[24,34,41]、谷胱甘肽[34,42]等等。細菌、真菌體系通常利用還原性酶的作用[24],酵母體系傾向于利用植物螯合肽的螯合過程[13,38]。大部分微生物體系合成無機納米材料的過程包括成核、生長和穩定3個步驟,因此其往往能合成具有有序晶體結構的納米材料。
微生物合成無機納米材料的機理是極其復雜且多樣的,即便對于同種微生物也存在多種機制來合成無機納米材料,這增加了對合成機理研究的難度。其中較為常見的是生物還原(Bioreduction)所主導的合成機制,它是指高價態金屬離子被微生物體系還原成低價態金屬離子或金屬單質的過程[23,29,34],此外其他種類納米材料的合成機制還受多種復雜代謝過程的控制。理解微生物合成無機納米材料的機理是控制其產品性質的關鍵,以下將對生物還原和其他合成機理分別進行討論,以進一步了解各種生物分子在合成過程中的作用。
1.1 生物還原主導的合成機理
生物還原過程幾乎存在于所有微生物合成無機納米材料的過程中,它體現了微生物對于金屬毒性的抵抗作用。生物還原主導的合成是指在還原性酶或者蛋白質等活性物質的催化下,一些生物分子(谷胱 甘肽[43]、NADH[36]、NADPH[37]、蛋白質等)作為電子供體還原金屬離子,生成水溶性更差或毒性更低的單質或低價態金屬。生物還原合成的場所分為細胞內和細胞外兩種,這取決于參與反應的生物活性分子的分布位置(圖2)。細胞內合成時,金屬離子被膜轉運系統輸送到細胞質后被生物活性分子所還原[39,42,44-46]。細胞外合成時有2種情況,第1種為微生物向胞外分泌的生物活性分子直接在胞外還原金屬離子[34,46-48],含有微生物分泌物的培養液上清液同樣也能還原金屬離子[39,42,44];第2種是在細胞表面合成,細胞壁表面的羧基、磷酸基團等先通過靜電引力吸附金屬離子(少部分情況通過共價結合),然后細胞壁、細胞膜上的生物活性分子還原金屬離子[13-14,33-34,44,49]。還原開始后,生物分子中吸引金屬離子的基團會幫助金屬顆粒快速成核、生長[14,50]。最后為了增加材料的穩定性,微生物會利用蛋白質、多糖等生物分子作為天然的包覆劑和穩定劑對顆粒進行包裹,由于靜電斥力和空間位阻的作用,納米顆粒長時間內不易團聚[39,51-53]。
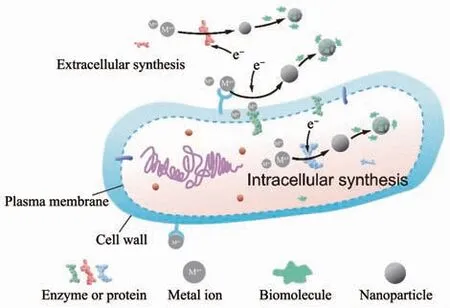
圖2 無機納米材料的生物還原合成示意圖Fig.2 Biosynthesis of inorganic nanomaterials mediated by bioreduction
金屬離子的生物還原過程往往是多種場所同時進行的。Das等[44]認為米根霉(R.oryzae)合成AuNPs時,一部分Au3+在細胞表面被蛋白質還原成AuNPs,此外另一部分Au3+滲透進入細胞質與蛋白質共價結合并被金屬還原酶還原成AuNPs(圖3a)。許多細胞外的生物還原過程還涉及到細胞利用復雜的電子傳遞途徑進行呼吸作用的過程[23,53]。香港大學支志明的團隊[49]證明了細胞色素c在大腸桿菌合成AgNPs中起到了電子傳遞的重要作用,他們認為耐銀性大腸桿菌與AgNO3溶液反應時,細胞氧化呼吸底物的同時細胞色素c的亞基NapC介導了周質空間內銀離子的還原(圖3b)。
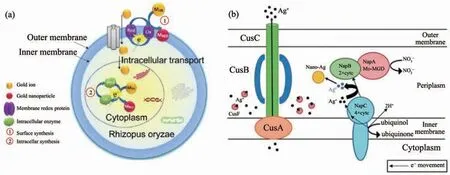
圖3 (a)真菌R.oryzae合成AuNPs的機理圖[44];(b)大腸桿菌細胞色素c亞基NapC介導的AgNPs合成機理圖[49]Fig.3 (a)Proposed mechanism of AuNPs biosynthesis by fungi R.oryzae[44];(b)Proposed mechanism of AgNPs biosynthesis mediated by c-type cytochrome subunit NapC in E.coli strain[49]
1.2 其他合成機理
對于一些處于穩定氧化態的無機離子,微生物難以通過生物還原過程將其沉淀,此時微生物需要利用更為復雜的機制來合成無機納米材料。大部分非生物還原主導的合成過程同樣具有成核、生長和穩定的過程,并且在胞內或胞外進行,但是目前很多機理尚未完全闡明。一些氧化物的合成來自于微生物介導的水解過程,如硅藻合成SiO2可能與細胞壁上硅蛋白參與的硅酸鹽水解有關[8],TiO2的微生物合成同樣來自于生物誘導的TiF62-的水解[54-55],病毒特有的表面結構還可以作為模板通過水解來合成氧化物納米材料涂層[56]。趨磁細菌合成Fe3O4納米顆粒的機理有多種解釋,其中一種認為:趨磁細菌先在胞內形成具有堿性環境的磁小體囊泡,然后細胞膜上的Fe3+被部分還原形成Fe2+及鐵蛋白并進入囊泡當中,Fe3+和Fe2+在囊泡上膜蛋白的作用下快速共沉淀,成核、生長產生Fe3O4顆粒[10,21]。Fe3S4納米顆粒的合成過程則更為復雜,其合成過程中有更多的無機相存在,目前還研究得較少[10]。CdS、PbS等含劇毒重金屬的半導體材料的合成往往與多肽等物質的螯合作用有關[13]。其中植物螯合肽和金屬硫蛋白是微生物中非常常見的穩定重金屬離子的螯合劑,這是因為植物螯合肽中的谷胱甘肽、金屬硫蛋白中的半胱氨酸基團可以有效螯合金屬離子[13,43]。這些生物源的螯合劑會在毒性條件下過表達以快速解毒,如酵母中的谷胱甘肽和植物螯合肽會高表達將Cd2+、Pb2+富集[13,42],然后半胱氨酸提供硫源以合成CdS、PbS納米顆粒[57-58]。還有一些微生物合成的無機納米材料是自身代謝過程得到的副產品,如細菌表面的S層蛋白可以促進方解石等細粒礦物的成核[14],硫酸鹽還原菌自身的硫代謝途徑促進了ZnS納米顆粒的形成[59]。總之,微生物合成無機納米材料的機理十分復雜,目前很多生物分子在合成當中的作用尚未被完全理解,還需要進一步的研究了解微生物合成無機納米材料的分子和基因機制。
2 影響微生物合成的因素
合成具有理想的成分、尺寸和形貌特征的無機納米材料一直是納米技術面臨的挑戰。在物理或化學方法中,影響合成的因素往往比較明確,而微生物合成無機納米材料的性質則受各種復雜因素的影響,導致了尺寸、形狀、合成速率相差很大[30]。影響合成效果的因素有很多,包括微生物的種類、pH值、溫度、金屬離子濃度、菌種生長期、培養基成分、孵育時間、微生物或蛋白濃度、離子強度、是否攪拌等等[30,39,46,60-63]。下面我們主要闡述了最重要的前4種因素[64]及其對微生物體系合成金屬納米材料的影響。
2.1 微生物的種類
微生物是種類極其繁多的生物群體,通常包括細菌、病毒、真菌等肉眼難以觀察到的小型生物。目前被用于合成無機納米材料的微生物有細菌、真菌、放線菌、病毒、酵母和藻類等[42,60,65-66],圖4展示了幾種微生物和它們合成的無機納米材料。由于不同的微生物具有不同的基因、蛋白和代謝過程,進行生物礦化的功能分子不同,因而它們合成無機納米材料的能力也不同[23]。
細菌因為結構簡單、生長快、容易培養[14]而最早被用于合成無機納米材料[43]。細菌由于表面的凈負電性電荷和S層蛋白[14,68]而很容易吸附金屬離子并提供成核位點。細菌中大腸桿菌的基因編輯技術較為成熟,通過基因編輯可以增強其合成無機納米材料的某些效果[69-71]。真菌是合成無機納米材料的主力軍,它們相比于其他微生物具有許多突出的優點:能承受更多的外界機械壓力,可以在無機基質上生長,生長面積大,對金屬離子的攝入量高,向外分泌的酶和蛋白量比其他微生物多,因而合成效率很高[34,42,51,65]。放線菌作為細菌的一種同樣生長繁殖快速,但放線菌同時又具有許多重要的真菌特征,如菌絲比表面積大、胞外分泌蛋白量多[34],盡管放線菌具有諸多優點,但目前對其合成能力的探索還較少。酵母是一種能夠積累大量劇毒金屬的單細胞真菌[13,34,42]。酵母的解毒能力主要來源于其富含的谷胱甘肽、金屬硫蛋白和植物螯合肽等生物分子,其中植物螯合肽可以高效地螯合Cd2+等劇毒重金屬離子[13,34,43],因此酵母很適合用于合成CdS、CdSe等納米材料[34,72]。植物螯合肽也有利于納米顆粒的穩定和分散[13],因而酵母能很容易地在胞內合成小粒徑的半導體量子點[58,67]。酵母也有基因編輯的潛力[73],這允許其像重組大腸桿菌一樣調控合成效果。藻類通常是水生的光合自養生物[30],其中有部分生物(如藍藻)屬于微生物的范疇。藻類特有的光合系統電子傳遞鏈也能起到合成無機納米材料的重要作用[53],并且藻類等水生生物適應惡劣環境的能力很強[74],因此藻類是很有潛力的“納米工廠”[30,34]。病毒很擅長利用生物還原制備無機納米材料[23,29,66],因為病毒衣殼蛋白獨特的拓撲結構和殘基有利于金屬離子的結合和還原[29,75]。病毒衣殼還可以通過基因工程進行表面修飾,成為一種組裝具有復雜結構的納米材料的模板[76],從而為金屬離子提供均勻、精確的結合位點,并對金屬離子進行選擇性還原[23,56,75]。病毒與其他微生物在生物結構和合成無機納米材料的過程方面差別過大,Lee等[56]對病毒合成無機納米材料進行了詳細的闡述。微生物合成無機納米材料的過程存在著高度的生物控制,產物的晶體形態和成分很大程度上取決于微生物的特性[77],對此我們在合成不同形貌及大小的無機納米材料時應選擇合適的生物資源。
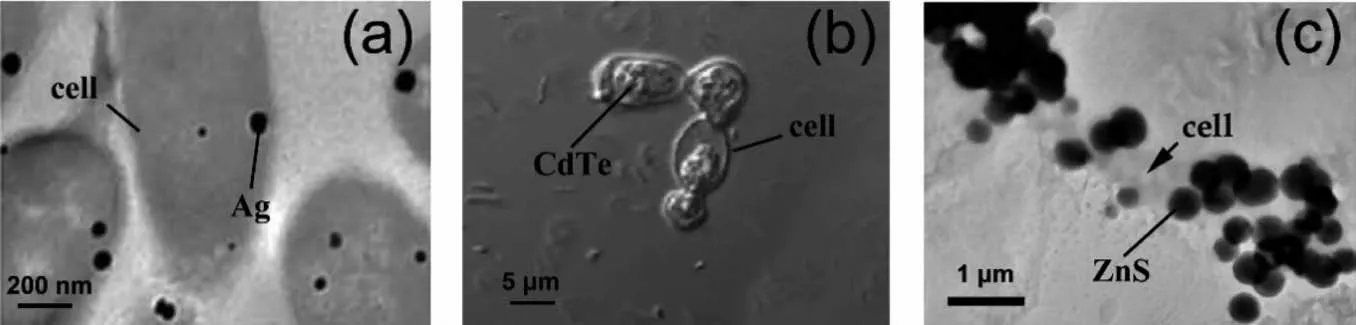
圖4 大腸桿菌 (a)[49]、酵母 (b)[67]和硫酸鹽還原菌 (c)[59]合成的Ag納米顆粒Fig.4 AgNPs biosynthesized by Escherichia coli(a)[49],yeast(b)[67]and sulfate-reducing bacteria(c)[59]
2.2 pH值
大量研究表明pH值能顯著影響微生物體系合成金屬納米材料的形貌大小和合成速率,如莢膜紅假單胞菌(R.capsulata)在pH=4時胞外合成了大于200 nm的金納米片,而在pH=7時主要合成10~20 nm大小的納米顆粒[36];輪枝孢菌(V.luteoalbum)在pH=5和7時合成AuNPs的粒徑要遠大于pH=3和9時[78];云芝(C.versicolor)蛋白在堿性條件下合成AgNPs反應速率比中性更快,反應時間從72 h減少到1 h[79];節桿菌屬(Arthrobacter sp.)胞外多糖在pH=5以下便失去了合成AgNPs的能力,而在pH=7到8之間能快速還原Ag+[41];一些微生物及其提取物的合成速率還在某一特定pH值下達到最大值[80-81]。因此,pH值被認為是影響微生物合成的一個重要因素[82]。
pH值對不同微生物合成的金屬納米材料會產生不同的效果。其中一種關于pH值影響微生物合成的解釋認為,質子濃度會影響生物活性分子的總電荷,進而影響它們對金屬離子的吸附積累量[83]和對晶體生長的控制能力[82]。以AuNPs的合成過程為例,pH值較低時質子濃度很大,容易使參與還原過程的氨基、巰基、羧基等基團帶更多正電荷,導致了其還原能力和還原速率的下降[33,36,48],但同時生物活性分子也更容易吸附Au3+與生物分子形成的負電性絡合物或者AuCl4-,最終聚集形成大塊的金納米片[33,48];pH值較高時則生物活性分子的還原能力增強、還原速率增加,但帶負電性的Au3+絡合物或AuCl4-與生物分子的結合能力變差,易于形成熱力學上更穩定的小粒徑、單分散的球形AuNPs[36,62]。過于酸、堿性的環境不僅不利于還原過程的進行,還可能會引起材料表面電荷的不穩定,導致團聚現象發生[41,62]。此外,pH值還可能影響酶和蛋白的活性、細胞攜帶的電荷、細胞膜的通透性等因素,最終得到不同的合成效果,并可能因此產生合成過程的最適pH值。
2.3 溫 度
微生物體系作為一個復雜的化學反應體系,必然受溫度控制。一般來說,隨著溫度的升高,微生物體系合成金屬納米材料的速率會加快。例如,摩根氏菌屬(M.psychrotolerans)合成AgNPs的速率在4~25℃的溫度范圍內隨溫度不斷提高[84];一些耐溫范圍更廣的微生物或微生物提取物,它們合成金屬納米材料的速率也會隨著溫度的升高而增加[78,85-86]。李玉梅等[41]探究了不同溫度孵育下Arthrobacter sp.胞外多糖合成AgNPs的速率。當孵育溫度為70℃時,10 min內就可以觀察到AgNPs的形成;當溫度升至80℃時,合成過程為5 min;而在90℃時,合成過程則不到2 min。也有研究表明微生物體系合成一些金屬納米材料的過程存在最快反應溫度,如南極假單胞菌(P.Antarctica)為22 ℃[80],癭青霉(P.Fellutanum)為10~20℃[81]。溫度的改變同樣能影響材料的形貌,如M.psychrotolerans在20℃時主要合成球形AgNPs,而在4和25℃時主要合成多邊形銀納米片[84];V.luteoalbum在50℃時會生成大的球形或多種其他形狀的金納米材料,而在25℃時僅有小粒徑顆粒形成[78]。
溫度對微生物體系合成金屬納米材料的影響機制目前還不夠清楚。一般認為,一定范圍內溫度的升高加速了金屬離子的細胞內積累和還原過程[46,60],有利于顆粒表面二次還原的發生從而形成大顆粒[86],但反應物的消耗速度和材料的成核速度的加快有時反而會導致形成小粒徑顆粒[63,85],具體的影響效果還需要視合成途徑而定。溫度過高會導致材料表面生物分子變性以及酶的失活[62-63],不僅不會繼續提高合成效率,還會不利于其穩定分散,導致團聚現象更加嚴重[87]。
2.4 金屬離子濃度
金屬離子是微生物合成金屬納米材料的原料離子。微生物雖然具有一定的金屬耐受性,但大量的金屬離子對于微生物結構的破壞是不可避免的。隨著金屬離子濃度的增大,更多的金屬離子參與到合成過程中,導致最初微生物合成速率顯著增加,但過高的金屬離子濃度會使微生物死亡或生物分子失活,最終導致合成效率急劇下降[60,81]。目前對于金屬離子濃度與金屬納米材料形貌、大小的關系也有許多人進行了研究。V.luteoalbum被報道在HAuCl4濃度較小時(250和500 mg·L-1)合成20 nm左右的納米顆粒,當 HAuCl4濃度增至2 500 mg·L-1時,合成出來的則是200 nm左右形狀不規則的金納米片[78];Riddin的團隊[88]利用硫酸鹽還原菌群的蛋白進行Pt納米顆粒合成時,發現H2PtCl6與蛋白的質量濃度比值的改變會明顯影響顆粒形貌,當比值為0.7∶1時容易形成大塊的不規則顆粒并且團聚現象嚴重,比值為2∶1時則會形成粒徑較小、分散性較好的方塊狀顆粒;東南大學顧寧課題組[89]發現R.capsulata在HAuCl4物質的量濃度較低時只會產生10~20 nm的球形AuNPs,而當HAuCl4濃度較高時則會形成具有網狀結構的金納米線,他們認為這和包覆劑(參與合成和穩定過程的蛋白質等生物分子)與HAuCl4的濃度比值以及奧斯特瓦爾德成熟(Ostwald ripening)過程有關;Das等[61]對真菌 R.oryzae提取物合成AuNPs的影響因素進行了深入研究(圖5),他們同樣認為金屬納米顆粒的大小和形狀受包覆劑與金屬離子質量濃度的比值控制,這些參與合成和穩定過程的蛋白在晶體上的吸附水平會隨著金屬離子濃度的改變而改變,從而誘導產生了不同形狀的晶體。
3 微生物合成的無機納米材料
無機納米材料因其獨特的光學、電學、磁學和熱學等性能受到了廣泛關注,不同無機納米材料的性能也各不相同。為了滿足各種應用的需要,科學家們對微生物體系合成無機納米材料的能力進行了廣泛探索,成功地誘導了多種微生物從無機離子前體合成出不同的無機納米材料,并通過多種手段表征了這些材料的理化性質以及探究了其在不同應用領域的發展前景。下面將從微生物體系所合成的各種無機納米材料的角度進行綜述,并在表1中歸納了一些微生物合成的無機納米材料。

圖5 在不同的pH值、Au3+離子濃度下由R.oryzae提取物合成的不同形貌和大小的AuNPs[61]Fig.5 AuNPs with various morphologies and sizes synthesized by R.oryzae extract at different pH values and Au3+concentrations[61]
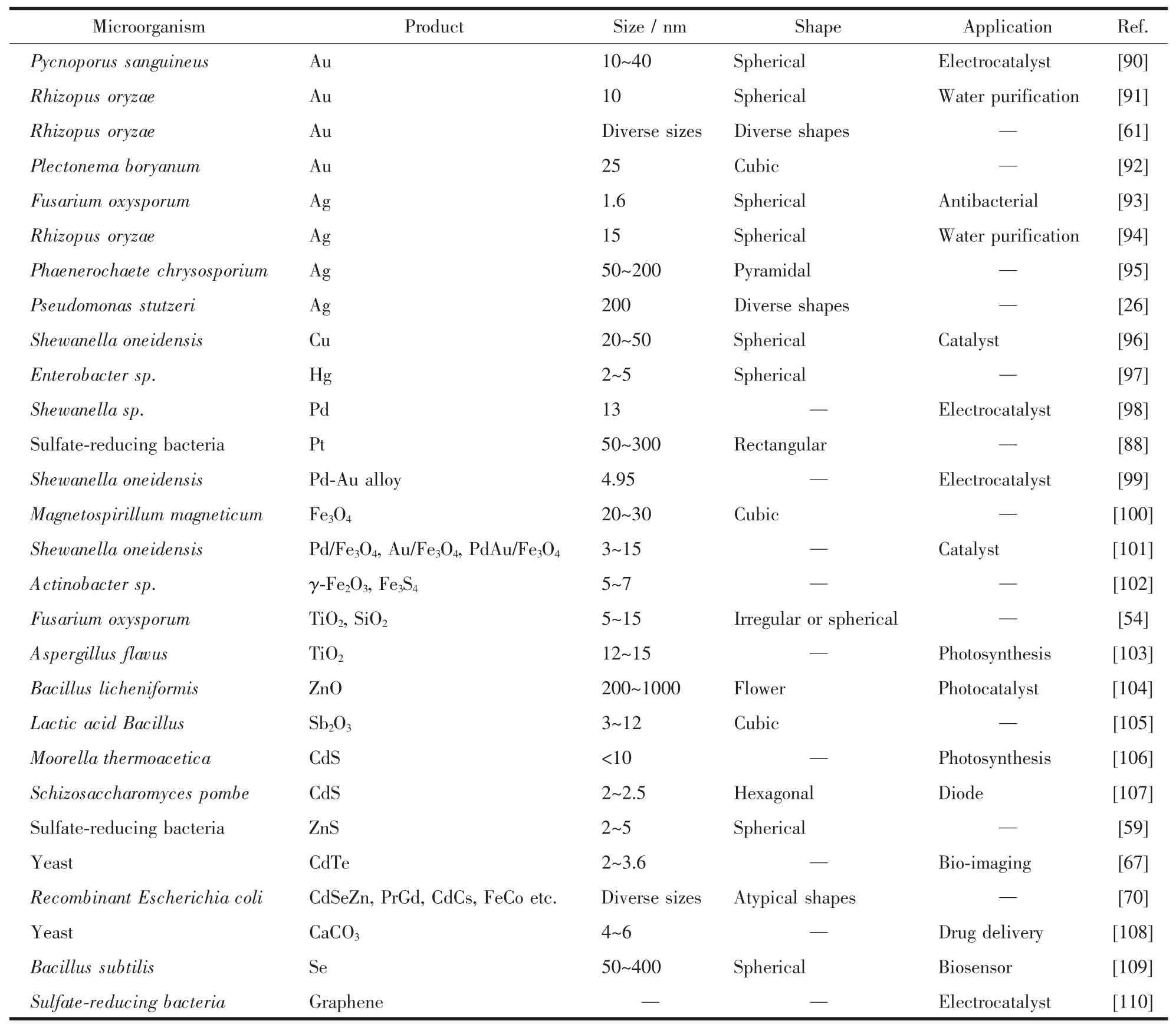
表1 一些微生物合成的無機納米材料及其性質Table 1 Some inorganic nanomaterials synthesized by microbes and their properties
3.1 金屬納米材料
3.1.1 金和銀納米材料
由于合成過程簡單,過去幾十年間金和銀納米材料被視作研究微生物合成無機納米材料的簡單模型而得到了廣泛的研究[28,39,48]。1980年,Beveridge等[25]最早發現細菌B.subtilis能夠合成AuNPs,而后2001年Mukherjee等首次利用真菌合成了AuNPs[111]和AgNPs[112],目前人們已經能夠運用多種微生物資源合成具有復雜結構的金、銀納米材料,如顧寧課題組[89]報道了用R.capsulata合成出金納米線,最近Sreedharan等[64]還成功地用B.subtilis合成出了具有較高比表面積的金納米花。微生物體系合成的金、銀納米材料不僅在形貌上高度可控,還因為在光、電、抗菌等性能方面表現優異而具有一定的應用潛力。早期微生物體系合成的金和銀納米材料常應用于醫療、環境領域,如Durán等[93]用尖孢鐮刀菌(F.oxysporum)制備出的AgNPs對棉衣進行抗菌化處理,一些真菌合成的金和銀納米材料還被用于促進傷口愈合[113]、消毒凈水[91,94]等。此外,Joerger 等[114]率先以細菌P.stutzeri AG259細胞作為碳基質,并將細胞碳基質和細菌合成的AgNPs以薄膜形式沉積在鋁基上合成出具有典型金屬陶瓷性能的陶瓷-Ag復合材料。這種將微生物同時作為無機納米材料的還原載體和應用載體的方法可以有效繞過無機納米材料與微生物分離這一繁瑣的步驟[29],并能在一定程度上提高其理化性質,為后來微生物合成金屬-碳材料的研究提供了新穎的思路。2016年,加州大學圣克魯茲分校陳少偉和華南理工大學周偉家等團隊[90]利用細菌膜作為電催化載體來改善微生物合成AuNPs的電催化性能。他們首先在血紅密孔菌(P.sanguineus)表面和內部合成出了AuNPs,該 AuNPs緊密吸附在經過Ar氣氛高溫煅燒后成為了氮摻雜碳基材料(NC)的細胞膜上,最終組成了負載AuNPs的氮摻雜碳基復合材料(Au@NC)(圖6)。C、N元素的引入顯著增強了AuNPs的電化學性能,Au與NC之間存在大量的電荷遷移過程,因此Au@NC表現出對析氫反應(HER)及氧還原反應(ORR)高效的電催化活性。除了微生物膜,其他納米材料也能同時成為金、銀納米材料的還原和應用載體以增強微生物合成金和銀納米材料的性能。安徽大學石先陽課題組[115]利用奧奈達希瓦氏菌(S.oneidensis)在硝酸改性的多壁碳納米管(MWNTs)上原位合成了高度分散的AgNPs。改性后的MWNTs因具有大量成核位點而容易促進S.oneidensis合成高度分散的AgNPs,MWNTs優異的導電性能還顯著增強了Ag催化降解4-硝基苯酚的能力。除了與納米材料結合,一些微生物合成的AuNPs還會很容易與生物分子本身組成偶聯物而增強AuNPs的吸附或催化性能[116],因為AuNPs表面的生物修飾作用,微生物合成的AuNPs還表現出比對照組AuNPs更強的表面增強拉曼(SERS)效應[52]。由于微生物體系合成的金和銀納米材料具有形貌可控、性能優異、合成過程簡單等特點,在過去幾十年間微生物合成技術已經發展成為合成金、銀納米材料的一種重要手段,未來將有可能在大規模生產方面實現重要突破。
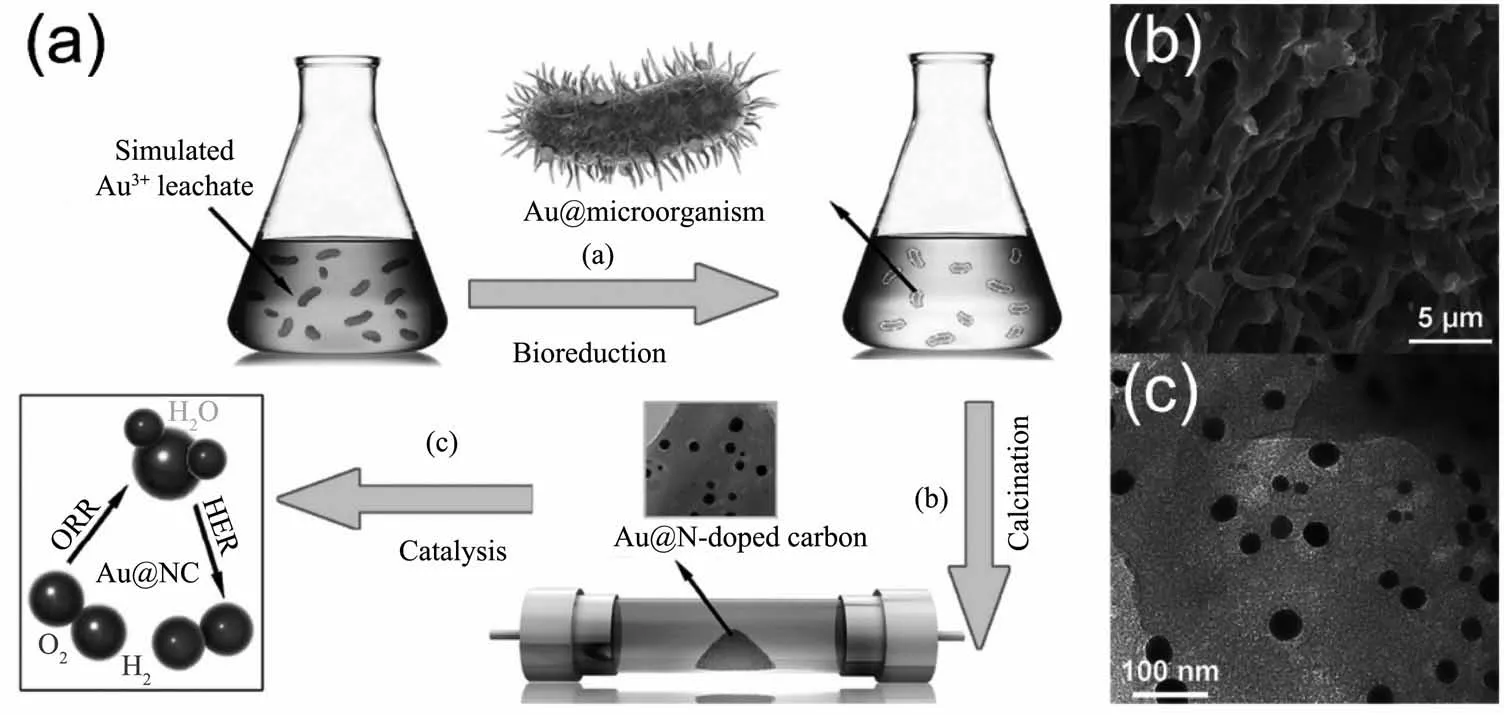
圖6 (a)Au@NC的合成過程示意圖[90];(b)Au@NC的SEM圖中的纖維形態的Au@NC及亮點狀的AuNPs[90];(c)Au@NC的TEM圖中的AuNPs負載于NC上且粒徑為10~40 nm[90]Fig.6 (a)Preparation of N-doped carbon-supported AuNPs(Au@NC)[90];(b)Fibrous morphology of Au@NC and bright Au dots in SEM image[90];(c)AuNPs with sizes ranging from 10 to 40 nm loaded on N-doped carbon(NC)in TEM image[90]
3.1.2 其他金屬納米材料
受到微生物合成金、銀納米材料的啟發,人們探索了微生物合成其他金屬納米材料的能力。其中Pd、Pt兩種金屬單質具有出色的穩定性和催化性能,所以開發微生物合成Pd、Pt納米材料的方法顯得尤為重要。Lloyd的團隊[117]最早嘗試了以丙酮酸、甲酸或H2等外加物質為電子供體,利用微生物來回收廢液中的Pd2+并得到了Pd納米顆粒,幾年后Lengke的團隊[118]又用微生物合成出了Pt納米顆粒。由于微生物對金屬離子的吸附作用,Pd、Pt納米顆粒往往會沉淀在細胞表面并被細胞膜有效分散和穩定,其催化活性得到了提高[119-120]。基于這一點,中國科學技術大學俞漢青課題組[98,121]進一步提出用高溫碳化方法由S.oneidensis合成雜原子摻雜的Pd-C介孔納米材料以提高Pd納米顆粒的催化性能和導電性能。他們首先利用細菌S.oneidensis還原PdCl42-,在細胞表面合成了生物源的Pd納米顆粒(Bio-Pd),接著向Pd與微生物的混合溶液中加入KOH高溫活化數小時,KOH高溫脫水形成的K2O與微生物膜反應產生了內部微孔和缺陷,最終合成出負載Pd納米顆粒的雜原子摻雜的介孔碳材料(圖7a)。導電性的介孔碳材料具有較高的比表面積且Pd在介孔碳上分散良好(圖7(b~c)),因而該Pd-C介孔納米材料表現出良好的催化降解4-硝基苯酚的能力和氧還原反應電催化活性。石先陽課題組[122]還利用S.oneidensis在TiO2納米管上原位制備出了Pd-TiO2復合光催化劑,進一步擴展了微生物合成Pd納米材料在光催化領域的應用。除了Pd、Pt,微生物合成其他金屬納米材料的能力也得到了初步探索,如S.oneidensis合成Cu納米顆粒(CuNPs)(圖7(d~f))[96]、腸桿菌屬(Enterobacter sp.)合成 Hg 納米顆粒[97]、乳酸菌合成Ti納米顆粒[123]、多種細菌合成La等納米晶體[124]等。這些方法合成的金屬納米材料具有良好的分散性和穩定性,對后續實現微生物合成多種金屬納米材料具有重要的借鑒意義。
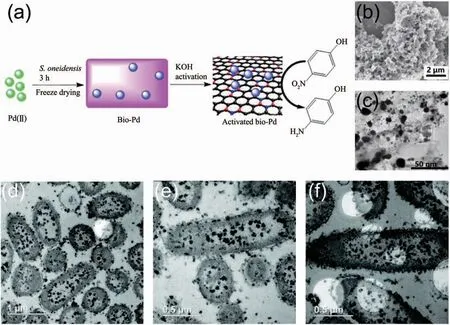
圖7 (a)由S.oneidensis合成負載Pd納米顆粒的雜原子摻雜介孔碳材料示意圖[121];(b)400℃高溫活化后S.oneidensis細胞和Pd納米顆粒的SEM圖[121];(c)400℃高溫活化后S.oneidensis細胞和Pd納米顆粒的TEM圖[121];(d~f)S.oneidensis在細胞內大量合成的CuNPs的TEM圖[96]Fig.7 (a)Preparation of heteroatom-doped porous carbon materials with Pd nanoparticles synthesized by S.oneidensis[121];(b)SEM image of Pd nanoparticles and S.oneidensis cells after activation at 400℃[121];(c)TEM image of Pd nanoparticles and S.oneidensis cells after activation at 400 ℃[121];(d~f)TEM images of large amounts of CuNPs synthesized in S.oneidensis cytoplasm[96]
3.1.3 雙金屬納米材料
由于協同效應,雙金屬納米材料往往在某些方面比金屬單質性能更突出[99,125],因此近年來出現了許多關于微生物合成雙金屬納米材料的研究。Nair和Pradeep[126]首次提出用乳酸菌同時還原金和銀前體在細胞內合成Au-Ag合金納米材料,進行了微生物合成雙金屬納米材料的重要嘗試,后來Senapati等[127]進一步采用真菌胞外合成Au-Ag合金納米材料并改善了其分散性,這一系列的研究使得微生物合成雙金屬納米材料的能力引起了廣泛關注。微生物體系合成雙金屬納米材料的合成過程簡單、分散性較好,具有用于制備電極材料的潛力,如武漢大學胡成國的團隊[128]將酵母胞外合成的Au-Ag合金納米顆粒用于修飾電化學傳感器并將其靈敏度提高了5倍。但是非導電性的微生物膜容易吸附合金納米材料、高溫碳化處理會導致顆粒團聚等問題往往限制了其在電化學等領域的應用。對此華中農業大學韓鶴友和中科院城市環境研究所趙峰的團隊[99]提出利用細菌S.oneidensis基于氧化石墨烯(GO)和高溫碳化過程合成合金-碳陽極材料以解決這些問題。他們首先在細菌S.oneidensis表面先后還原PdCl4-、AuCl4-得到了微生物膜負載的Pd-Au合金材料,然后在微生物膜-Pd-Au材料表面進一步涂覆GO,最后通過水熱反應制備出了具有三維多孔結構的雜原子摻雜的Pd-Au合金/還原氧化石墨烯(rGO)復合材料。高溫碳化和包裹rGO后的細胞膜導電性顯著提升,并且預先進行GO的包裹避免了高溫碳化時顆粒聚集的問題,提高了合金材料的比表面積。因此,這種合金納米材料和碳納米材料的組裝方法將大大提升合金納米材料的電學性能。安徽大學程園園等[129]在催化應用方面也采取了類似的策略,但是他們沒有進行高溫碳化過程,而是用S.oneidensis一步還原合成了Pd-Ag/rGO復合材料,并將其用于催化降解污染物,充分展示了細菌S.oneidensis在合成金屬-碳納米材料方面的巨大潛力。總之,S.oneidensis等微生物因具有強大的生物還原能力為合成雙金屬納米材料提供了巨大探索空間,從而成為微生物體系合成無機納米材料在催化、電化學領域應用的重要生物資源。
3.2 金屬氧化物和金屬硫化物納米材料
由于合成機制復雜,人們對微生物體系合成金屬氧化物和金屬硫化物納米材料的探索經歷了漫長的過程。趨磁細菌是最早被發現可以合成金屬氧化物和金屬硫化物納米材料的微生物之一,1975年Blakemore[130]在Science上首次展示的這種能在細胞內合成鏈狀磁性納米顆粒的微生物引起了當時多個領域的關注。趨磁細菌能利用Fe3+在細胞內合成具有長方形、子彈形、菱形等多種晶形的Fe3O4、Fe3S4、γ-Fe2O3等磁性納米顆粒[10,77],因此其一直被當作生物礦化過程的標準模型而得到了廣泛研究[10]。盡管其基因層面的合成機理尚不明確,但人們已經從中學習并利用其他多種微生物合成了Fe3O4、Fe3S4、Co3O4、FeS2等磁性納米材料[10,43,131],如Bharde等[132]利用真菌胞外分泌蛋白使鐵前體水解形成方塊狀Fe3O4納米顆粒;Byrne的團隊[133]嘗試了利用硫還原地桿菌(G.sulfurreducens)合成Zn置換的磁鐵礦納米顆粒。相比于非磁性納米材料,由微生物合成的磁性納米材料具有許多獨特的性質[134]。首先,磁性納米材料更容易從反應體系中回收利用。大連理工大學柳廣飛的團隊[101]利用S.oneidensis MR-1先在胞外合成了Fe3O4納米顆粒,然后在Fe3O4表面進一步通過生物還原過程合成了 Pd/Fe3O4、Au/Fe3O4和PdAu/Fe3O4納米復合材料(圖8),該復合材料不僅能有效催化降解有機污染物,Fe3O4納米顆粒的存在還使得該催化劑可以通過磁場回收;Coker等[135]用鐵還原菌同樣得到了Fe3O4納米顆粒負載的Pd催化劑;Watson等[136-137]認為硫酸鹽還原菌產生的FeS具有吸附水中重金屬離子的能力,并且FeS能夠通過磁場從水中分離而實現水的凈化。其次,一些趨磁細菌合成的磁性納米材料具有高度可控的形貌特征、良好的生物相容性和超順磁性,因而在生物醫學領域具有廣闊的應用前景[10,57],例如Lisy的團隊[138]將趨磁細菌中磁螺菌(M.gryphiswaldense)合成的磁性納米材料作為造影劑,用于巨噬細胞的磁共振成像(MRI);Matsunaga等[21]還綜述了趨磁細菌等微生物合成的磁性納米材料在生物醫學領域的應用,包括藥物遞送、DNA提取、免疫分析等。這些成果都表明對合成磁性納米材料的微生物的研究具有重要的意義。
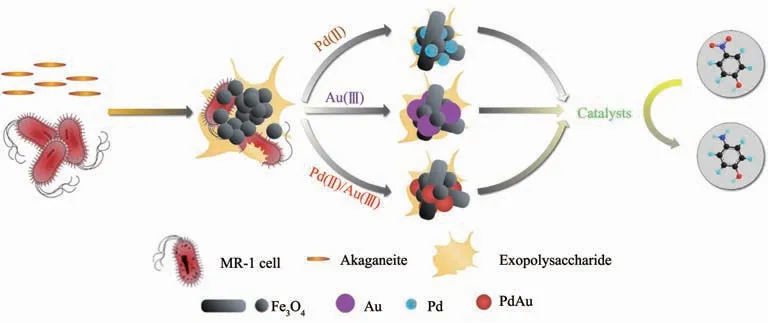
圖8 由S.oneidensis MR-1合成Pd/Fe3O4、Au/Fe3O4和PdAu/Fe3O4納米復合材料的示意圖[101]Fig.8 Biosynthesis of Pd/Fe3O4,Au/Fe3O4and PdAu/Fe3O4composites by S.oneidensis MR-1[101]
不同于趨磁細菌,硅藻可以利用細胞壁表面的蛋白質將海水中的硅酸鹽水解而產生緊密排布的SiO2材料。受微生物這種強大水解活性的啟發,研究者們可以由微生物合成許多金屬氧化物,如真菌F.oxysporum被報道通過生物誘導的水解作用由TiF62-和SiF62-溶液合成 TiO2和SiO2納米顆粒[54]以及由ZrF62-溶液合成ZrO2納米顆粒[55];乳酸菌被報道由Sb3+合成了Sb2O3納米顆粒[105]。除了上述氧化物外,UO2[139]、Ag2O[140]、CeO2[141]、Bi2O3[142]、CuO[143]等納米材料均能由微生物以多種涉及水解或氧化過程的機制合成。在這些氧化物當中,一些半導體納米材料因具有出色的光電性能而被用作光催化劑。例如,Raliya等[103]利用黃曲霉(A.flavus)胞外合成了粒徑只有幾納米的TiO2納米顆粒,他們將TiO2噴灑到植物葉面后有效促進了植物的生長,這表明微生物合成的TiO2納米顆粒具有良好的光催化性能和生物相容性;Tripathi的團隊[104]還利用地衣芽孢桿菌(B.licheniformis)合成了ZnO納米花,并表明B.licheniformis合成的ZnO具有較強的光催化降解有機污染物的性能。
與上述合成氧化物的機制有所不同,許多微生物合成金屬硫化物納米材料的能力是來自于對重金屬脅迫的抵抗。1989年,Dameron等[144]最早發現酵母可以在螯合肽的作用下由Cd2+溶液合成CdS QDs;Cunningham和Lundie[145]接著在1993年指出半胱氨酸和CdCl2能使大腸桿菌表面沉淀出CdS顆粒。一般認為,微生物為了避免重金屬離子的毒性作用,他們會利用半胱氨酸等含硫分子誘導重金屬離子沉淀而解除毒性。研究者們已經發現酵母在這方面表現出色,它們利用細胞內富含的多肽將重金屬離子螯合并在液泡當中隔離[13,32],進而利用半胱氨酸合成多種硫化物納米晶體。由于酵母細胞的解毒能力出色,且酵母合成的無機納米材料往往尺寸較小而均一,它們一直在金屬硫化物納米材料的合成當中扮演著重要的角色[13,31,34],如酵母被報道合成CdS[107]、PbS[146]、ZnS[147]等多種納米材料。除了酵母,許多微生物也廣泛具有合成 CdS[148]、ZnS[59]、PbS[148-149]、Ag2S[26,150]、HgS[148,151]、Bi2S3[152]、CuS[153]等金屬硫化物的能力,但是合成機制不盡相同。無論是哪種機制,微生物合成的許多金屬硫化物納米材料具有良好的晶體結構和較小的尺寸,故這些材料很好地保持了半導體的性能[13]。楊培東課題組[106]以半胱氨酸作為硫源在非光合作用的CO2還原細菌熱醋穆爾氏菌(M.thermoacetica)細胞表面合成了CdS納米顆粒,并通過CdS半導體納米顆粒與細菌Wood-Ljungdahl固碳途徑的結合實現了非光合細菌對太陽能的有效利用。半導體CdS在光照下躍遷產生的大量電子可以參與到非光合細菌M.thermoacetica還原CO2的電子鏈當中,使其進行光合作用產生乙酸(圖9),并且量子產率達到了85%左右。Kowshik的團隊[107]還將粟酒裂殖酵母(S.pombe)合成的CdS納米晶用于制備二極管裝置,由于顆粒表面生物修飾的作用,該二極管具有工作電壓低,正向電流大等特點。這些研究表明微生物將有望成為合成半導體納米材料的小型工廠,未來應當進行更多的探索。
3.3 其他金屬化合物納米材料
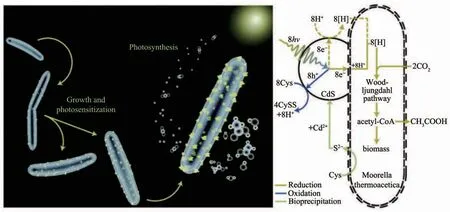
圖9 非光合細菌M.thermoacetica合成CdS納米顆粒及隨后還原CO2的示意圖[106]Fig.9 Depiction for biosynthesis of CdS nanoparticles and subsequent CO2reduction by nonphotosy nthetic bacteria M.thermoacetica[106]
除了硫化物半導體量子點外,微生物還具備合成其他多種量子點的能力。例如,武漢大學龐代文課題組[32]提出將酵母內Se的還原代謝途徑和Cd2+離子的解毒途徑相耦合用于合成CdSe QDs,他們首先利用酵母細胞中的谷胱甘肽及相關還原性酶將Na2SeO3還原成Se-Cys復合物,然后復合物在谷胱甘肽的作用下與Cd2+結合最終形成CdSe QDs(圖10a)[58]。他們還進一步研究了CdSe QDs的控制合成及發光性質,結果表明隨著Cd2+孵育時間的延長,CdSe QDs的直徑不斷變大,由2.77 nm左右變為6.34 nm左右,CdSe的發光波長也隨之紅移 (圖10(b~d))。基于酵母合成CdSe QDs優異的發光性能,中國藥科大學吳盛美和嚴拯宇的團隊[154]進一步利用含有CdSe QDs的酵母細胞作為熒光探針檢測水中和血漿中的Cu2+,首次實現了利用活細胞內生物合成的量子點進行離子選擇性檢測。不同于上述胞內合成量子點的過程,趙東元院士的團隊[67]另辟蹊徑在酵母胞外合成了CdTe QDs,他們指出胞外合成的CdTe QDs同樣具有尺寸可調、熒光發射較強的特點,并且胞外合成的量子點極易回收處理,CdTe QDs在被酵母內吞后還可以實現對酵母細胞的原位生物成像。微生物合成的各種半導體量子點因具有出色的水溶性和生物相容性,在生物醫學領域具有廣闊的應用前景,對此張春陽課題組[31]有詳細的綜述。為了進一步提升微生物合成量子點等無機納米材料的能力,Park等[70]利用基因編輯技術由微生物合成了多種量子點以及其他金屬納米材料。他們將其他物種的植物螯合肽合成酶和金屬硫蛋白的基因引入大腸桿菌后,成功地合成出了CdZn、CdSe、CdTe、SeZn、CdSeZn、PrGd、CdCs和FeCo 等無機納米材料。這項研究充分說明了基因編輯技術將成為微生物合成新型無機納米材料的一把利劍,能進一步豐富微生物合成無機納米材料的種類。
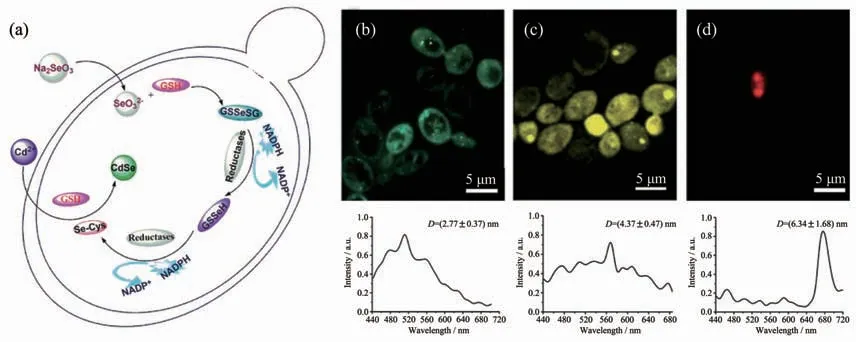
圖10 (a)酵母合成CdSe QDs的機理圖[58];(b~d)經Cd2+孵育(b)12、(c)24和(d)40 h后酵母的共聚焦顯微鏡熒光圖像及其相應的原位熒光光譜[58]Fig.10 (a)Proposed mechanism of CdSe QDs biosynthesis by yeast[58];(b~d)In situ laser confocal scanning microscopy photographs and corresponding fluorescence spectra of yeasts after incubation with Cd2+for(b)12,(c)24,and(d)40 h,respectively[58]
微生物合成CaCO3、CaSO4等無機鹽的例子在自然界中相當常見。微生物通過生物礦化合成這些礦物質來維持自身的生存,因此利用微生物這種與生俱來的能力可以合成一些無機鹽類納米材料。例如,河南師范大學楊林的團隊[108]利用酵母呼吸產生的CO2在生物分子的引導下與溶液中的Ca2+反應在胞內合成了CaCO3納米顆粒,這種內源性的CaCO3支架可以誘導藥物進入細胞,然后作為pH響應的藥物遞送載體;廈門大學賈立山課題組[155]還利用了畢赤酵母(P.pastoris)提取物合成了Cu摻雜的LaCoO3光催化劑,Cu的摻雜和材料表面的生物修飾使得該催化劑對甲醛溶液制氫反應具有較強的光催化活性。此外,微生物細胞生物礦化的能力還被用于合成細胞外殼。浙江大學唐睿康課題組[156]通過提高酵母細胞表面的電荷密度,在酵母細胞表面原位誘導合成了一層磷酸鈣外殼,該外殼不僅保持了細胞的生命活力,還可以在惡劣的外部條件下保護細胞。除了上述無機鹽外,微生物還被用于合成SrCO3[157]、BaTiO3[158]、FePO4[50]等多種納米材料。基于微生物復雜的代謝過程,未來利用微生物合成各種具有復雜成分和結構的無機納米材料成為了可能。
3.4 其他非金屬納米材料
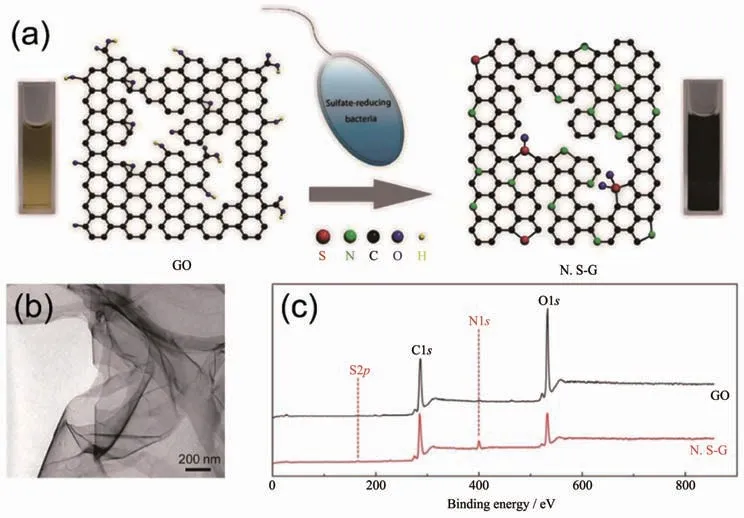
圖11 (a)硫酸鹽還原菌通過生物還原合成氮和硫摻雜的石墨烯材料(N,S-G)的示意圖[110];(b)N,S-G的TEM圖[110];(c)GO和N,S-G的XPS圖譜[110]Fig.11 (a)Preparation of nitrogen and sulfur-doped graphene(N,S-G)by microbial reduction of sulfate-reducing bacteria[110];(b)TEM image of N,S-G[110];(c)XPS survey spectra of GO and N,S-G[110]
一些非金屬離子也被報道可以由微生物體系合成非金屬單質及其氧化物、硫化物納米材料,特別是一些準金屬元素受到了研究者們的廣泛關注[15,159]。例如,Baesman的團隊[160]用2種厭氧菌合成了具有針狀和球狀的Te納米顆粒;中科院合肥智能機械研究所劉錦淮的團隊[161]利用B.subtilis合成出Se納米球和納米線并將其用于制備H2O2生物傳感器;Lee的課題組[162]利用希瓦氏菌屬(Shewanella sp.)在厭氧條件下合成了As2S3納米管,隨著時間的推移,納米管的結晶度和化學成分也在不斷變化,最終產生了As4S5、AsS等多種砷化物;As2O3也被報道可以由微生物合成得到[163]。基于微生物強大的生物還原能力和復雜的表面結構,近年來微生物還被用于合成碳納米材料。Salas[164]和李軼[165]的團隊利用Shewanella sp.在常溫有氧條件下還原GO合成了石墨烯材料。加州大學圣克魯茲分校李軼的團隊認為Shewanella sp.在還原GO的過程中不僅外膜的細胞色素c直接介導了胞外的電子轉移,而且細菌自分泌的可溶性電子介質也參與了胞外電子轉移過程[165]。中科院化學研究所劉云圻院士和華中科技大學王帥的團隊[110]還進一步利用硫酸鹽還原菌還原GO得到了氮和硫摻雜的石墨烯材料(圖11),并將其用于制備檢測Cd2+和Pb2+的電化學傳感器。此外,細菌繁殖時所合成的細菌纖維素因具有復雜的三維多孔網狀結構近年來被廣泛用于合成三維碳納米材料[166],微生物膜也因具有高比表面積和許多雜原子而被用于合成碳基材料。盡管微生物具有合成多種非金屬納米材料的潛力,但目前這方面的研究還較少,微生物合成其他非金屬納米材料的方法還有待開發。
4 總結與展望
過去幾十年間,人們已經利用微生物的多種生存代謝機制得到了不同種類的無機納米材料。這些基于微生物體系合成的無機納米材料不僅完整地保留了傳統物理、化學方法合成納米材料的光學、電學、磁學等性質,還具有環境友好、成本低廉、生物相容性好等突出優點。因此,利用微生物體系合成無機納米材料這一領域正不斷得到重視,并在生物醫學、催化等方面實現了初步應用。盡管這一領域目前已經取得了巨大的進展,但未來還有許多工作需要進一步開展:
(i)深入研究微生物合成無機納米材料的機理,精確控制無機納米材料的形貌特征。盡管人們已經知道微生物的解毒機制和其他代謝過程在合成中起關鍵作用,但仍有很多微生物的合成機理尚不明確,細胞的轉運機制、pH值、金屬離子濃度、培養介質、材料表面的生物分子如何具體影響合成過程仍有待闡明,這導致目前微生物合成無機納米材料的分散性、尺寸控制還不夠理想。對此,已有許多團隊在分子和基因水平上對微生物合成無機納米材料的機理進行了研究。支志明[49]和Vasylevskyi[167]的團隊對參與大腸桿菌和細菌G.sulfurreducens合成AgNPs的生物分子進行了精確定位,闡明了生物還原的電子傳遞過程,對于理解生物分子在生物還原中的作用有著重要的意義。龐代文課題組[32,58]基于對酵母的Se還原途徑和Cd解毒過程的理解,設計出了合成具有理想尺寸和發光性能的CdSe QDs的方法。Kang等[69]根據植物螯合肽的解毒機制,將植物螯合肽合成酶的基因引入大腸桿菌,其所合成的CdS納米晶的尺寸均勻性得到了優化,證明了從基因層面調控微生物合成無機納米材料效果的可能性。此外研究者們還一直通過基因測序等手段試圖探究和模仿趨磁細菌合成高度有序磁性納米材料的能力,但是進展仍然緩慢[10]。盡管目前人們對微生物合成機制方面的理解非常有限,但從分子和基因層面研究微生物合成機制將是合成出具有理想尺寸、形狀和分散性的無機納米材料的出路之一,故未來應當更多地在分子和基因水平上深入探索微生物合成無機納米材料機理。通過了解生物分子的表達和作用過程,以及合成參數對生物分子的影響,我們可以在時間和空間上對微生物誘導的還原、成核、生長、穩定等過程進行選擇性調控,最終像物理化學方法一樣通過調節合成參數來精確控制無機納米材料的維度、尺寸、形狀和分散性等性質。
(ii)提高微生物合成的效率,實現大規模生產。微生物的培養到合成過程需要花費數小時甚至數天,產品數量相對物理化學方法較少,無機納米材料與細胞的分離過程也會增加處理難度,這些阻礙了無機納米材料的大規模生產。未來需要深入研究穩定高效的無機納米材料合成方法以實現大規模生產。細胞外合成具有效率高、易分離等優勢[46],對此Moon等[168-170]設計了基于細胞外合成的生物反應器工藝并優化參數,實現了利用熱厭氧桿菌屬(Thermoanaerobacter sp.)大規模胞外合成ZnS和磁性納米顆粒,展示了微生物合成納米材料實現工業化應用的巨大前景。微生物生長繁殖速度的加快能顯著提高無機納米材料的產率,其中生物膜作為微生物活躍生長的聚集體,繁殖迅速,表面積大,分泌的生物分子量多,抗外界干擾能力強,是極具效率的合成載體[53],基于生物膜設計的生物反應器有望大幅縮短合成時間[51],但目前關于這方面的研究還較少。相比活細胞體系,無細胞提取物反應體系更加簡單、易控制和易實現分離[46],因此利用微生物無細胞提取物進行合成也是實現工業化的有效方式。此外,Chen等[71]通過基因編輯使重組大腸桿菌中的谷胱甘肽合成酶過表達,最終CdS納米顆粒的產量達到了對照組的2.5倍。細胞外合成、生物膜技術、無細胞提取物合成、基因編輯以及其他增強微生物發酵能力的技術能提高合成效率,在未來應當得到更多的研究,并通過取長補短充分發揮微生物合成無機納米材料綠色、節能的優點。
(iii)豐富微生物合成材料的種類。微生物對重金屬的解毒過程是用于合成無機納米材料常見的手段,這使得目前微生物合成的無機納米材料往往集中于金屬納米材料或CdS等半導體納米材料,對于非金屬等其他無機納米材料不易通過微生物獲得,如碳納米材料、無機鹽類。迄今為止已有許多研究者采取高溫處理的辦法將微生物細胞轉化成雜原子摻雜的碳納米材料,或者采取生物還原由GO合成石墨烯材料,這是豐富微生物合成碳納米材料種類的重要嘗試,但合成高性能碳納米材料方面的探索還不夠。微生物還具有強大的生物礦化能力,在自然界中已廣泛合成了 CaCO3、Ca3(PO4)2、CaSO4等無機礦物質[171],但利用微生物合成具有復雜成分的化合物(如鈣鈦礦納米材料等),以及含缺陷或摻雜的無機納米材料的方法仍需進一步開發。基因編輯技術同樣對于豐富無機納米材料的種類具有重要意義,如Park等[70]利用能夠表達其他來源的植物螯合肽合成酶和金屬硫蛋白的重組大腸桿菌合成了多種新型無機納米材料。開發新材料的合成方法同樣需要對微生物合成機制有著深入理解,未來應當研究各種微生物以及相應生物分子的合成特性,充分挖掘微生物體系合成某一類無機納米材料的能力,繼而舉一反三,開發出多種無機納米材料的合成方法。
總之,利用微生物體系合成無機納米材料具有廣闊的前景。細菌、真菌等微生物因自然賦予的強大生存能力成為了無機納米材料的合成工廠,并可能在催化、環境、醫學等領域發揮重要作用。但目前微生物體系合成無機納米材料這一領域的開發探索還不夠深入,還缺少實現大規模可控合成的方法設計,在機理研究、材料性質的控制、合成效率的提高、納米材料種類多樣性等方面還有許多問題亟待解決。如何利用微生物高效地合成所需無機納米材料是一個物理、化學、生物多學科交叉的問題,在未來需要各個學科的科學家共同努力解決。
- 無機化學學報的其它文章
- Effect of Promoter on the Ni-Al Alloy&the Corresponding Raney-Ni Catalyst and Hydrogenation Performance of 1,4-Butylenediol
- Hierarchically Porous Nanosized Red Phosphorus with Enhanced Photo-Oxidation and Photo-Reduction Activities
- Tb(Ⅲ)-Based Metal-Organic Framework for Simultaneously Luminescent Detection of Cu2+and Fe3+Ions
- Stretch-Induced Luminescent Changes of a Self-Healing Elastic Polymer Functionalized with Platinum Complex
- Solvent-Induced Syntheses,Crystal Structures and Magnetic Properties of Two Mononuclear Er(Ⅲ)Complexes
- Synthesis,Crystal Structures of Two Lanthanides Complexes with 2,6-Difluorobenzoic Acid

