心房顫動患者射頻消融術后晚期復發的危險因素研究
姚俊功,魯敏,孫琳
(河南大學人民醫院 心血管內科,河南 鄭州 450000)
心房顫動是常見的心律失常,我國心房顫動總發病率約為0.77%,年齡大于60歲者心房顫動發生率約為1%,75歲以上者甚至可高達10%[1]。心房顫動患者并發癥嚴重,包括血栓栓塞、腦卒中、心衰及心肌梗死等,嚴重影響患者生活質量,病死率較高。2014年AHA/ACC/HRS指南以及2016年ESC指南均依據發作的頻率及持續時間將心房顫動分為4類:陣發性房顫、持續性房顫、長程持續性房顫和永久性房顫。目前心房顫動的治療原則包括:控制心室率、轉復竇律以及防止血栓栓塞,但目前藥物治療的效果不盡人意,無法徹底根治心房顫動。對于藥物治療效果不佳的患者,2014年及2016年的心房顫動指南中均指出,對于應用抗心律失常藥物難以控制的有癥狀的陣發性房顫患者,均將導管射頻消融(radiofrequency catheter ablation,RFCA)治療作為ⅠA類推薦。對于癥狀明顯的持續性或長程持久性房顫,如果藥物治療不能改善癥狀,結合患者的意愿,經過心房顫動團隊評估風險和獲益后,可以考慮行導管消融術(Ⅱa,C)[2-3]。但心房顫動患者復發率較高,有研究表明,晚期復發率達25%~40%[4]。因此,探討房顫術后復發的危險因素就顯得尤為重要。
1 資料與方法
1.1 一般資料 選擇2017年1月至2018年1月在河南大學人民醫院首次行射頻消融治療的心房顫動患者作為研究對象,所有患者均為抗心律失常藥物無效或不能耐受藥物治療的患者。心房顫動定義及復發標準參考2014、2016年心房顫動指南以及專家共識[2-4]。排除標準:(1)有心房顫動相關病因且未糾正者;(2)有心房導管消融史者;(3)有瓣膜性心臟病、心肌病、嚴重心功能不全等器質性心臟病者;(4)有抗凝禁忌者;(5)自身免疫性疾病、慢性炎性反應及正在服用免疫抑制劑者;(6)存在肝硬化或肝炎;(7)惡性腫瘤和或進行化療的患者;(8)嚴重腎臟功能不全;(9)術前24 h經食道超聲證實存在左心耳血栓患者;(10)失訪患者。經過嚴格的納入與排除過程,總共收集170例病例。
1.2 相關定義 (1)早期復發:心房顫動射頻消融術后3個月為“空白期”,在此期間發生的房顫、房撲、房速,如持續時間>30 s,可視為早期復發。臨床研究發現,術后早期發生的房性心律失常多為一過性,可自行終止,或者延遲治愈的存在,故早期復發不能認為房顫射頻消融手術失敗[5]。(2)晚期復發:心房顫動患者經射頻消融術后3~12個月內發生的房顫、房撲、房速,如持續時間≥30 s,視為晚期復發[5]。(3)代謝綜合征(metabolic syndrome,MS):根據中華醫學會糖尿病學分會的代謝綜合征的定義,以下5項因素中具有3項或3項以上診斷為代謝綜合征。體質量指數(body mass index,BMI)≥25 kg·m-2;血壓≥130/85 mm Hg(1 mm Hg=0.133 kPa)或高血壓病史;空腹血糖≥6.1 mmol·L-1或糖尿病史;空腹甘油三酯≥1.69 mmol·L-1;高密度脂蛋白膽固醇<1.03 mmol·L-1(男)和<1.29 mmol·L-1(女)[6]。
1.3 手術方法 患者在局部麻醉狀態下進行射頻消融手術,常規法放置標測及消融電極導管,所有患者起源點均經電生理檢查確認,靜脈給予芬太尼、咪噠唑侖鎮靜鎮痛,利用Carto 三維標測建立左心房三維模型,預設消融功率為25~35 W,溫度為25~45 ℃,分別行環左、右肺靜脈消融至肺靜脈電隔離,左右上下肺靜脈電位雙向阻滯,肺靜脈電隔離。消融終點為肺靜脈電位延遲至完全消失,Carto驗證雙側肺靜脈隔離。
1.4 術后處理及隨訪 對上述患者進行電話、門診或住院隨訪,隨訪內容包括詢問是否有心房顫動相關癥狀發作、發作誘因、復發時間及術后并發癥,以患者有無心房顫動相應癥狀及當時心電圖或24小時動態心電圖結果為復發依據。根據術后3~12個月內隨訪結果將其分為晚期未復發組及晚期復發組。以當時發作時間為復發時間。栓塞風險通過CHADS2及CHA2DS2-VASc進行評分評估。
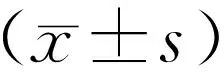
2 結果
2.1 晚期未復發組與晚期復發組臨床特征的單因素分析 納入的170例研究對象中,術后早期復發的有68例(40.0%),晚期復發的有58例(34.1%)。晚期未復發組與晚期復發組的臨床特征比較,高血壓或血壓≥130/85mm Hg、糖尿病或空腹血糖≥6.1 mmol·L-1、代謝綜合征、左房內徑、持續性房顫、病程、術后早期復發被認為與心房顫動射頻消融術后晚期復發有關(均P<0.05)。見表1。

表1 晚期未復發組與晚期復發組臨床特征的單因素分析
注:BMI—體質量指數;TG—甘油三酯;HDL-C—高密度脂蛋白膽固醇;LVEF—左心室射血分數;由于長程持續性房顫病例較少,在此將其合并在持續性房顫中統一處理。
2.2 房顫射頻消融術后復發危險因素多因素Logistic回歸分析 高血壓或血壓≥130/85 mm Hg、糖尿病或空腹血糖≥6.1 mmol·L-1、持續性房顫、病程是射頻消融術后復發的獨立危險因素(均P<0.05)。見表2。

表2 房顫射頻消融術后復發危險因素多因素Logistic回歸分析
3 討論
近年來隨著人們生活方式的改變和生活水平的提高,代謝綜合征的發病率也在逐年升高,據統計2010—2012年我國成年人代謝綜合征患病率為11.0%[7]。代謝綜合征與心血管疾病的不良預后有關,本研究證明代謝綜合征與心房顫動射頻消融術后晚期復發有關。2014年美國的一項薈萃分析,納入了23項研究,共12 924例患者(陣發性房顫為7 594例、非陣發性房顫為5 330例),得出這樣的結論:代謝綜合征與導管消融后房顫復發的風險增加有關,但對代謝綜合征及其組成因素作為房顫術后復發的危險因素還需進一步研究[8]。也就是說,究竟是代謝綜合征定義中的哪幾個因素與房顫射頻消融術后復發相關尚不明確。
本研究證實高血壓或血壓≥130/85mm Hg、糖尿病或空腹血糖≥6.1 mmol·L-1是射頻消融術后復發的危險因素。2017年韓國的一項全國性隊列研究表明,在沒有合并癥的健康亞洲人群中,高血壓前期和空腹血糖受損(impaired fasting glucose,IFG)是心房顫動的重要危險因素。具體而言,當高血壓前期(包括收縮壓和舒張壓)最終與IFG結合時,新發房顫的風險增加,尤其是BMI<25 kg·m-2組[9]。
高血壓是心房顫動射頻消融后復發的危險因素可能與血壓控制水平有關,特別是與收縮壓關系密切。2017年瑞典的一項研究發現,高血壓的血壓控制與新發房顫的風險降低有關,特別是與收縮壓控制水平關系密切,與收縮壓位于130~139 mm Hg和收縮壓<130 mm Hg相比,收縮壓≥140 mm Hg者新發房顫風險較高[10]。2018年比利時魯汶大學的一項研究發現,收縮壓是發生房顫的重要預測指標,在動態血壓監測中白天收縮壓負荷>38%的參與者發生房顫的風險顯著增加[11]。2019年韓國進行的一項全國性研究,將高血壓分為5個階段:非高血壓,高血壓前期,未藥物治療的高血壓,藥物治療<5 a的高血壓和藥物治療≥5 a的高血壓,研究發現在高血壓的5個階段中,新發房顫的發生率逐漸增加[12]。而對整個心臟而言,高血壓患者血壓越高、持續時間越長,心臟前負荷壓力過大使心房擴大,導致心房發生機械重構和電重構,加之高血壓可激活RAAS系統不僅使心臟發生機械重構與電重構,而且能產生房顫的觸發因素和基質[13]。
對于血糖水平高的患者來說,高血糖是心房顫動射頻消融術后復發的危險因素,這可能與血糖控制水平以及降糖藥物的選擇有關。2018年英國的一項薈萃分析發現,前驅糖尿病和糖尿病分別使心房顫動的風險增加了20%和28%,并且血糖升高和心房顫動之間存在劑量-反應關系[14]。同年中國臺灣地區的一項基于人群的嵌套病例對照研究發現,使用雙胍類藥物或噻唑烷二酮類藥物可能會降低新發房顫風險,而胰島素可能會增加2型糖尿病患者的新發房顫的風險[15]。對整個心臟而言,高血糖、血糖波動也能激活RAAS系統不僅使心臟發生機械重構與電重構,產生房顫的觸發因素和基質,而且糖尿病患者的心臟自主神經功能紊亂也是導致房顫合并糖尿病患者射頻消融術后房顫復發的重要機制之一[16-17]。
房顫病程、持續性房顫也是房顫射頻消融術后復發的危險因素,這可能也與房顫的機械重構和電重構有關。陣發性房顫轉為持續性房顫過程的主要機制是難以轉復的心房纖維化[18],房顫病程越長、持續時間越長,左房基質改變越明顯,左房的電重構及機械重構越重,射頻消融術后的復發率也就越高[19]。同時房顫頻繁發作使心房肌去極化導致鈣負荷增加,鈣超載是引起心房的電重構及結構重構主要原因之一[20]。
綜上所述,高血壓或血壓≥130/85 mm Hg、糖尿病或空腹血糖≥6.1 mmol·L-1、持續性房顫、病程這4個因素被認為是射頻消融術后復發的獨立危險因素。但由于本研究為單中心回顧性研究,樣本量較小,隨訪時間過短,需要進一步大樣本、多中心、前瞻性的研究加以證實。

